Водородный показатель
Ионное произведение воды.Особая роль воды в химии определяется, в частности, тем, что она широко используется для приготовления растворов и как среда для проведения реакций. Поэтому важное значение имеет собственная диссоциация воды на ионы:
 Н2О Н+ + ОН- .
Н2О Н+ + ОН- .
Константа равновесия этой обратимой реакции называется константой диссоциации (Кд): Кд = 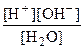 .
.
Так как [H2O] - величина постоянная ( [H2O] = 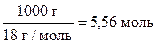 ), и мало отличающаяся от концентрации всех (диссоциировавших и недиссоциировавших) молекул воды, ее включают в константу, которую называют ионным произведением воды (Кв):
), и мало отличающаяся от концентрации всех (диссоциировавших и недиссоциировавших) молекул воды, ее включают в константу, которую называют ионным произведением воды (Кв):
Kд·[H2O] = [H+]·[OH-] = Кв,(6.21)
то есть Кд = Кв/55,56.
Ионные произведения (ИП) отличаются от константы равновесия на постоянную величину и поэтому обладают всеми свойствами константы равновесия. Например, ИП не зависят от концентраций ионов - если концентрация одного из них увеличивается, то другого - уменьшается так, что ИП остается неизменным. При 295 К ИП воды равно 10-14. Отсюда
[H+] = [OH-] = 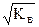 = 10-7 моль/л.
= 10-7 моль/л.
Ионное произведение, как и всякую константу равновесия, можно найти по термодинамическим данным (DG0дисс.):
Кд = exp (-DG0 дисс / RT). (6.22)
По этой формуле можно рассчитать стандартную энергию Гиббса для диссоциации воды:
lnKд = - DG0 дисс / RT; DG0 дисс = - lnKд·RT =
ln (10-14/55,56)·8,31·298 = 53565 (Дж/моль) = 53,565 кДж/моль.
Пример 18. Какова концентрация ОН--ионов в 0,01 М растворе НCl.
Решение. В 0,01 М растворе сильного электролита HCl содержится 0,01 моль/л ионов Н+. Используя выражение (6.21), получаем:
0,01.[ОН-] = 10-14; отсюда [ОН-] = 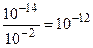 (моль/л ).
(моль/л ).
Водородный показатель рН.В соответствии с теорией электролитической диссоциации, ионы H+ являются носителями кислотных свойств, а ионы OH- - основных. Кислотность или щелочность водных растворов может быть охарактеризована концентрацией ионов [Н+] или [ОН-]. Для удобства вместо концентраций используют их отрицательные логарифмы, которые назаваются водородным (рН) и гидрокисльным (рОН) показателями, соответсвенно:
рН = - lg [H+] и pOH = - lg [OH-].
Для чистой воды [Н+] = [ОН-] = 10-7 и рН = рОН = 7. Это нейтральная среда и нейтральные растворы. Если в растворе [Н+] > [ОН-], то
рН < 7, а рОН > 7 - это кислые растворы; в случае если [Н+] < [ОН-], то рН > 7, а рОН < 7 - это щелочные растворы. Очевидно, что
pН + pOH = 14 .
Таким образом, можно сказать, что в шкале рН от 0 до 7 - кислые , а от 7 до 14 - щелочные растворы.
Концентрации ионов Н+ и ОН-, кислотность и щелочность растворов определяют либо с помощью химических индикаторов - органических веществ, которые изменяют свою окраску в определенном интервале рН, либо с помощью специальных приборов - рН-метров. Например, лакмус имеет красную окраску при рН < 5, а синюю - при рН > 8; от 5 до 8 - диапазон перехода рН. В таблице 6.4 приведены характеристики наиболее часто встречающихся индикаторов.
Таблица 8.4
Индикаторы кислотности водных растворов
| Индикатор | Интервал пере- хода рН | Окраска

 в кислой среде в щелочной
среде в кислой среде в щелочной
среде
|
| Лакмус | 5 ¸ 8 | красная синяя |
| Фенолфталеин | 8,3 ¸ 10,0 | бесцветная красная |
| Метиловый фиолетовый | 0 ¸ 3 | желто-зеленая фиол-голубая |
| Метиловый оранжевый | 3,1 ¸ 4,4 | красная желтая |
Пример 19. Определить рН и рОН 0,005 М раствора Ca(OH)2.
Решение. Так как щелочь двухосновная, то [OH-] = 2Cщелочи = 0,01 моль/л. Найдем [H+] по формуле (6.21):
Кв = [Н+]×[ОН-] = 10-14 , [H+] = 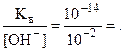 10-12 моль/л .
10-12 моль/л .
pH = -lg [H+] = -lg10-12 = 12 , рОН = Kв - pH = 14 - 12 = 2 .
Или pOH = -lg [ОH-] = -lg10-2 = 2. Раствор щелочной.
Дата добавления: 2016-07-05; просмотров: 2282;











