Окислительное фосфорилирование. Дыхательная цепь.
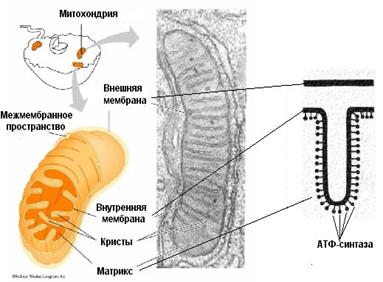
Окисление субстратов в процессе дыхания можно представить как перенос электрохимического эквивалента от органических веществ на кислород. Т.е. конечным акцептором электрохимического эквивалента является именно кислород. Доказано, что вводимый меченый кислород в последующем оказывается в составе воды. Перенос электрохимического эквивалента сложный и многостадийный процесс. Он осуществляется в специальной системе переносчиков, расположенных во внутренней мембране митохондрий и называется дыхательной цепью. Основная функция –перенос электрохимического эквивалента, т.е. окисление и сопряженные с ним процессы синтеза АТФ, т.е фософорилирование. В общем виде процесс окислительного фосфорилирования.
Главная дыхательная цепь представлена тремя белковыми комплексами, которые представляют собой интегральные белки (комплекс I, III, IV) и двумя подвижными переносчиками.
Белковые комплексы:
Ø I - NAD-дегидрогеназный комплекс представлен флавопротеинами и содержит железо в виде гема и сульфида FeS.
Ø III – комплекс цитохромов b-c1
Ø IV – комплекс цитохромов а-а3, работающий как цитохромоксидаза
Ø Подвижные переносчики представлены убихиноном и цитохромом С.
Существует несколько теорий, которые описывают работу дыхательной цепи. На сегодняшний день общепринятой является теория Митчелла, предложенная в 1961 году и названная хемиоосмотической.
Согласно этой теории процесс протекает следующим образом:
1. Электрохимический эквивалент поступает в дыхательную цепь в виде восстановленного NAD, который передает пару электронов на комплекс I, а пару протонов в межмембранное пространство.
2. Принятие двух электронов NAD – дегидрогеназой способствует присоединению к ней двух протонов водорода из матрикса, которые выталкиваются в последующем в межмембранное пространство при передачи электронов на убихинон.
3. Убихинон, переходя в восстановленную форму за счет электронов полученных от белкового комплекса I, получает возможность присоединения из внутримитохондриального матрикса пары протонов, которые и выталкивает в межмембранное пространство. Электроны же передаются на комплекс цитохромов b-c1
4. Белковый комплекс III передает электроны на цитохром С, котрый несет их комплексу IV, который функционирует как цитохромоксидаза и имеет большое сродство к кислороду.
5. Комплекс IV передает пару электронов на кислород, который связывается с протонами водорода матрикса с образованием воды.
Последовательный переход электронов по цепочке возможен только при наличии разности потенциалов. т.е. электродный потенциал предыдущего переносчика должен быть меньше, чем последующего. Общая разность потенциалов начиная от NAD и заканчивая О2 составляет 1.44 В, что соответствует 220 кДж энергии в пересчете на каждую пару электронов.
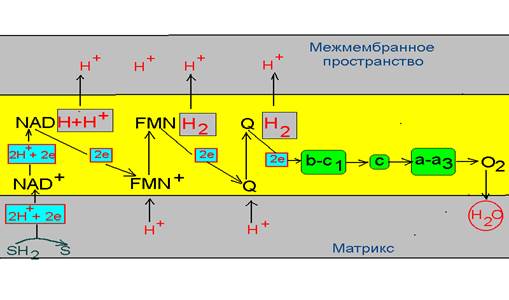 |
Однако, наиболее выражена разность потенциалов только в трех участках дыхательной цепи, а именно в местах где протоны переходят в межмембранное пространство, т.е. на участках NAD ---комплекс I, комплекс I – убихинон и комплекс IV ---- кислород. Возможно, что энергия, выделяющаяся в этих участках, трансформируется в энергию переноса протонов и создание трансмембранного водородного потенциала.
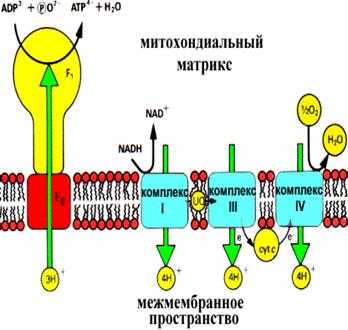
Концентрация протонов в межмембранном пространстве значительно больше, чем в матриксе митохондрий. Как показывают данные экспериментов значение рН в межмембранном пространстве на 1,4 ниже, чем в матриксе. Сама мембрана непроницаемая для протонов водорода, однако терминальный конец дыхательный цепи сопряжен с комплексом белков, которые работают как переносчики их в матрикс. Этот комплекс состоит из двух компонентов: фактор F1 – обращен к матриксу и представляет собой АТФ-синтетазу и фактор F0. – протонный канал – обеспечивает транспорт протонов по градиенту
концентраций.
АТФ-синтаза присутствует в "энергетических станциях" растительных и животных клеток.
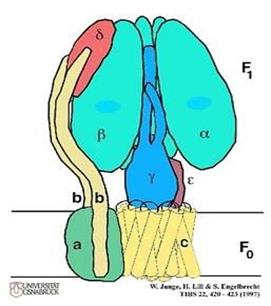
АТФ-синтетаза является универсальным компонентом сопрягающих мембран и располагается в митохондриях, хлоропластах, фотосинтезирующих и дышащих бактериях. Ее можно увидеть в электронный микроскоп, на электронных снимках комплексы выглядят как грибовидные выросты, состоящие из 2 субкомплексов: F0 и F1.
| 
|
Фермент АТФ-синтетаза представляет собой встроенное во внутреннюю мембрану грибовидное тельце с каналом в центре. Он составляет около 15% всего белка внутренней митохондриальной мембраны. Аденозинтрифосфатсинта́за— класс ферментов, синтезирующих аденозинтрифосфат (АТФ) из аденозиндифосфата (АДФ) и неорганических фосфатов с затратами энергии. Эту энергию АТФ-синтаза часто получает от протонов, проходящих по электрохимическому градиенту, например из просвета хлоропласта в его строму, или же из межмембранного пространства в матрикс митохондрии. Реакция синтеза такова:
АДФ+Фн →АТФ+H2O
АТФ-синтазы очень важны для жизнедеятельности почти всех организмов, так как АТФ — основная внутриклеточная «энергетическая валюта». Антибиотик олигомицин подавляет активность FO-компонента АТФ-синтазы.
Дата добавления: 2016-06-29; просмотров: 2698;











