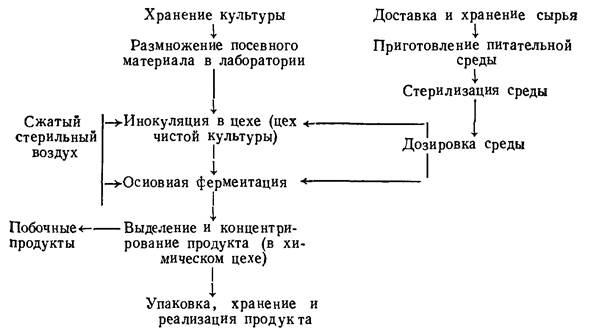
Характеристика этапов
Хотя для получения продуктов микробиологического синтеза применяются различные культуры микроорганизмов и используются разные питательные среды и режимы культивирования, тем не менее процессы синтеза имеют общую структуру. Это видно из приведенной ниже схемы:
Приготовление и стерилизация питательной среды. Для выращивания микроорганизмов в цехе чистой культуры и в цехе основной ферментации необходима стерильная питательная среда. Это делают в сырьевом или рецептурном цехе. Среду готовят по периодическому или непрерывному методу. В отдельных случаях приготовление и стерилизация среды осуществляются прямо в ферментаторе. На современных микробиологических предприятиях все чаще используют непрерывный метод приготовления среды (рис. 4.15). Для этого используют два резервуара: в один вводят исходные вещества, а из другого жидкость идет в смеситель непрерывного действия. Из него среда при помощи насоса подается в колонну стерилизации и на выдерживание, а затем — в охладитель.
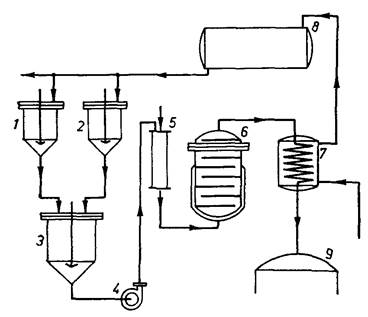
Рисунок 4.15 – Схема непрерывного приготовления питательной среды:
1 и 2 – резервуары для растворения исходных веществ, 3 – резервуар для смешивания растворов, 4 – насос для передачи среды, 5 – колонна или инжектор для нагрева среды паром, 6 – закрытый сосуд для стерилизации, 7 – охладитель, 8 – резервуар для спуска нагретой воды, 9 – ферментор
Выбор аппаратуры и технологии приготовления питательной среды зависит от количества и вида компонентов. Компоненты растворяют в подогретой или горячей воде. Если с точки зрения совместимости и стерилизации это возможно, то все они могут быть растворены в одном реакторе. В противном случае компоненты растворяют по группам и затем соединяют в смесителе. Если среду стерилизуют периодически паром или при помощи теплообменника, надо довести весь объем питательной среды до 120°С и после этого по меньшей мере час выдержать при 120— 124°С. Затем среду охлаждают до 29—30°С.
При непрерывной стерилизации нагревание среды до температуры стерилизации, выдерживание при этой температуре и охлаждение происходят в потоке. Прямая подача пара в среду разбавляет ее на 10—20%, это надо учитывать при приготовлении среды. При работе с колонками используют пар давлением 0,5 МПа (5 кгс/см2). Скорость потока среды в колонке зависит от состава и температуры.
В кожух выдерживателя вводят пар давлением 0,25 МПа (2,5 кгс/см2). Длительность выдерживания (5—7 мин) зависит от состава и свойств питательной среды. Температура среды, вытекающей из выдерживателя, 124—130°С.
Приготавливая среду, надо следить, чтобы в процессе стерилизации не происходили нежелательные реакций (карамелизация, образование меланоидинов). Если в цехах чистой культуры и основной ферментации работают с разными средами, то необходимо иметь две и более линий для приготовления питательных сред. В цехе приготовления среды необходимо иметь различную измерительную аппаратуру (весы, мерную посуду, дозаторы), аппаратуру для растворения вискозных и твердых веществ, снабженную мешалками (обычные реакторы), центрифуги для осветления растворов (кларификаторы), устройства для декантации и др.
Хранение культуры и размножение посевного материала в лаборатории. Культуры микроорганизмов — продуцентов веществ— заводы получают из институтов (коллекции культур) в пробирках на косом агаре или в ампулах, законсервированными в виде чистых культур. Каждая культура имеет паспорт с подробным описанием морфологии, физиологии, характеристики среды для культивирования и хранения культуры.
При длительном хранении культуры важно сохранить ее свойства. При частом пересеве она со временем может изменять свойства — уменьшается продуктивность, появляется гетерогенность культуры, — т. е. различные варианты культуры с отличающейся морфологией и физиологией.
В гомогенности или гетерогенности культуры можно убедиться, высевая ее на твердую питательную среду и изучая морфологические и физиологические свойства колоний.
Чтобы сохранить свойства культуры без изменений, ее надо хранить в соответствующих условиях. В основе хранения культур лежит охлаждение, замораживание или обезвоживание.
Во всех этих случаях ограничивается или даже прекращается клеточный обмен веществ. Иногда (при замораживании и обезвоживании) клетки приводят в состояние анабиоза или преданабиоза.
На практике культуры хранят различными способами;
– на косом агаре при низкой температуре (1 - 5°С) можно хранить культуру 1—2 мес, а иногда и дольше;
– замораживание и хранение при температуре ниже —20°С позволяет сохранить культуру в течение нескольких месяцев. Не желательно многократное оттаивание и замораживание;
– на твердых средах под слоем стерильного парафина или минерального масла можно хранить дрожжи, плесневые грибы. Менее пригоден этот способ для хранения актиномицетов. Слой масла над поверхностью косого агара должен быть не менее 1 см. Масло предохраняет культуру от высыхания и доступа кислорода;
– на агаре без добавления питательных веществ (допускаются очень незначительные добавки питательных веществ) хранят актиномицеты;
– при лиофилизации культуру замораживают при температуре до —80°С (обычно при —30°С) и подвергают сублимации в вакууме (остаточное давление 6—130 кПа). Для предохранения клеток от инактивации используют защитные среды (сыворотка крови, бульон, сахароза, смесь песка и глины и др.). Лиофилизированную чистую культуру в ампулах хранят в течение нескольких лет;
– хранение в стерильной смеси песка и глины заключается в следующем. Нанесенные на эту смесь микроорганизмы или суспензию спор сушат при комнатной температуре и при такой же температуре хранят в посуде, закрытой ватной пробкой;
– консервация спор (актиномицеты) в песке. Около 1,0 г стерильного песка насыпают в пробирку, высевают туда же споры и сушат их в эксикаторе над силикагелем или хлористым кальцием. После сушки пробирки герметично закрывают пробками и заливают парафином.
Через определенное время, специфичное для каждого вида хранения, культуру пересевают.
Перед началом технологического процесса культуру размножают в лаборатории в стерильных условиях при оптимальном составе среды и режиме выращивания (рН, температура, длительность). С поверхности косого агара культуру стерильно переносят в колбы объемом 100—200 мл и инкубируют в термостате или на качалке в зависимости от потребности культуры в кислороде. В производстве дрожжей для этого используют, например, колбы Пастера (0,45 л), затем колбы Карлсберга (4,5 л). Длительность каждой стадии выращивания 24 ч. На этом этапе дрожжи растут на полноценной среде — 10%-ном солодовом сусле. Содержимое колб Карлсберга используют в качестве посевного материала для первого инокулятора цеха чистой культуры. Однако последовательность стадий не всегда одинакова. В производстве аминокислот, например лизина, в цех чистой культуры поступает посевной материал, полученный из колб на качалке.
Иногда для уменьшения опасности заражения инфекцией в инокулятор культуру вносят прямо из пробирок. При этом длительность инокуляции увеличивается.
В производстве антибиотиков часто используют споровый материал. При этом в лабораторных условиях культуру размножают двумя способами:
– культуру продуцента высевают на косой агар, инкубируют до образования спор и смывают их стерильной водой. Суспензию спор снова переносят в свежую агаризированную среду для получения спорового материала второго поколения. Выросшие споры еще раз смывают стерильной водой и суспензию используют для получения первого вегетативного поколения продуцента на жидкой среде;
– как и в первом случае, культуру продуцента высевают на агаризованную среду для получения спор. Полученную суспензию спор сразу же вносят в колбы с жидкой средой и выращивают их на качалке. Полученный таким образом вегетативный материал продуцента первого поколения используют в качестве посевного материала для второго поколения продуцента в колбах с жидкой средой. Вегетативный материал второго поколения используют для внесения в инокулятор. Для размножения спорового материала широко используют среды на сыпучем материале— зерне, крупе, лузге и др.
Для получения спор многих продуцентов антибиотиков часто используют среду из зерен проса. Споровый материал с таких сред можно засевать прямо в инокулятор, минуя размножение на жидкой среде в колбах. Иногда в лабораторной практике культуру продуцента начинают размножать сразу на жидкой среде в колбах, исключая предварительное получение спор.
Для обеспечения стабильного выхода активных веществ в производственных условиях надо создать достаточный запас культуры продуцента на длительный период времени (год и более), но нельзя часто менять технологию приготовления посевного материала.
Получение посевного материала в цехе чистой культуры.Дальнейшее размножение посевного материала обычно идет в две стадии: в цехе чистой культуры и в отделе инокуляции. Аппараты первой стадии часто называют инокуляторами, аппараты второй стадии — посевными ферментаторами.
Схема приготовления посевного материала из споровых культур на предприятиях по производству антибиотиков показана на рисунке 4.16.
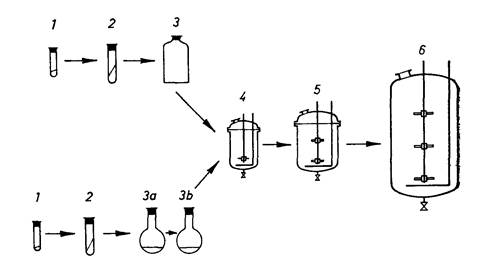
Рисунок 4.16 – Схема приготовления посевного материала:
1 – законсервированный штамм продуцента, 2 – первое поколение на косом агаре в пробирке с образованием спор, 3 – второе поколение на твердой среде в колбах с образованием спор, 3а и 3б – первое и второе поколение на жидкой среде в колбах, 4 – инокулятор, 5 – посевной ферментатор, 6 – ферментатор
Для приготовления посевного материала используют полноценную среду, тщательно проверенную различными химическими и микробиологическими методами. Количество питательной среды в аппарате не должно превышать 60% общего объема. Если культуру в инокулятор вносят из колб, то количество посевного материала составляет примерно 0,1% объема среды. Такое небольшое количество посевного материала требует длительного периода инокуляции (2—4 сут). Для посевных ферментаторов используют 10—12% инокулята, поэтому продолжительность приготовления посевного материала на этой стадии уменьшается и обычно не превышает 1 сут. Во время приготовления посевного материала надо следить, чтобы в аппаратах был оптимальный режим культивирования. Три раза в сутки отбирают образцы для микробиологического и биохимического анализов. Посевной материал для главной ферментации готовят в количестве 5—20% объема используемой питательной среды.
Главная ферментация. Обычно она протекает в ферментаторах большого объема. Для стерильной ферментации широко используют аппараты объемом 50м3 с механическими мешалками. Перед заполнением аппарата средой его моют, проверяют на герметичность, стерилизуют горячим паром как сам ферментатор, так и систему трубопроводов. Для обеспечения стерильности ферментатора часто применяют предварительную обработку его химическими дезинфицирующими веществами (этот процесс проводят непосредственно перед обработкой горячим паром). После этого его заполняют стерильной охлажденной питательной средой. Количество среды в ферментаторе не должно превышать 70% его общего объема. Затем по линии посевного материала с помощью стерильного воздуха в ферментатор вводят посевной материал. Уже перед его подачей температура и рН питательной среды должны быть доведены до оптимальных значений для данной культуры. Соответственно регулируют интенсивность аэрации и перемешивания среды. Для предотвращения попадания нестерильного атмосферного воздуха в аппарат давление воздуха над поверхностью жидкости повышают на 20— 30 кПа (0,2—0,3 кгс/см2). В пространстве над жидкостью обычно скапливается пена. Если ее слой сильно увеличивается, то в аппарат вводятся химические пеногасители. Во время ферментации автоматически регулируется температура и рН среды, в случае необходимости добавляют растворы кислоты или щелочи. По специальному графику берут образцы жидкости из ферментатора для биохимического и микробиологического контроля. При получении активных веществ методом периодической ферментации различают два этапа.
На первом этапе идет интенсивное размножение культуры. Она проходит через все характерные фазы развития. На этом этапе компоненты питательной среды используются главным образом на получение энергии и конструктивный обмен веществ — происходит постепенная ассимиляция источников углерода и азотсодержащих веществ, в среде накапливаются продукты окисления углеводов, например кислоты.
На втором этапе происходит интенсивный синтез нужного метаболита (иногда он идет параллельно процессу роста культуры), наблюдается старение клеток и их автолиз.
Ферментацию прекращают, когда в среде накапливается максимальное количество полезного продукта. Конец ферментации можно определить и микробиологически по морфологическим изменениям клеток продуцента. Окончив ферментацию, культуральную жидкость охлаждают до 10—15°С и перекачивают в резервуары, из которых она постепенно подается на дальнейшую обработку.
Выделение продукта из культуральной жидкости. В состав культуральной жидкости входят остатки использованной питательной среды, синтезированные метаболиты и клеточная масса продуцента. В наиболее простом случае всю культуральную жидкость можно использовать как готовый продукт, например при получении бактериальных удобрений, если их применяют в жидком виде. В спиртовой промышленности амилолитические ферменты плесневых грибов иногда используют в жидком виде. При производстве витаминных и аминокислотных концентратов для нужд животноводства иногда используются все продукты ферментации. В таких случаях культуральную жидкость упаривают в вакуум-аппаратах и сушат в сушилках распылительного типа.
В производстве дрожжей, бактериальных удобрений и средств для защиты растений полезным продуктом является клеточная масса микроорганизмов.
Для выделения биомассы используют сепараторы, осадительные центрифуги, фнльтр-прессы, вакуум-фильтры или отстойники. Иногда биомассу осаждают добавлением электролитов (FеС13), надосадочную жидкость декантируют. После центрифугирования биомассу получают в виде густой жидкости или пасты 75—90%-ной влажности. Клеточную массу промывают, фильтруют, сушат, гидролизуют, экстрагируют из нее нужный продукт и т. д. Если активное вещество находится в растворе, то биомассу используют после отделения как побочный продукт, а нужное вещество выделяют из раствора различными химическими или физическими методами:
– отгонка спиртов и органических растворителей;
– осаждение кислот в виде солей;
– выделение аминокислот с помощью ионитов, с последующей элюцией, упариванием элюата и кристаллизацией;
– антибиотики выделяют, осаждая в виде малорастворимых солей из водного раствора, где они предварительно максимально концентрируются путем экстракции или ионообменным путем, а также высушивая водные растворы лиофилизацией или в сушилках распылительного типа.
Допустимо производство нескольких препаратов микробного происхождения на одном предприятии и даже в одном цехе только в том случае, если они не являются антагонистами. Надо избегать соседства с производством культур, образующих споры, если продуцент основного вещества является бесспоровым микроорганизмом. При организации производства надо изолировать отдел обработки сухой активной биомассы во избежание ее распространения в виде пыли. На предприятиях микробиологического синтеза можно обеспечить высокие экономические показатели и выпуск продукции высокого качества только прн наличии отличных санитарных условий и высокой культуры производства. Регулярная чистка аппаратуры и коммуникаций, стерилизация, светлые тона окраски стен и аппаратуры, гладкие поверхности, кондиционированный воздух, безукоризненно чистая спецодежда рабочих — таким должно быть современное предприятие микробиологического синтеза.
Дата добавления: 2018-11-26; просмотров: 905;










