Основные стадии и показатели роста микроорганизмов
Организация любого микробиологического процесса синтеза практически важных веществ начинается с изучения физиологии продуцента.
Необходимо изучить характер питания продуцента, а также влияние внешних факторов на состояние клеток и популяций. Вопросы эти выясняются путем оптимизации исследуемого процесса. Основой для этого является культивирование микроорганизмов в контролируемых и управляемых условиях.
Оптимизация давно существующих промышленных процессов начиналась с эмпирического подбора условий методом «проб и ошибок». При большой затрате времени и труда в конечном итоге устанавливали состав сред и режим культивирования, наиболее приемлемые экономически и, которые в дальнейшем также эмпирически возможно совершенствовать при ведении процесса в промышленном масштабе.
Долгое время не существовало иного способа культивирования микроорганизмов в лаборатории, кроме периодического: засев — размножение продуцента —- съем выросшей культуры и выделение нужного продукта из клеток или из среды.
В промышленности с давних пор существовали и другие способы культивирования микроорганизмов: непрерывно-проточный метод получения этилового спирта из мелассы и проточный метод получения уксуса из спирта при помощи бактерии, иммобилизованных на твердой фазе — древесных стружках. Эти методы пришли в лабораторную практику на десятилетия позже, когда появились новые технические возможности и новые взгляды на проблемы культивирования микроорганизмов.
По мере развития технологии производства, изучения физиологии и биохимии микроорганизмов методы их культивирования в лаборатории и в промышленности совершенствовались и видоизменялись. Многие технологические приемы проведения химических реакций оказались пригодными для микробиологических процессов, прежде всего проведения их в реакторах — ферментерах со всем необходимым для этого оснащением. Существует ряд методов культивирования микроорганизмов, применяемых на лабораторном этапе разработки промышленного процесса, а затем ведутся в укрупненном масштабе в емкостях среднего размера (десятки литров) и, наконец,— в крупномасштабном варианте, в емкостях в сотни кубометров. Все методы культивирования микроорганизмов делятся на периодические и непрерывные.
Периодическое культивирование - начало изучения микробиологического синтеза. Изучение процесса микробного биосинтеза обычно начинается с исследования динамики роста периодической культуры. Цикл развития периодической культуры (не имеющей аналогии с циклом развития многоклеточного организма) начинается с засева среды. Засев осуществляется в таком количестве, которое обеспечивает начало роста микроорганизмов с минимальной задержкой или даже без лаг-фазы. Лаг-фаза мало дает для понимания хода биосинтеза, ее наличие свидетельствует только о недостаточно хорошем качестве и количестве посевного материала или о неоптимальности условий для роста. Для многих микробиологических процессов активный «омоложенный» посевной материал применяют в количестве около 2% от объема среды.
Прослеживают ход накопления биомассы и интересующего продукта, а также потребление исходного основного сырья, обычно углеродного. Для этого отбирают пробы развивающейся культуры с частотой, позволяющей уловить фазы экспоненциального роста, и заканчивают наблюдения после остановки роста (рис. 4.1) и накопления максимума целевого продукта. Полученные кривые роста и накопления продукта показывают, является ли его образование связанным с ростом биомассы, т. е. первичным, или это процесс второй фазы, когда рост заторможен, по выросшая биомасса может перерабатывать оставшийся недоиспользованным субстрат. Бывают, однако, случаи, когда интересующий продукт второй фазы начинает синтезироваться еще в фазу роста, так что подразделение процессов на одно- и двухфазные не носит абсолютного характера.
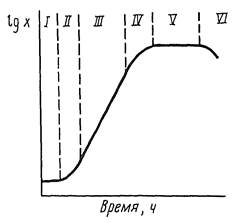
Рисунок 4.1 – Кривая роста микроорганизмов в полулогарифмическом масштабе: х – концентрация биомассы, I – лаг-фаза, II – фаза ускорения роста, III – экспотенциальная фаза, IV – фаза замедления роста, V – стационарная фаза, VI – фаза отмирания
Наличие вторичных продуктов (метаболитов) в отличие от первичных в большинстве своем для жизни продуцента необязательно. Они образуются в том случае, когда состав среды таков, что для дальнейшего роста биомассы каких-либо компонентов начинает недоставать, но живые клетки способны синтезировать некоторые вещества и в среде имеются материалы для этого. Иногда вторичный биосинтез связан с видоизменением нормального роста клеток из-за лимитирования или ингибировапия. Среди вторичных продуктов встречаются искаженные вещества клеточной оболочки, предшественники веществ, входящих в состав спор, производные аминокислот, пептидов, углеводов, нуклеотидов, а иногда их сложные комплексы. Типичными продуктами конструктивного метаболизма второй фазы роста культур являются антибиотики. Вторичными могут быть и продукты энергетического метаболизма. Например, у некоторых бродильных микроорганизмов продуктами первичного метаболизма углеводов часто являются органические кислоты, но при ингибировапии роста создающимися экстремально кислыми условиями среды вместо них образуются нейтральные вещества - спирты, кетоны, которые часто и являются целевыми продуктами.
Во вторую фазу могут осуществляться и сверхсинтезы продуктов первой фазы роста культур, часто бесполезные в это время для самого продуцента. Состав среды может быть таким, что вещества, необходимые для нормального роста микроорганизмов, исчерпываются, но имеются субстраты и активные ферменты, участвующие в синтезе тех или иных продуктов нормального метаболизма первой фазы. Такими являются, например, витамины.
Способность к сверхсинтезам продуктов второй фазы особенно сильно выражена у специально полученных мутантов; последние имеют изменения в генетическом аппарате, препятствующие нормальному метаболизму. В результате реакции отклоняются в сторону обильного накопления веществ, необходимых клетке лишь в небольшом количестве. Среди них встречаются практически ценные продукты. Кроме генетического контроля вторичного синтеза и сверхсинтеза огромное значение имеет физиологический контроль, или управление метаболизмом популяций.
Биохимические механизмы изменения метаболизма обусловлены репрессией и депрессией синтеза определенных ферментов или изменением их активности. Эти изменения часто в наибольшей степени выражены в среде, не оптимальной для роста, но оптимальной для биосинтеза определенного продукта. Для этого некоторые компоненты среды должны быть в недостатке, чтобы основное исходное сырье перерабатывалось биомассой в целевой продукт.
До недавнего времени лимитирующие рост факторы выявлялись только путем эмпирического поиска и обнаруживались случайно. Так установлено, что многие антибиотики, образуемые актиномицетами, синтезируются при лимитации роста продуцентов недостатком фосфата, для биосинтеза пенициллина требуется лимитация роста культур глюкозой, а для грамицидина С — молекулярным кислородом. Целенаправленные поиски факторов, необходимых для каждого процесса, лимитирующего или ингибирующего рост продуцентов, значительно сокращают подбор оптимальных условий для их биосинтеза. После получения заданного количества биомассы в условиях, оптимальных для роста культур, добавки элементов питания (кроме лимитирующего), обеспечивающие синтез продукта, могут продлить его образование.
Большинство промышленных микробиологических процессов ведут на сложных средах, часто используя отходы других производств или сельского хозяйства из-за их дешевизны. Естественно, что и в лабораторных условиях процесс отрабатывается на тех же средах. На сложных средах можно определить фазу наиболее активного биосинтеза целевого продукта, его скорость, продуктивность процесса, выявить оптимальную температуру, рН, степень аэрации. Для оптимизации роста микроорганизмов и получения продуктов первой фазы этого достаточно. Но на сложных средах невозможно выявить лимитирующие рост культур компоненты питания: источники углерода, азота, фосфора, витамины и др., недостаток которых приводит к синтезу вторичных метаболитов. Этот вопрос можно решить только на синтетических или полусинтетических средах. Если микроорганизмам необходимы витамины или аминокислоты, то их вносят в среду в небольших количествах, например, в виде автолизата или экстракта дрожжей, содержащих почти все необходимые витамины и аминокислоты. Если продуцент растет при небольших добавках дрожжевого автолизата, например, в пределах 0,2 г/л и рост возможен за счет потребления минеральных соединений азота (аммония или нитрата), то автолизат можно рассматривать как источник витаминов. Если же автолизат дрожжей требуется в больших количествах, а минеральные соединения азота не используются, то организм, следовательно, нуждается в готовых аминокислотах и (или) других органических веществах.
Применяя набор синтетических сред с заранее предусмотренным ограничением роста культур микроорганизмов известным компонентом, выявляют нужный для данного биосинтеза лимитирующий или ингибирующий фактор и нужные концентрации других компонентов, чтобы они не были в недостатке.
Если потребности микроорганизма неизвестны, то оптимизация условий питания и понимание физиологии продуцента затруднено. Полезно применение методов математического планирования экспериментов. Они ускоряют поиск оптимальных условий, но не заменяют собой изучение физиологии питания продуцента для понимания его потребностей в условиях роста и биосинтеза целевых продуктов.
Непрерывное культивирование микроорганизмов. Метод проточного непрерывного культивирования пришел в микробиологию из химической технологии. Принцип проточного культивирования состоит в том, что в сосуд, где размножаются микроорганизмы, непрерывно подается свежая питательная среда и одновременно вытекает такой же объем культуры. По такому принципу организуются две разновидности процессов непрерывного культивирования: процесс полного вытеснения и процесс полного смешения.
Непрерывные процессы имеют значительные преимущества перед периодическими: возможность специализации аппаратуры для каждой операции (стадии) непрерывного процесса, стабилизации его во времени, улучшение качества продукта, легкость регулировки и, главное, возможность автоматизации. Этими преимуществами объясняется тенденция микробиологов к переходу от периодических процессов к непрерывным.
Процесс полного вытеснения. Сосуд для выращивания микроорганизмов (трубчатый ферментер) представляет собой трубку, расположенную горизонтально или вертикально, в которую втекают среда и посевной материал и вытекает культура (рис. 4.2). Перемешивания не производится. Так можно культивировать микроорганизмы, не требующие аэрации. С одного конца ферментера подаются среда и посевной материал, популяция находится в начале своего развития. По ходу трубки культура «стареет», субстрат исчерпывается, накапливаются продукты метаболизма и вытекающая культура находится в состоянии, аналогичном стационарной фазе роста периодической культуры. Таким образом, в ферментере воспроизводится полная кривая роста, но не во времени, а в пространстве.

Рисунок 4.2 – Трубчатый ферментер полного вытеснения:
S0 – концентрация субстрата в поступающей среде, S – концентрация субстрата в вытекающей среде, X0 – начальная концентрация биомассы,
X – концентрация вытекающей биомассы
В настоящее время появились ферментационные аппараты, обеспечивающие процессы с режимом, приближающимся к полному вытеснению и при аэробном культивировании. Это вращающиеся трубчатые реакторы с насадкой или внутренними аэрирующими элементами, а также многосекционные колонные аппараты.
Процесс полного вытеснения применяется в промышленности в тех случаях, когда желательно избежать потери времени па опорожнение, стерилизацию и заполнение емкости. Его применяют в пищевой промышленности, когда используются сложные среды и стоит задача наиболее экономично провести процесс, аналогичный тому, который ведется в периодическом режиме.
Пример практического применения трубчатого ферментера — анаэробная стадия при производстве пива в башенных проточных емкостях. В этом случае не требуется аэрирования и процесс идет без перемешивания. Если этот процесс аэробный, то его ведут в батарее аэрируемых ферментеров (рис. 4.3). При этом кривая роста периодической культуры распределяется но ходу батареи.
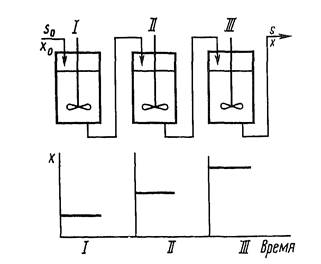
Рисунок 4.3 – Рост микроорганизмов в батарее аэрируемых ферментеров
(I – III). Обозначения на рисунке 2
Процесс полного смешения. В процессе полного смешения рост культур происходит в емкости — ферментере при интенсивном перемешивании. Перемешивание достигается продуванием воздуха или работой мешалки (или тем и другим одновременно). Во всей массе культуры условия должны быть совершенно одинаковыми. Этот метод культивирования получил название гомогенно-непрерывного. В ферментере создаются условия, соответствующие одной точке кривой роста культуры. При больших потоках среды эти условия близки к быстрому экспоненциальному росту, при малых -- приближаются к условиям стационарной фазы роста культур. При таком методе может быть воспроизведена любая точка роста периодической культуры — от начала замедления роста после экспоненциальной фазы и до конца стадии замедления роста. В установившемся режиме скорость потока среды, отнесенная к единице объема культуры в ферментере, называется коэффициентом разбавления D. Она равняется удельной скорости роста µ. При этом культура находится в устойчивом стационарном состоянии (динамическое равновесие, D = µ) и обладает способностью самопроизвольно автоматически подстраиваться к изменениям условий.
Если условия изменятся таким образом, что рост ускорится, то в ферментере повысится концентрация биомассы (х) и понизится концентрация субстрата (s). Если рост замедлится, концентрация биомассы понизится, а остаточное содержание лимитирующего рост субстрата повысится.
Если изменения условий временные, то при возвращении к исходным установится исходное стационарное состояние. На изменения скорости потока культура реагирует соответствующим изменением концентрации биомассы и остаточной концентрации субстрата, ограничивающей рост, не выходя из стационарного состояния. При неизменности условий проточные культуры способны к полной воспроизводимости концентрации биомассы. Но при таком способе культивирования нельзя получить устойчивого состояния только при максимальной скорости роста. Повышение скорости потока или взаимодействие, замедляющее рост, приводит к тому, что скорость роста (µ) окажется меньше коэффициента разбавления (D) и культура вымоется из ферментера. Воспроизведение в потоке определенной точки кривой роста культур широко применяется в промышленности при наращивании биомассы микроорганизмов. Хорошо отработанный периодический процесс выращивания экономически выгодно воспроизводить в проточном варианте, так как культура непрерывно находится в состоянии максимальной активности нужного процесса, не тратится время на освобождение, заполнение емкостей и на лаг-фазу.
При наращивании биомассы в проточных условиях процесс стремятся вести при возможно большей скорости потока, но не настолько большой, чтобы в среде оставался недоиспользованный субстрат. Ограничивающим фактором часто является интенсивность аэрации. Из-за слабой растворимости молекулярного кислорода следует применять только такую концентрацию субстрата, которая может быть использована при доступной для данной аппаратуры степени аэрирования. При необходимости переработать высокие концентрации субстрата применяется батарея ферментеров, в каждом из которых успевает использоваться только его часть. Чем выше концентрация субстрата, тем больше ферментеров необходимо иметь в батарее. При всех процессах, связанных с фазой роста культур, считается целесообразным применение проточного культивирования, как более экономичного с технологической точки зрения.
Если периодический процесс идет без учета действия лимитирующих и ингибирующих факторов, то эта неопределенность останется и при переводе его на непрерывный режим. При разных скоростях потока рост культур может быть ограничен разными факторами. Недостаток одного компонента питания при одной скорости роста может смениться недостатком другого компонента при другой скорости и притом без ведома экспериментатора. При наращивании биомассы на сложных средах иногда нет необходимости выявлять смену лимитирующих факторов при разных скоростях потока. Это возможно в тех случаях, когда хотят воспроизвести в проточных условиях хорошо отработанный периодический процесс.
Хемостатное культивирование. Хемостатное культивирование — это вариант гомогенного проточного культивирования с заданным желаемым коэффициентом разбавления (D), к которому подстраивается скорость роста культур (µ). Последняя может быть минимальной или близкой к максимальной. При этом задается также фактор, который обусловливает ограничение концентрации вырастающей биомассы. Концентрация биомассы определяется одним определенным компонентом питания. При низком коэффициенте разбавления лимитация, т. е. голодание, будет сильной, при высоком — слабой. То же наблюдается и в отношении отравления микроорганизмов ингибиторами: при низком коэффициенте разбавления клетки долго соприкасаются с ингибитором и бывают сильно отравлены, при высоком они недолго пребывают в ферментере и отравлены в слабой степени. Однако при высокой скорости роста клетки могут быть более чувствительны к ингибитору.
Хемостатный метод культивирования незаменим в лабораторных исследованиях физиологии микроорганизмов и клеток тканей. В промышленности он применяется при наращивании микробной биомассы, если известно, какой именно фактор ограничивает рост.
Варианты хемостатного культивирования. Хемостатный метод имеет большое количество вариантов. Одностадийное культивирование применяется при необходимости воспроизвести любую скорость роста культур, кроме максимальной. Двухстадийное культивирование в двух последовательных ферментерах позволяет наблюдать культуры при максимальной скорости роста и создать условия для ее превышения. Для этого в первом ферментере ведется культивирование при D<µm, а во второй подается культура из первого и добавляется свежая среда (рис. 4.4). Во втором ферментере происходит повышение скорости протока вплоть до превышения µm, а вымывания не происходит, так как из первого ферментера непрерывно поступает культура.
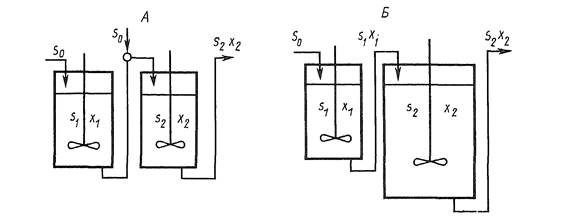
Рисунок 4.4 – Двухстадийный хемостат с дополнительной подачей во вторую стадию (А); двухстадийный хемостат (Б):
S0 – концентрация субстрата в подаваемой среде, S1 – в первом ферментере, S2 – во втором ферментере, X1 – концентрация клеток в первом ферментере, X2 – во втором ферментере
Максимальная скорость роста может быть достигнута при турбидостаточиом методе регулирования, который является вариантом хемостатного, в этом случае скорость потока среды устанавливается не экспериментатором, а автоматически, по сигналу датчика, регистрирующего концентрацию клеток. Для этого ферментер должен иметь устройство для нефелометрического измерения мутности, зависящей от концентрации клеток (х) и для регулирования скорости потока среды так, чтобы х оставалось постоянным. Этот метод культивирования позволяет поддерживать культуру в устойчивом состоянии па границе вымывания из ферментера, так как при снижении концентрации клеток перестает подаваться среда. Турбидостат дает возможность изучать влияние внешних факторов па максимальную скорость роста культур и на состояние клеток при этом (рис. 4.5).
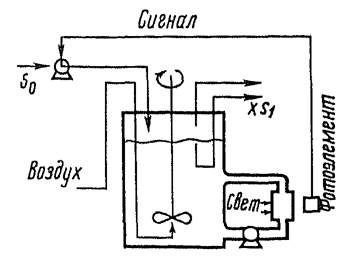
Рисунок 4.5 – Схема турбидостата. Подача среды осуществляется по «команде» нефелометра, измеряющего концентрацию клеток в контуре, по которому насосом прокачивается культура из ферментера:
S0 – концентрация субстрата в подаваемой среде, S1 – в первом ферментере, S2 – концентрация субстрата в вытекающей культуре, X – концентрация клеток
Сигналом для подачи среды может быть не только плотность (мутность), но и любой параметр среды, измеряемый электродом или другим устройством, переводящим величину измеряемого параметра в величину электрического потенциала. Последний усиливается и приводит в действие работу насоса, подающего раствор или питательную среду. Для процессов культивирования, имеющих прямую связь между приростом биомассы и изменением значения рН среды (например, при потреблении физиологически кислого соединения азота), используется рН-статный способ управления скоростью потока среды. Скорость потока с помощью автоматических устройств уравнивается со скоростью изменения рН растущей популяцией, а следовательно, и со скоростью роста культур. Это обеспечивает поддержание рН па заданном уровне, а скорость роста является максимальной в данных условиях. Изменяя условия, можно проследить за соответствующими изменениями максимальной скорости роста культур.
В двухстадийиой системе можно воспроизвести во втором ферментере вторую фазу роста периодической культуры, связанную с синтезом вторичного продукта метаболизма. В первом ферментере ведется выращивание культуры при большой скорости роста, что соответствует первой фазе периодической культуры. Второй ферментер берется большего размера или содержит больше среды. Поэтому поступающая из первого ферментера культура оказывается в условиях замедленного роста в такой степени, в какой во втором ферментере содержится больше среды, чем в первом. Скорость роста во втором ферментере должна соответствовать скорости роста во второй фазе, оптимальной для синтеза вторичного продукта.
При низких концентрациях субстрата и при низкой концентрации клеток можно возвратить в ферментер часть вытекающей из него биомассы; возврат повышает ее концентрацию и ускоряет процесс. Вариантов возврата биомассы может быть несколько. Сепарируют вытекающую культуру и сгущенную часть возвращают в ферментер. Устанавливают различные фильтрующие устройства, позволяющие вытекать культуральной жидкости, но задерживающие клетки. Известны и другие методы культивирования:
1. Отъемно-доливной метод. Среда подается в проточный ферментер порциями. Отъем культуры также производится порциями или происходит постоянный слив. Кривая концентрации клеток приобретает вид гребенки.
2. В практике стерильного наращивания патогенных бактерий для получения вакцин применяют многократное выращивание без стерилизации перед каждым циклом. Из ферментера после окончания цикла роста сливается не вся культура (небольшая часть остается). К ней добавляется стерильная среда и цикл наращивания повторяется. Так ведут несколько циклов.
3. Продленная периодическая культура, или метод подпитки. К периодической культуре добавляются компоненты питания — обычно соединение углерода по мере его исчерпания. Культура не страдает от избытка соединения углерода в начале роста, что неизбежно в обычной периодической культуре, и сразу начинает быстрый рост, который идет с постоянной скоростью до полного исчерпания всех компонентов питания.
Другой способ продления роста —- это диализ. Культивирование ведут в гильзе, не проницаемой для клеток, но пропускающей растворенные вещества. Гильза с культурой погружена в питательную среду, которая может быть проточной. Из среды поступают компоненты питания и в нее же выносятся продукты метаболизма. Таким путем получают сильно концентрированную биомассу.
Основные методы культивирования микроорганизмов представлены на схеме (рис. 4.6).
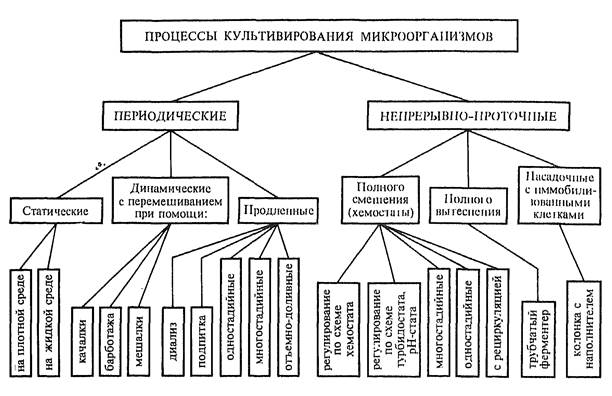
Рисунок 4.6 – Основные методы культивирования микроорганизмов
Стадии разработки биотехнологичесого производства - лабораторный регламент (подбор штаммов, субстратов, условий культивирования, конструкции биореактора, способов выделения и оценки качества конечного продукта, технологическая схема), опытно-промышленное испытание (масштабирование в условиях полупромышленных производств), промышленное производство (масштабирование)
Все биотехнологические производства по их направленности делятся на две группы. Первая преследует цель получения максимально возможных количеств биомассы, а вторая - максимум выхода продуктов жизнедеятельности клеток (метаболитов). В первом случае - это могут быть живые клетки (например, хлебопекарные дрожжи), биомасса нежизнеспособных клеток как источник кормового белка, витаминов, споры с токсинами (препараты для защиты растений от вредителей). Во втором - органические кислоты, ферменты, аминокислоты, антибиотики. При этом клетки продуцента являются отходом производства, требующим утилизации.
Несмотря на различные цели, общая схема биотехнологического производства в обоих случаях может быть представлена в виде пяти основных стадий:
- подготовка питательной среды для культивирования промышленного микроорганизма;
- получение чистой культуры для внесения в основной аппарат - ферментер;
- основная ферментация;
- выделение и очистка конечного продукта;
- получение товарных форм препарата.
Постановка задачи масштабирования.Изучение процессов ферментации в лабораторных условиях происходит сначала в колбах, затем в ферментерах лабораторного масштаба объемом 1 — 10 л, далее происходит испытание в опытных установках объемом 50, 100, 1000 л и более. Объемы промышленных установок зависят от вида продукта и от потребности в нем. Обычно речь идет уже о десятках кубометров — 10, 20, 50, 60, 100, отдельные аппараты имеют объемы свыше 1000 м3 (для получения кормовых дрожжей).
Обычно в аппаратах разного масштаба используют одинаковые микроорганизмы и одинаковый состав питательных сред. Можно было бы ожидать, что в пересчете на единицу объема — литр, кубометр, миллилитр — количество получаемого продукта (биомассы или продуктов метаболизма) будет одинаковым или почти одинаковым в аппаратах разного масштаба.
Действительность, однако, не оправдывает таких прогнозов. Наоборот, очень часто в аппаратах разного масштаба и конструкции результаты процесса различаются, иногда в несколько раз.
В связи с этим в производственной практике возникает проблема масштабирования.
Масштабирование — это воспроизведение результатов, полученных на оборудовании одного размера (или одной конструкции), при проведении того же процесса в аппаратах другого (обычно большего) размера или другой конструкции.
Обиходный пример масштабирования дан в книге Джонатана Свифта «Путешествия Гулливера». Гулливер оказался пленником лилипутов, и у них возникла проблема кормления Гулливера. Их специалистами по масштабированию был разработан критерий масштабного перехода: Гулливеру давали 1728 лилипутских порций. Происхождение этой цифры таково. Гулливер был в 12 раз крупнее (т. е. выше ростом), чем лилипут. Очевидно, что масса и объем Гулливера и лилипута соотносились как 123: 1 = 1728.
Масштабирование оказалось удачным: Гулливер совершал множество всяких подвигов и в конце концов освободился от плена.
Другой пример не столь удачен, хотя по существу использовался тот же принцип масштабирования — по массе. Биологическая лаборатория в США проводила испытание действия препарата ЛСД на различных животных. Как обычно принято при испытании лекарственных средств, сначала испытания проводят на мелких животных (мышах, крысах, кошках, кроликах), а затем переносят их на крупных животных и даже на человека; при подборе дозировки исходят из массы тела. Испытав препарат ЛСД на кошках, назначили дозировку для слона с учетом их разницы в весе в 30 000 раз. Результат оказался отличным от ожидаемого: слон зашатался и упал замертво, свидетельствуя тем самым, что проблема масштабирования не столь однозначна, как кажется.
Вернемся теперь к нашему процессу — процессу ферментации. Соотношение массы культуральной жидкости, например, в колбе (100 мл) и в производственном аппарате объемом 63 м3 (объем жидкости 45 м3) равно 450 000 : 1 — даже больше соотношения кошка: слон. Между тем именно с таким соотношением реально приходится работать, если не хочется осложнять себе жизнь и тратить время и деньги на испытания в большом ряду аппаратов промежуточных емкостей.
Подход к масштабированию на основе концентрации растворенного кислорода. Основные предпосылки. Поскольку ход процесса определяется микроорганизмами, различия в ходе ферментации в аппаратах разного масштаба и конструкции следует искать в микроокружении микробных клеток. Концентрации питательных веществ, продуктов метаболизма, температура и рН вряд ли зависят от масштаба. Более естественным выглядит предположение о различии в концентрациях растворенного кислорода С.
Аэробные микроорганизмы не могут развиваться в отсутствие кислорода. Однако растворимость кислорода воздуха в воде очень невелика — 7 мг/л при 20°С. Если жидкость (или среду) полностью насытить кислородом воздуха, а затем прекратить аэрацию, то многие промышленные культуры микроорганизмов «съедают» этот запас за 5—10 с. Поэтому требуется непрерывная подача воздуха в аппарат.
Надо заметить, что растворимость кислорода зависит еще и от давления воздуха, а вернее, от парциального давления кислорода в газовой фазе. Если, например, повысить давление воздуха в 2 раза, то и концентрация растворенного кислорода при насыщении жидкости воздухом также повысится в 2 раза. Если вместо воздуха для насыщения среды использовать чистый кислород, то концентрация растворенного кислорода возрастет почти в 5 раз — пропорционально парциальному давлению кислорода в воздухе и газообразном кислороде: (100 %) / (21 %) — 4,8. Этот показатель — концентрацию растворенного кислорода — можно измерять с помощью специального датчика растворенного кислорода. Это очень важный прибор для процессов ферментации, хотя в обычных системах контроля и автоматизации химических производств он используется довольно редко.
Профили изменения концентрации растворенного кислорода во времени. Концентрации растворенного кислорода, которые мы указывали ранее, — это концентрации в равновесном состоянии, при насыщении. В реальном процессе происходит непрерывное потребление растворенного кислорода из жидкости и одновременно его непрерывное растворение — массопередача из пузырей воздуха. Надо иметь в виду важную особенность микробиологических процессов. Микроорганизмы не способны потреблять кислород напрямую из газовых пузырей. Они потребляют лишь растворенный кислород, т. е. кислород переходит в клетку микроорганизма через две ступени: массопередача из газа в жидкость и затем потребление уже растворенного кислорода из жидкости.
Чтобы повлиять на концентрацию растворенного кислорода в жидкости, необходимо изменить либо скорость продувания воздуха через аппарат, либо частоту вращения мешалки в аппарате; либо давление в нем.
Мы можем наблюдать за ходом изменения концентрации растворенного кислорода непрерывно в течение всей ферментации. Обычный ход кривой C(t) представлен на рисунке 4.7.
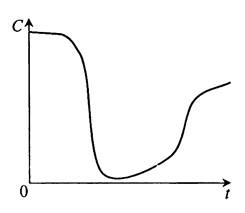
Рисунок 4.7 – типичный профиль изменения концентрации растворенного кислорода во времени в ходе периодической ферментации
Эта кривая (профиль во времени) отражает разные потребности кислорода в разные периоды ферментации и, соответственно, баланс между подводом кислорода и его потреблением.
Можно, конечно, меняя скорость подачи воздуха и частоту вращения мешалки, поддерживать профиль во времени, например, в большом аппарате таким же, как в малом.
А можно вспомнить о том, что кислород, как и другие субстраты, влияет на процесс обычно по кривой с насыщением (рис. 4.8). Тогда в ходе процесса достаточно поддерживать величину OQp. Обычно зависимость выхода за весь процесс ферментации (Р или X) от поддерживаемой концентрации растворенного кислорода имеет вид графика, представленного на рисунке 4.9.
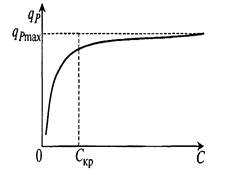
Рисунок 4.8 – Влияние концентрации растворенного кислорода на удельную скорость биосинтеза целевого продукта
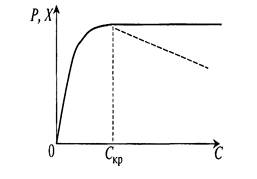
Рисунок 4.9 – Влияние концентрации растворенного кислорода на выход продукта или биомассы микроорганизмов
Повышение концентрации растворенного кислорода выше некоторой величины Скр не ухудшает процесс, но из экономических соображений удобно держать концентрацию поменьше. При высоких концентрациях в аппарат подается больше воздуха, больше скорость вращения мешалки, иногда приходится увеличивать давление и даже добавлять в воздух кислород.
Есть процессы, хотя их и немного, в которых повышение концентрации растворенного кислорода хуже не просто из-за перерасхода воздуха и энергии, но также и из-за снижения выхода (показано пунктиром на рисунке 4.9).
Так в общем выглядит способ масштабирования процесса путем поддержания профиля растворенного кислорода во времени.
Проблема в том, что обслуживание датчика и прибора для измерения растворенного кислорода — довольно хлопотное дело, и часто на заводах их либо нет, либо отказываются от их регулярной эксплуатации.
Связь концентрации растворенного кислорода с условиями массопередачи. Как бы сделать так, чтобы этот профиль в аппарате большего масштаба выдерживался сам собой? Какую характеристику нужно поддерживать одинаковой в сравниваемых аппаратах, чтобы одинаковым был и кислородный профиль?
Для ответа на этот вопрос рассмотрим основное уравнение массопередачи кислорода в ферментере
Qo2 = KLa (C* - C), (4.1)
где Qo2— скорость потребления кислорода единицей объема среды (кинетический параметр, аналогичный Qs для не газообразного субстрата); KLa — объемный коэффициент массопередачи по кислороду; С* — концентрация растворенного кислорода при насыщении; С — текущая концентрация растворенного кислорода.
Уравнение показывает, что в текущий момент времени скорость потребления кислорода равна его скорости растворения в жидкости из газового потока.
Интересно, что коэффициент KLa включает в себя площадь межфазной поверхности, поэтому его размерность включает в себя единицу объема.
Размерность Qo2 :
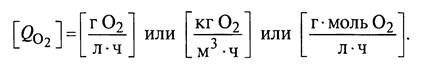
Размерность С и С:
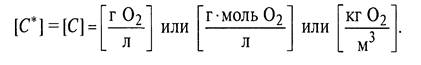
Отсюда получается размерность для величины KLa:
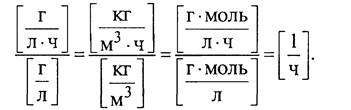
Из уравнения (1) легко получить выражение для текущей концентрации растворенного кислорода С:
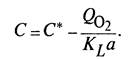 (4.2)
(4.2)
Если в ходе процесса скорость потребления кислорода Qo2, изменяется во времени, то изменяется и концентрация растворенного кислорода, что и дает наблюдаемый профиль во времени.
Если мы имеем два разных аппарата, в которые загружена одна и та же культуральная жидкость, имеющая одну и ту же скорость потребления кислорода на единицу объема, то концентрация растворенного кислорода в таких аппаратах зависит
Дата добавления: 2018-11-26; просмотров: 1422;










