Смеси идеальных газов
Идеальный газ. Уравнение состояния
Под идеальным газом понимают газ, в котором полностью отсутствуют силы межмолекулярного взаимодействия, а молекулы можно считать материальными точками.
Для такого газа справедливо уравнение состояния Клапейрона - Менделеева
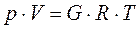 (3-1)
(3-1)
где V и G - объём и масса газа;
R - газовая постоянная данного газа.
Газовая постоянная определяется выражением
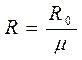 (3-2)
(3-2)
где m - молекулярная масса данного газа 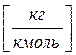
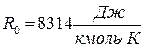 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Реальные газы при достаточно высоких температурах и малых плотностях хорошо соответствуют модели идеального газа, а такие условия очень широко распространены в технике.
Смеси идеальных газов
В тоже время в технике очень редко приходится иметь дело с чистыми газами. В большинстве случаев рабочие тела представляют собой газовые смеси, под которыми понимают механическую смесь нескольких газов - компонентов химически между собой не взаимодействующих.
В соответствии с определенней идеального газа можно считать, что каждый компонент газовой смеси ведет себя так, как будто других компонентов нет, т.е. каждый компонент равномерно заполняет объём смеси V и оказывает на стенки давление pi ; которое называется парциальным давлением. Очевидно, что все компоненты в смеси имеют одинаковую температуру Т .
Давление газовой смеси определяется законом Дальтона, который гласит: "Давление газовой смеси при отсутствии химических реакций равно сумме парциальных давлений компонентов, составляющих смесь''.
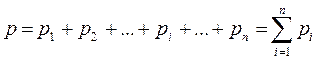 (3-3)
(3-3)
Поскольку каждый компонент смеси подчиняется уравнению состояния идеального газа, то и вся смесь должна подчиняться этому уравнению, которое можно представить в виде
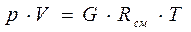 (3-4)
(3-4)
где G и Rсм - масса и кажущаяся газовая постоянная смеси, для которой будем считать справедливым соотношение (3-2), которое для смеси примет вид
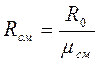 (3-2а)
(3-2а)
где mсм - кажущаяся молекулярная масса смеси,
Как видим, чтобы использовать в термодинамических расчётах уравнение (3-4) необходимо знать величину Rсм или mсм, которые отвечают данному составу смеси.
Состав смеси может быть задан тремя способами: с помощью массовых, объёмных и мольных долей.
I. Массовое задание состава смеси, когда заданы массовые доли компонентов gi:
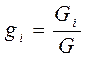 (3-5)
(3-5)
где Gi - масса i -того компонента в смеси.
Очевидно, что
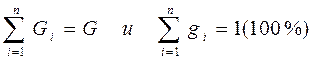 (3-6)
(3-6)
2. Объемное задание состава смеси, когда заданы объёмные доли компонентов ri :
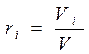 (3-7)
(3-7)
где Vi - парциальный объём компонента - объём который имел бы компонент, если бы один находился под давлением смеси и имел температуру смеси.
Очевидно, что
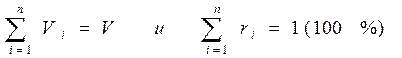 (3-8)
(3-8)
Запишем уравнение состояния i - ого компонента при температуре смеси
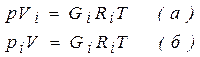
Разделив выражение (б) на (а), получим
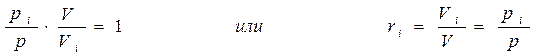
2. Мольное задание состава смеси, когда заданы мольные доли компонентов ni:
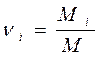 (3-9)
(3-9)
где Mi и M - количество молей i - го компонента и общее количество молей в смеси.
Выразим парциальный объем Vi - го компонента и объём смеси через мольный объём и количество молей
|
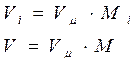
Разделив выражение (г) на (в), получим:
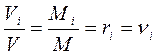
т.е. мольная доля идеального газа численно равна объёмной доле, поэтому в дальнейшем будем оперировать только с объёмными долями.
Найдём взаимосвязь между массовыми и объёмными долями компонента:
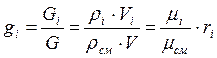 ,т.е.
,т.е.
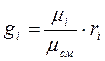 (3-10)
(3-10)
Из зависимости (3-2) можно получить
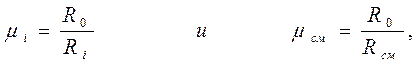
тогда
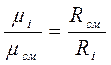 (д)
(д)
Подставив выражение (д) в (3-10), получим
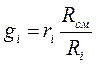 (3-11)
(3-11)
Дата добавления: 2018-11-26; просмотров: 873;











