Общая теория сплавов. Диаграмма состояния.
Основные понятия
1. Система. Системой называют группу тел (веществ), которую выделяют из прочих окружающих тел и в которой наблюдают интересующие явления.
Для металлических сплавов системой будет являться совокупность фаз, находящихся в состоянии равновесия. Система, состоящая из одной фазы, называется гомогенной; система, состоящая из двух и более фаз – гетерогенной.
2. Фаза. Фазой называют однородную (гомогенную) составную часть системы, имеющую одинаковый состав, строение и свойства, одно и тоже агрегатное состояние и отделенную от других частей поверхностью раздела, при переходе через которую свойства резко меняются.
Фазами могут быть:
· сами элементы в твердом, жидком состоянии и их аллотропические модификации;
· жидкие и твердые растворы, химические соединения.
3. Структура. Под структурой понимают форму, размеры, количество и характер взаимного расположения соответствующих фаз.
4. Компонент. Компонентами называют независимые индивидуальные вещества, способные существовать в изолированном виде, наименьшее число которых достаточно для образования всех фаз данной системы.
5. Металлический сплав – вещество, обладающее металлическими свойствами, полученное сплавлением или спеканием двух или более компонентов. В металлических сплавах компонентами являются чистые металлы и неметаллы, а также химические соединения.
Правило фаз
Общие закономерности сосуществования устойчивых фаз могут быть выражены в математической форме, именуемой правилом фаз или законом Гиббса.
Правило фаз показывает количественную зависимость между числом степеней свободы С, числом компонентов К и числом фаз Ф:
С = К – Ф + 2 (1)
Независимыми переменными в уравнении правила фаз являются концентрация, температура, давление. Если признать, что все превращения происходят при постоянном давлении, то число переменных уменьшается на единицу и уравнение правила фаз примет следующий вид:
С = К – Ф + 1. (2)
Число степеней свободы С (вариантность) показывает, сколько переменных могут изменяться в системе одновременно и независимо друг от друга, без изменения числа фаз, находящихся в равновесии.
Для случая, характеризуемого уравнением (2), таких переменных две – температура и концентрация.
Если С = 2 (система бивариантная), то в рассматриваемой области и температура, и концентрация могут изменяться независимо друг от друга. Это значит, что никаких превращений в сплаве не происходит (например, в жидком расплаве из двух компонентов С = 2 – 1 + 1 = 2).
Если С = 1 (система моновариантная), то это значит, что в данной области при изменении одного параметра (например, температуры сплава) одновременно по определенному закону изменяется и второй (концентрация). На кривой охлаждения будет наблюдаться перегиб (например, сплав из двух компонентов в области первичной кристаллизации будет иметь С = 2–2+1=1).
Если С = 0 (система нонвариантная), то это значит, что оба параметра (температура и концентрация) должны оставаться постоянными до окончания данного превращения. На кривой охлаждения будет наблюдаться горизонтальная площадка при температуре этого превращения (например, сплав из 2-х компонентов при эвтектических концентрациях и температуре будет иметь С = 2–3+1=0).
Основные типы диаграмм состояния
Диаграммы состояния или диаграммы фазового равновесия в удобной графической форме показывают фазовый состав сплава в зависимости от температуры и концентрации компонентов. Диаграммы состояния строят для условий равновесия или условий, достаточно близких к ним. Они дают наглядное представление о процессах, происходящих в сплавах при нагревании и охлаждении, что может быть использовано при оценке физико-химических, механических и технологических свойств сплава и позволяет рационально подойти к выбору материалов для изготовления изделий.
Диаграммы состояния двойных систем строят в координатах “концентрация компонентов - температура”. Линии, соединяющие точки аналогичных превращений в системе, разграничивают области существования равновесных фаз. Каждая точка на диаграмме определяет фазовый и химический состав сплава, а также его структуру при данной температуре.
Как известно, при кристаллизации чистых металлов атомы, ранее находящиеся в жидкости хаотично, выстраиваются в определенном порядке и образуют, так называемую, кристаллическую решетку, наиболее распространенными из которых являются ОЦК, ГЦК, ГПУ. Если же в жидкости присутствуют атомы двух компонентов, то при кристаллизации возможно образование трех типов сплавов.
Первый тип сплавов – твердые растворы. В этом случае образуется кристаллическая решетка одного из компонентов (растворителя), а атомы второго компонента в этой решетке располагаются. Твердые растворы на диаграммах соответствуют областям и обозначаются греческими буквами a, b, g и т.д.
Второй тип сплавов – химическое соединение. В этом случае образуется новая сложная кристаллическая решетка, отличающаяся от кристаллических решеток образующих ее компонентов. На диаграммах химсоединения соответствуют вертикальным линиям, и как правило, указывается формула этого соединения.
Третий тип сплавов – механические смеси. В этом случае при кристаллизации образуются одновременно 2 кристаллические решетки. Различают эвтектические и эвтектоидные механические смеси. Эвтектические образуются при кристаллизации из жидкости, Эвтектоидные – при распаде твердого раствора.
В зависимости от характера взаимодействия компонентов различают разные типы диаграмм состояния.
Рассмотрим пять основных типов диаграмм состояния.
Диаграмма состояния сплавов I рода, образующих механические смеси из чистых компонентов, представлена на рис. 5.1.
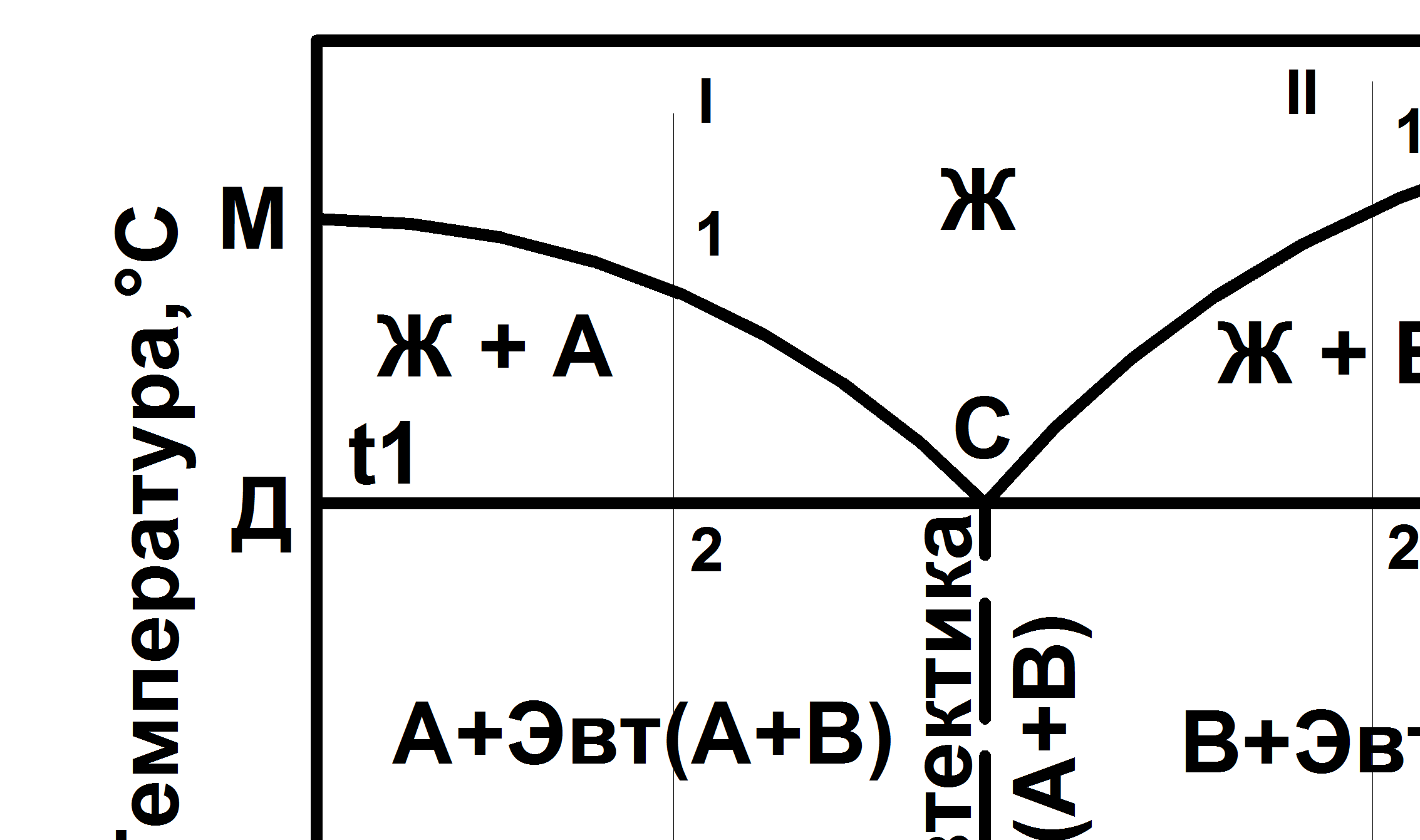
Рис 5.1 Диаграмма состояния I рода сплавов, образующих механическую смесь из чистых компонентов
Оба компонента в жидком состоянии неограниченно растворимы, а в твердом состоянии нерастворимы (или ничтожно мало растворимы) и не образуют химических реакций. На этой диаграмме линия MBN – линия ликвидус, линия ДСЕ – линия солидус. Точки М и N – температуры плавления компонентов А и В. При охлаждении жидкого сплава I в интервале между линиями ликвидус и солидус от точки 1 до 2 происходит образование кристаллов компонента А. При охлаждении жидкого сплава II в интервале между линиями ликвидус и солидус от точки 1 до 2 происходит образование кристаллов компонента В. При достижении температуры t1, весь оставшийся жидкий сплав превращается в эвтектическую смесь, состоящую из кристаллов А и В с химическим составом, соответствующим точке С. Точка С называется эвтектической точкой. При температуре t1 и концентрации, соответствующей точке С, до завершения кристаллизации система будет нонвариантной (С = 2 – 3 + 1 = 0).
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (II рода) представлена на рис. 5.2.
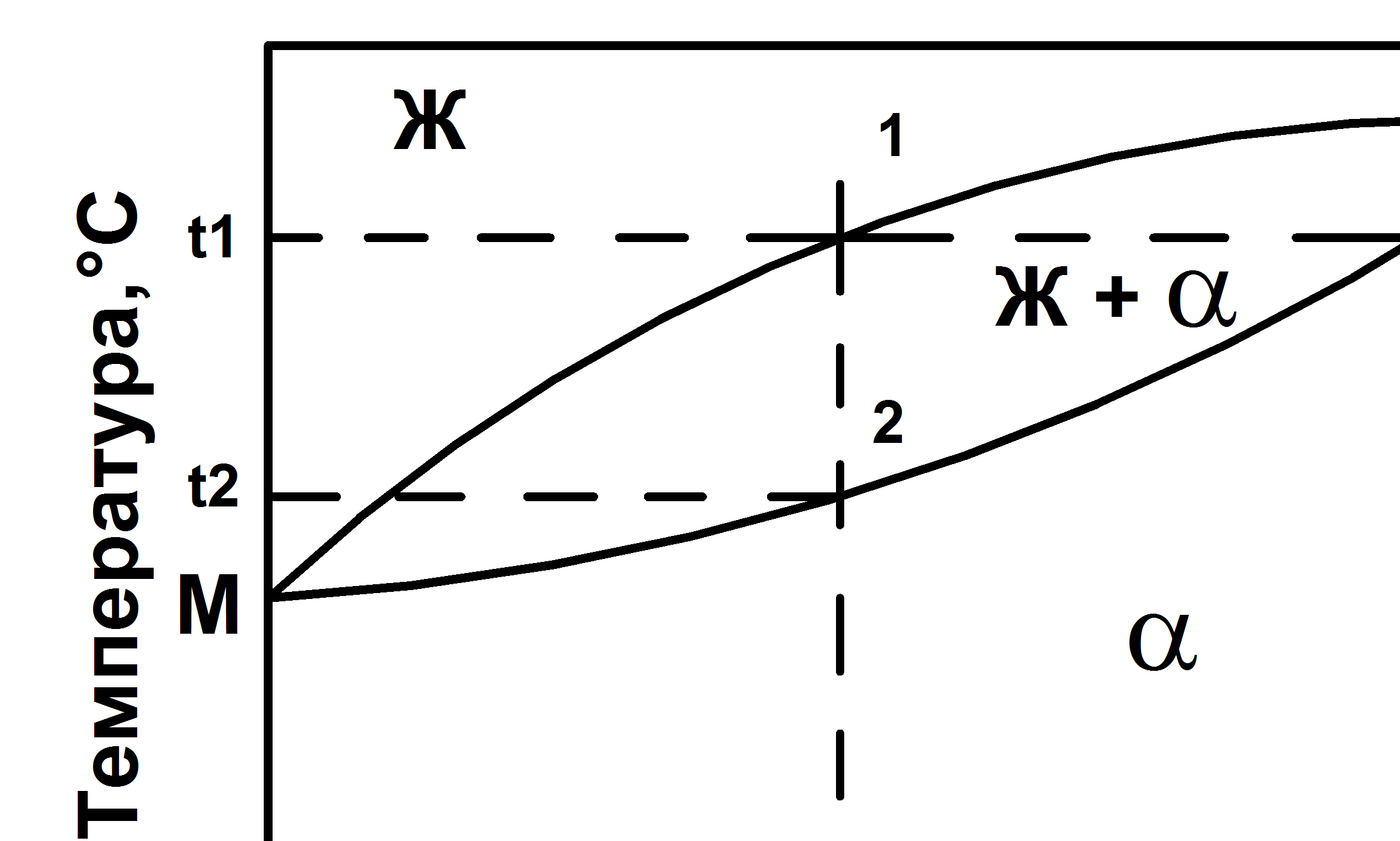
Рис 5.2 Диаграмма состояния II рода сплавов с неограниченной растворимостью компонентов в твердом состоянии.
Полная взаимная растворимость в твердом состоянии возможна тогда, когда оба компонента имеют одинаковые кристаллические решетки и атомные диаметры компонентов отличаются по размерам не более чем на 15%.
Линия M1N – линия ликвидус, линия M2N – линия солидус. Точки М и N – температуры плавления компонентов А и В. При охлаждении жидкого сплава в интервале температур между линиями ликвидус и солидус (от точки 1 до точки 2) происходит выпадение кристаллов твердого раствора a разного химического состава, изменяющегося от точки С до точки 2. При медленном охлаждении концентрация всех зерен твердого раствора выравнивается за счет диффузии между кристаллами. При охлаждении сплава в интервале кристаллизации от t1 до t2 система будет моновариантной (С = 2 – 2 + 1 = 1).
Диаграмма состояния сплавов эвтектического типа с ограниченной растворимостью компонентов в твердом состоянии (III рода) представлена на рис.5.3.
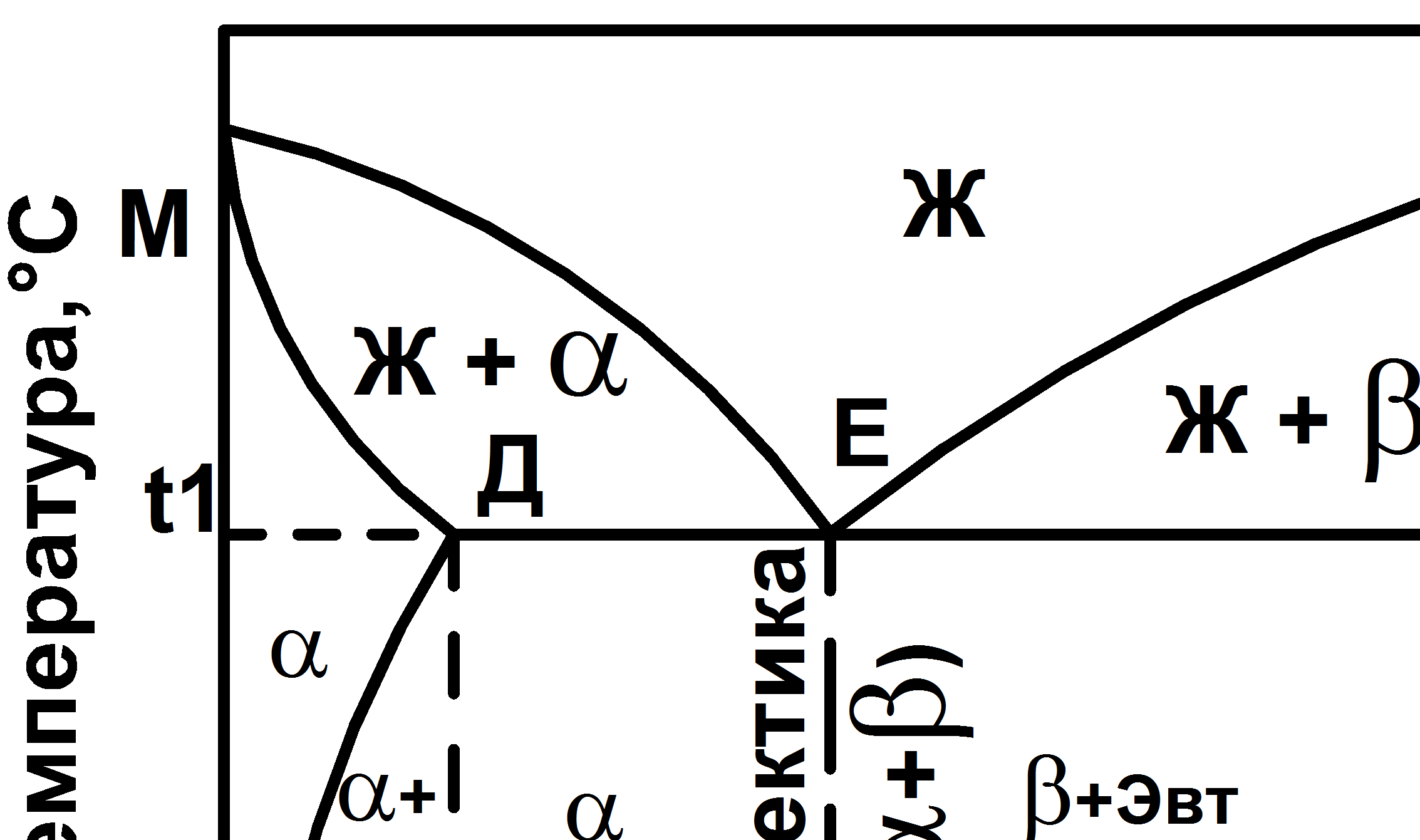
Рис 5.3 Диаграмма состояния Ш рода – эвтектического типа с ограниченной растворимостью компонентов в твердом состоянии
Линия MEN – линия ликвидус, линия МДECN – линя солидус. Точки М и N – температуры плавления компонентов А и В. Точка Д – максимальная растворимость компонентов В в компоненте А. Точка С – максимальная растворимость компонента А в компоненте В. Точка Е – эвтектическая точка. При охлаждении жидкого сплава этой концентрации до температуры t1 происходит одновременная кристаллизация твердых растворов a и b с образованием эвтектики, состоящей из кристаллов a и b.
ЖЕ → aД + bс
Согласно правилу фаз при температуре t1 до полного затвердевания эвтектического сплава система будет нонвариантной (С = 2 – 3 + 1 = 0).
При медленном охлаждении твердого раствора a от температуры t1 до комнатной в связи с уменьшением растворимости из него будут выделяться субмикроскопические кристаллы твердого раствора b (вторичные).
Диаграмма состояния сплавов с перитектическим превращением (IV рода) представлена на рис.5.4.
Линия MCN – линия ликвидус, линия MPDN – линия солидус. Точки М и N – температуры плавления компонентов А и В. Точка Р – перитектическая точка. Линия СРД (температура t1) – перитектическая линия. При охлаждении жидкого сплава с концентрацией F, соответствующей точке Р, ранее выпавшие кристаллы твердого раствора b взаимодействуют с жидкостью и образуют новую твердую фазу - кристаллы a-твердого раствора.
Жс+βд→aр
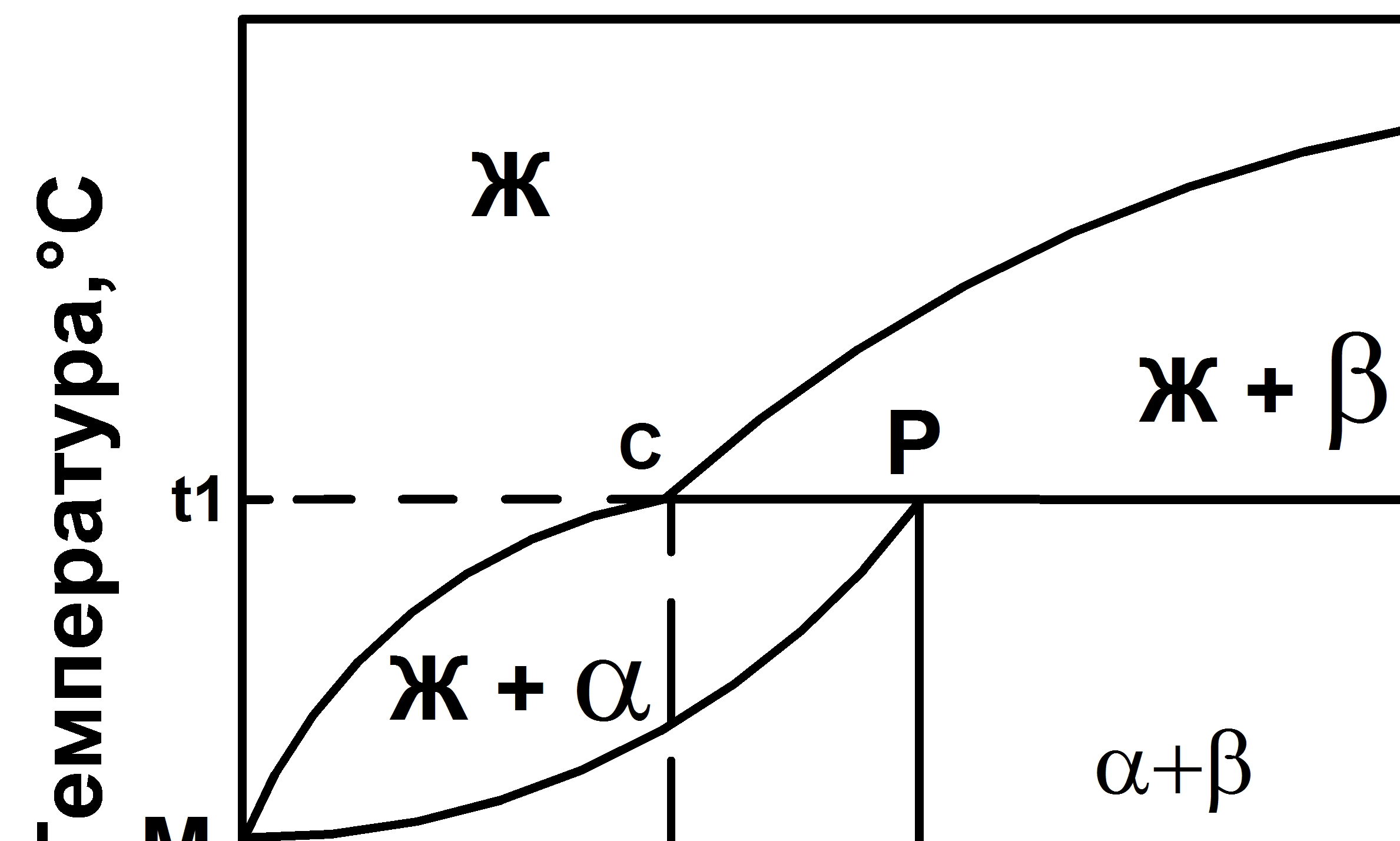
Рис 5.4 Диаграмма состояния с перитектикой (IV рода)
При температуре t1 система также будет нонвариантной до завершения превращения (С = 2 – 3 + 1 = 0).
В сплавах до- и заперитектических при температуре перитектической реакции имеет место избыток жидкой фазы или b-твердого раствора соответственно.
В интервале концентраций между точками Р и Д образуется структура из твердого раствора a и b, оставшегося в избытке; а между точками Р и С образуется a-твердый раствор и оставшаяся в избытке жидкость, из которой при дальнейшем охлаждении будут выделяться кристаллы a.
Диаграмма состояния с устойчивыми химическими соединениями (V рода) представлена на рис. 5.5.
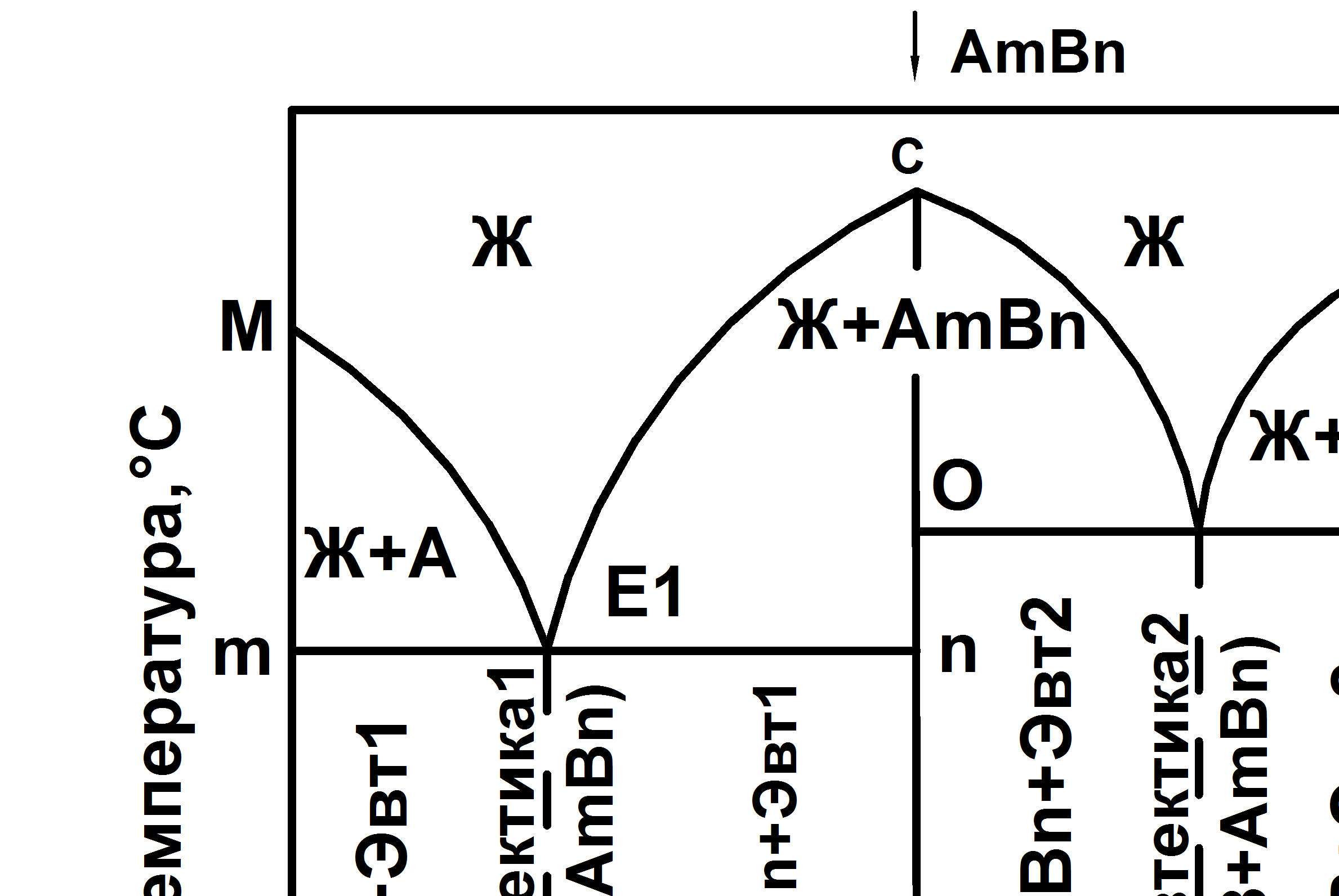
Рис. 5.5 Диаграмма состояния V рода с устойчивыми химическими соединениями
Линии МЕ1СЕ2N – линия ликвидус, линия mnop – линия солидус. Точки М и N – температуры плавления компонентов А и В. Точка С – температура плавления химического соединения Аm Bn. Точки Е1 и Е2 – эвтектические точки.
Состав эвтектики Е1 будет А+АmBn, эвтектики Е2 – B+AmBn. При кристаллизации эвтектических сплавов система будет нонвариантной в обоих случаях (С = 2 – 3 + 1 = 0). Диаграмма состояния с устойчивым химическим соединением может быть представлена и в других видах, где наряду с чистыми компонентами и одним химическим соединением могут быть и твердые растворы (ограниченные и неограниченные) и другие химические соединения.
Дата добавления: 2022-07-20; просмотров: 583;











