Антропогенные изменения атмосферы. Источники, загрязнители, загрязнения воздуха и их последствия
Природные и антропогенные факторы предопределяют существенные изменения в нормальном функционировании атмосферы, причем как в самых нижних, так и в высотных ее частях. В последние годы резко возросла роль антропогенных (техногенных) факторов.
Имеется множество различных источников антропогенного характера, вызывающих загрязнение атмосферы и приводящих к серьезным нарушениям экологического равновесия. По своим масштабам наибольшее воздействие на биосферу оказывают два источника: транспорт и индустрия. В среднем на долю транспорта (например, в США) приходится 60 % общего количества атмосферных загрязнений, промышленности - 17 %, энергетики - 14 %, отопления и уничтожения отходов - 9 %.
Транспорт, в зависимости от используемого топлива, выбрасывает в воздух оксиды азота, серы, свинец и его соединения, оксид и диоксид углерода, сажу, бензопирен (вещество из группы поли циклических ароматических углеводородов, являющееся сильным канцерогеном, вызывающим рак кожи). Реальную причину гибели деревьев, растущих вдоль крупных автомагистралей столицы, установили специалисты в 2000 году. Выяснилось, что придорожные зеленые насаждения умирают не только и не столько от выхлопных газов, сколько под воздействием технической соли. Результаты исследования причин массового засыхания деревьев, посаженных у дорог, оказались сенсационными. Свое убийственное влияние техническая соль, которой зимой обильно посыпают столичные автотрассы, оказывает не на корневую систему дерева, а на его будущую листву. Соленые брызги, летящие из-под колес машин, и испарения, поднимающиеся на высоту до четырех метров, оседают на ветках близко от растущих деревьев. Через некотрое время их ветви покрываются настоящими соляными кристаллами. Таким образом, зреющие почки попадают в своеобразный футляр, который не дает им раскрыться в назначенное время. Дерево, лишенное возможности обзавестись зеленой кроной, вскоре попросту засыхает.
Большинство веществ, выбрасываемых транспортными средствами, опасны для здоровья человека, представляют опасность для биоты в целом, нарушая баланс экосистем и влияя на урожайность сельскохозяйственных культур. Бензин поступает в организм главным образом через дыхательные пути, может заглатываться с воздухом и затем всасываться в кровь из желудочно-кишечного тракта. В основе действия бензина на организм лежит его способность растворять жиры и липоиды. Особенно сильное действие он оказывает на центральную нервную систему, кожный покров.
Индустрия приводит к промышленным выбросам в атмосферу сернистого газа, оксидов углерода, пыли (в сумме 85 % общего выброса), углеводородов, аммиака, сероводорода, серной кислоты, фенола, хлора и других соединений и элементов (15 %).
Результатом техногенного загрязнения является образование аэрозолей, смога, кислотных дождей.
Аэрозоли представляют собой дисперсные системы, состоящие из газовой дисперсной среды, в которой распределены твердые или жидкие дисперсные фазы (частицы). Размер частиц дисперсной фазы обычно составляет 30 - 10 см.
В зависимости от состава дисперсной фазы аэрозоли можно подразделить на две группы. К первой относятся аэрозоли, состоящие из твердых частиц, дисперсированных в газообразной среде, ко второй - аэрозоли, являющиеся смесью газообразных и жидких фаз. Первые обычно называют дымами, вторые - туманами. В механизме их образования существенную роль играют центры конденсации химических соединений или ядра. В качестве ядер выступают вулканическая и космическая пыль, продукты промышленных выбросов, бактерии и др. Возможные источники и количество ядер непрерывно возрастают. Так, при уничтожении огнем сухой травы на площади 200  200 м образуется в среднем 2
200 м образуется в среднем 2 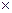 1022 ядер аэрозолей.
1022 ядер аэрозолей.
Образование аэрозолей началось с возникновения нашей планеты. Природные аэрозоли всегда влияли на окружающую среду, но, уравновешиваясь общим круговоротом веществ в природе, не вызывали глубоких экологических изменений. Антропогенные факторы их образования сдвинули это равновесие в сторону значительных биосферных перегрузок, тем более что человек начал использовать специально создаваемые аэрозоли в практической деятельности, например - для защиты растений в сельском хозяйстве или в виде боевых отравляющих веществ.
Медленное оседание аэрозолей предопределяет изменение прозрачности воздуха; быстрое их оседание отрицательно сказывается на зеленом покрове Земли.
Наиболее опасны для растений аэрозоли сернистого газа, фтористого водорода, азота. При соприкосновении с влажной поверхностью листа образуются кислоты, вызывающие гибель живой ткани. Кислотные туманы, попадая с вдыхаемым воздухом в дыхательные органы человека, агрессивно воздействуют на слизистые оболочки. Чрезвычайно опасны радиоактивные аэрозоли. Среди радиоактивных изотопов особую потенциальную опасность представляет 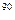 Sr, не только как долго живущий радиоактивный изотоп, но и как аналог кальция, замещающий его в костях живых организмов со всеми вытекающими последствиями.
Sr, не только как долго живущий радиоактивный изотоп, но и как аналог кальция, замещающий его в костях живых организмов со всеми вытекающими последствиями.
Во время ядерных взрывов образуются радиоактивные аэрозольные облака. Мелкие частицы радиусом 1-10 мкм попадают не только в верхние слои тропосферы, но и в стратосферу, в которой они могут находиться до года и более. Аэрозольные облака возникают в результате не только ядерных взрывов, но и работы реакторов промышленных предприятий, производящих ядерное топливо, и аварий на АЭС типа Чернобыльской.
Смог - смесь аэрозолей с жидкой и твердыми дисперсными фазами, образующая туманную завесу над промышленными районами. Различают три типа смога:
смог ледяной (аляскинского типа) - сочетание газообразных загрязнителей, пылевых частиц и кристаллов льда, возникающих при замерзании капель тумана и пара отопительных систем;
смог влажный (лондонского типа), иногда называемый зимним, - сочетание газообразных загрязнителей, в основном сернистого ангидрида, пылевых частиц и капель тумана.
Метеорологической предпосылкой для зимнего смога является безветренная тихая погода, при которой слой теплого воздуха расположен над приземным слоем холодного воздуха (ниже 700 м). Движение воздуха вблизи поверхности земли почти отсутствует (менее 3 м/с). Горизонтальный и вертикальный обмен воздуха затруднен. Загрязняющие вещества, рассеивающиеся обычно в высоких слоях, скапливаются в приземном слое (рис. 3.5).

Рис. 3.5. Метеорологическая обстановка, благоприятствующая
возникновению зимнего смога
Смог сухой (лос-анджелесского типа = фотохимический), называемый также летним, - сочетание озона, угарного газа, соединений азота (NOх), кислот и др. Он образуется в результате вторичного разложения загрязняющих веществ солнечными лучами, особенно ультрафиолетовыми. Метеорологической предпосылкой является атмосферная инверсия, выражающаяся в появлении слоя холодного воздуха под теплым. Обычно поднимаемые теплым воздухом газы и твердые частицы, затем рассеивающиеся в верхних холодных слоях, в данном случае накапливаются в инверсионном слое. В процессе фотолиза соединения азота, образующиеся при сгорании топлива в автомобильных двигателях, распадаются:
NO2 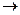 NO + О, l<240 .
NO + О, l<240 .
Затем происходит синтез озона:
О + О2 + М 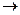 О3 + М;
О3 + М;
NO + О 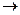 NO2,
NO2,
сопровождаемый желто- зеленым свечением.
Эта реакция обусловливает желто-зеленую окраску смога.
Кроме того, происходят реакции по типу: SO3+ Н2О 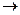 Н2SO4, приводящие к образованию капелек кислот.
Н2SO4, приводящие к образованию капелек кислот.
С изменением метеорологических условий, связанных с появлением ветра, холодный воздух смещается и смог исчезает. Рассмотрим это на примере динамики смога в долине Лос-Анджелеса (рис. 3.6).

Рис. 3.6. Динамика смога в долине Лос-Аиджелеса
При нормальных условиях (рис. 3.6,а) температура воздуха понижается с высотой. Теплый воздух поднимается вверх и рассеивает примеси, выбрасываемые у поверхности земли.
Когда устанавливается инверсионное распределение температуры (рис. 3.6,б), холодный воздух располагается под теплым, который поступает из калифорнийских пустынь. В этом случае температура снижается, а примеси (газы и твердые частицы) накапливаются в инверсионном слое. Это продолжается до тех пор, пока метеорологические условия не изменятся. При этом ветер (рис. 3.6,в) вызывает смещение холодного воздуха и исчезновение смога.
Концентрация загрязняющих веществ в смоге различных типов приводит к нарушению дыхания, раздражению слизистых оболочек, расстройству кровообращения, нередко к смерти (в Лондоне в 1952 г. от смога погибло 4000 человек).
Особую опасность смог представляет для малолетних детей, вызывая заболевания ложным крупом.
Кислотные дожди - атмосферные осадки (дождь и снег), подкисленные из-за растворения в атмосферной влаге промышленных выбросов (SO2, NОх, НС1 и др.). При сжигании горючих полезных ископаемых (уголь, нефть и газ) большая часть содержащейся в них серы превращается в диоксид серы (SO2). При всех видах сгорания различных материалов в воздухе происходит реакция атмосферного азота с атмосферным кислородом с образованием окислов азота (NOх). Чем выше температура сгорания, тем интенсивнее идет образование оксидов азота. Из всех выбросов оксидов азота (например, в ФРГ) 55 % приходилось на транспорт, 28 % -на энергетику, 14 % - на промышленные предприятия (1982). SO2 и NOх являются кислотообразователями, реагирующими с атмосферным кислородом и водой с образованием серной и азотной кислот.
Оксиды серы и азота в атмосфере - основная причина кислотных дождей. Оксиды серы поступают в воздух при сжигании ископаемых видов топлива, содержащих серу, первое место среди которых занимает каменный уголь (до 90 %), на втором месте - нефть, значительно уступает им газ. Оксиды азота NO также образуются при сжигании топлива, а дополнительным крупным их источником является автомобильный транспорт (рис. 3.5.1).
В 1983 г. тепловые электростанции при сжигании угля и нефти выбросили в атмосферу 16,8 млн. т серы, или 87 % всех оксидов серы, выброшенных в том же году. При сжигании угля и нефти образуются два кислородных соединения серы: двуокись и трехокись серы (SO2 и SОз). В атмосфере SO2окисляется до SOз:
2SO2 + O2 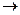 2SO3.
2SO3.
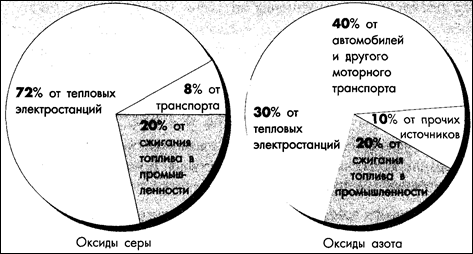
рис. 3.5.1. Количество выбросов оксидов серы и азота в атмосферу
от различных источников
Образовавшаяся трехокись реагирует с водяным паром, образуя серную кислоту:
SO3+ H2О 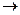 H2SO4.
H2SO4.
Серная кислота присутствует в воздухе в виде легкого тумана, состоящего из крошечных капель. При сжигании топлива выбрасываются в атмосферу также оксиды кальция и железа, которые вступают в реакцию с серной кислотой, образуя твердые частички сульфатов кальция и железа:
СаО + H2SO4 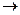 CaSO4 + Н2О.
CaSO4 + Н2О.
Fe2О3 + 3H2SO4 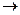 Fe2(SO4)3 + 3Н2О.
Fe2(SO4)3 + 3Н2О.
Количество содержащихся в городском воздухе твердых частиц сульфатов и капелек серной кислоты может достигать 20 %. Ветер разносит эти загрязнения за сотни километров от места их выброса, образуются туманы и смоги. Оксиды азота окисляются в воздухе до диоксидов, которые тоже растворяются в капельках воды, образуя азотную кислоту:
2NO + О2 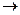 2NО2.
2NО2.
4NO2 + 2 Н2О + О2 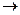 4HNO3.
4HNO3.
Эти две кислоты (H2SO4 и HNO3), а также их соли и обусловливают выпадение кислотных дождей. На растения, почву и воду выпадают также сухие частицы в виде солей.
Обычно кислотность измеряют не как отношение числа ионов водорода к числу молекул воды, а как логарифм концентрации ионов водорода, взятый с обратным знаком. Эта величина называется рН. Поскольку -lg (0,0000001) = 7, значение рН = 7 характеризует чистую воду - не кислую и не щелочную, а нейтральную. Дождь в Новой Англии с примерно 0,0001 водородных ионов на 1 молекулу воды имеет значение рН, равное —(0,0001), т.е. 4. В общем, чем меньше значение рН, тем более кислой оказывается вода (рис. 7.2.). Значение рН = 4 для дождевой воды - весьма необычное явление. Однако в настоящее время в некоторых районах часто наблюдается значение рН даже ниже 4. Естественная дождевая вода имеет слабокислую реакцию (рН 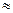 6), так как находится в контакте с СО2 (естественный компонент атмосферы) и растворяет ее, образуя слабую угольную кислоту:
6), так как находится в контакте с СО2 (естественный компонент атмосферы) и растворяет ее, образуя слабую угольную кислоту:
СО2 + Н2О 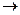 Н2СО3.
Н2СО3.
Однако дожди, выпадающие в Новой Англии, например, имеют иногда рН=4 - весьма необычное явление для дождевой воды. В других регионах мира часто наблюдаются дожди с рН ниже 4 (рис. 3.6.1).
Европа также страдает от кислотных дождей. Широко распространенное сжигание угля как основного топлива, особенно в Великобритании и Центральной Европе, оказывает разрушительное воздействие на природные экосистемы.
Спектр влияния кислотных дождей очень широк. Прежде всего, они сказываются на популяциях рыб в озерах, особенно высокогорных, где вода стала кислой. По данным 1975 г., в США 51 % озер имели рН воды меньше 5, в 90 % этих озер рыба полностью отсутствовала. Правда, трудно предположить, что такая вода может сильно влиять на взрослых рыб. Скорее всего низкий рН препятствует размножению рыб, убивая икру.

Рис. 3.6.1. Значение рН для некоторых продуктов и кислотных дождей
Чистая вода имеет рН = 7, дождевая вода - рН = 5,6. Уменьшение значения рН на единицу соответствует 10-кратному повышению кислотности. Максимальная, зарегистрированная в Западной Европе, кислотность осадков составляет 23 рН (рис. 3.7).

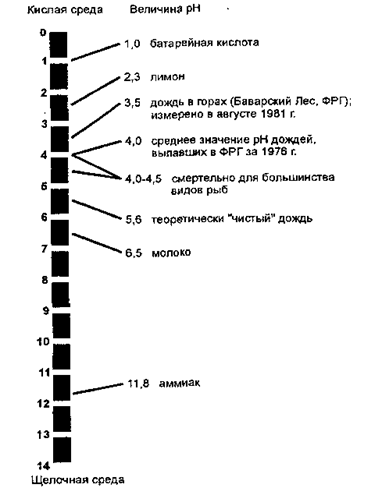
Рис. 3.7. Шкала значений рН
Кислотные дожди оказывают агрессивное воздействие на восковой налет листьев на деревьях, на кирпичные и бетонные сооружения, увеличивая скорость химического выветривания последних. Повышение кислотности препятствует саморегулирующейся нейтрализации почв, в которых происходит растворение питательных веществ. Эти вещества выносятся в грунтовые воды. Одновременно выщелачиваются из почв и тяжелые металлы, которые потом усваиваются растениями, вызывая у них серьезные повреждения и проникая в пищевые цепи человека.
Наиболее опасным является подкисление океанских мелководий, ведущее к невозможности размножения многих морских беспозвоночных, гибели рыб, разрыву пищевых цепей (пищевой или трофической цепью называют ряд видов, звено в котором служит пищей для следующего вида) и нарушению экологического равновесия в океане (рис. 3.8.).
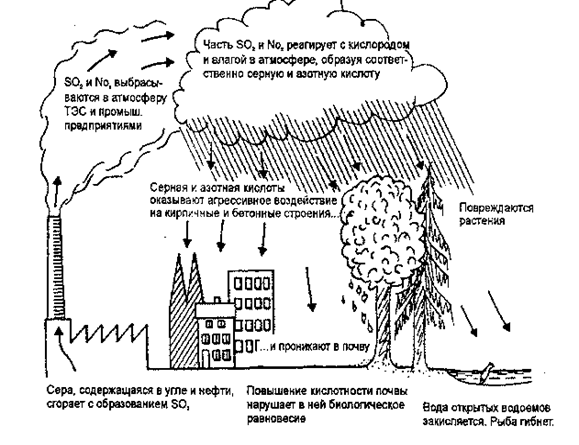
Рис. 3.8. Кислотные дожди: их причины и вредное влияние
Вероятно также снижение развития фитопланктона, а, следовательно, и кормовой базы для рыб. Снижение численности рыб влечет за собой исчезновение животных, которые питаются рыбой: белоголового орлана, гагар, чаек, норки, выдры и др. Численность земноводных (лягушек, жаб, тритонов), возможно, тоже сокращается.
Кроме того, подкисленные воды лучше растворяют различные минералы. Ртуть, содержащаяся в природных водоемах, в кислой среде может превратиться в ядовитую монометиловую ртуть. Подкисление воды в источниках водоснабжения может приводить к растворению в трубах токсичных металлов, которые могут попасть в питьевую воду. Так, в одном из районов Нью-Йорка подкисленная питьевая вода, простоявшая в трубах целую ночь, растворила свинец, и его содержание в воде превысило допустимые нормы.
Кислотные дожди разрушают строительные материалы (растворы, гипс, камень и др.), реагируя с кальцием и магнием, входящими в их состав; усиливают коррозию строительных конструкций из железа и других металлов. Шведские специалисты обнаружили высокую корреляцию между кислотными дождями и коррозией стали.
Конечно, кислотные дожди отрицательно влияют и на наземные экосистемы. Несомненно, что они - одна из причин деградации лесов. По имеющимся данным, например, в Чехословакии серьезно повреждены деревья на 200 тыс. га лесов именно в тех местах, где интенсивно сжигают бурый уголь с высоким содержанием серы. В Польше погибшие деревья в районах, где используется бурый уголь, обнаружены уже на 500 тыс. га. То же самое отмечено в Австрии, Швейцарии, Швеции, Германии, Голландии, Румынии, США и других странах. Кислотные дожди могут высвобождать из почв токсичный для растений алюминий.
Твердые частицы и оксиды серы, действуя совместно, вредно влияют и на здоровье людей. Серная кислота, растворяясь в каплях воды, образует едкий туман, вызывающий аллергию и другие заболевания. Частицы сульфатов железа могут создавать дополнительный канцерогенный потенциал в городском воздухе.
Из-за кислотных дождей под угрозой гибели оказалось не менее 20 % площади лесов ФРГ, Канады (рис. 3.9.).
На территории бывшего СССР площадь существенного закисления лесов достигла 46 млн га. В основном это результат переноса подкисленных осадков из Западной Европы в Прибалтийские республики, Карелию и на весь Северо-Запад России.
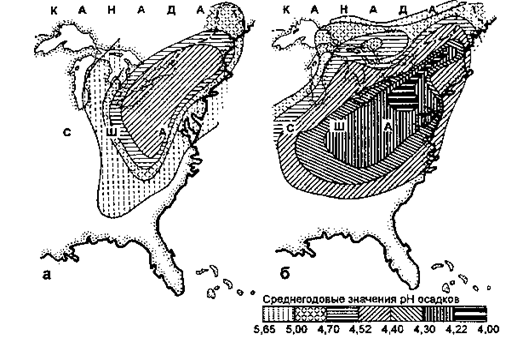
Рис. 3.9. Кислотные дожди на Востоке США:
а - 60-е гг.; б - 70-е гг. XX в.
Предотвращение последствий кислотных дождей - непростая проблема. В Швеции и США в порядке эксперимента было предпринято известкование озер. Известняк содержит карбонат кальция, который уменьшает кислотность воды и создает некоторый резерв сопротивляемости - буферную емкость:
СаСО3 + H2SO4 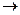 CaSO4
CaSO4 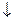 + H2О + CO2
+ H2О + CO2 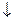 .
.
Известкование можно применять и для снижения кислотности почв в лесах. В Шварцвальде (Германия) в одном из лесов в почву внесли смесь сульфата магния (800 кгга-1) и известняка (2270 кгга-1). После такой обработки поврежденные деревья стали «выздоравливать».
Для борьбы с кислотными дождями используются те же технические средства, что и для ограничения выбросов оксидов серы и азота в атмосферу. Очистные установки различных конструкций хорошо известны. В 1982 г. Норвегия, Финляндия и Швеция предложили уменьшить выброс в атмосферу серы на 30 %. К ним присоединились Дания, Германия, Швейцария, Австрия, Канада. Великобритания и Франция отказались от таких обязательств. Канада же поставила целью снизить выбросы оксидов серы на 50 %.
В настоящее время по сравнению с 1975 г. выброс в атмосферу оксидов серы, несмотря на принятые меры, уменьшился примерно на 20 %. Многие источники и промышленные объекты, выбрасывающие оксиды серы, за этот период были просто перенесены из одного места в другое. Не следует забывать и о том, что при сжигании угля и в других промышленных производствах образуется большое количество твердых частиц. Транспортные средства также выбрасывают в воздух частицы солей свинца, капельки углеводородов, что обусловливает фотохимический смог.
Основные «поставщики» оксидов азота - выхлопные газы от автомобилей. Для борьбы с ними применяются каталитические конверторы и усовершенствованные двигатели. В США эти меры используются довольно широко, но в Европе пренебрегают контролем за выхлопными газами, хотя европейская автомобильная промышленность располагает необходимыми технологиями и на автомобили, экспортируемые в США, защитные устройства устанавливаются.
Дата добавления: 2021-11-16; просмотров: 795;











