Методические указания
Первый закон термодинамики
Сущность первого закона термодинамики. Внутренняя энергия. Работа процесса. Графическое изображение работы в рv-диаграмме. Теплота процесса. Принцип эквивалентности теплоты и работы. Аналитическое выражение и формулировка первого закона термодинамики. Энтальпия. Теплоемкость газов. Средняя и истинная теплоемкости, Теплоемкость смеси идеальных газов. Применение первого закона термодинамики к идеальному газу. Теплоемкость идеального газа при постоянном давлении и постоянном объеме. Энтропия. Вычисление изменения энтропии идеальных газов. Ts - диаграмма. Графическое изображение теплоты в диаграмме Ts.
Методические указания
Студент должен понять особенности применения в термодинамике общего закона сохранения и превращения энергии. Энергетические изменения, происходящие в термодинамической системе, определяют по изменению параметров рабочего тела, которое является объектом анализа.
Аналитическое выражение первого закона термодинамики имеет
две формы: 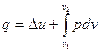 и
и 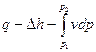 .
.
Следует четко разобраться в разнице понятий «работа расширения» и «располагаемая работа» и уметь дать (геометрическую интерпретацию их в pv – диаграмме.
Уясните принципиальную разницу между внутренней энергией, однозначно определяемой данным состоянием рабочего тела, а также работой и теплотой, которые появляются лишь при наличии процесса перехода рабочего тела из одного состоянии в другое и, следовательно, зависят от характера этого процесса. Следует понять разницу между функцией состояния и функцией процесса.
При изучении темы вводится еще одна функция (параметр) состояния, которая называется энтропией. Этот параметр служит лишь для упрощения термодинамических расчетов, а главное, позволяет графически изобразить теплоту, участвующую в процессе, в Ts - анаграмме. Уясните, как из выражения ds = dq/T можно установить знак теплоты, участвующей в процессе. Знание этого вопроса поможет при использовании Тs – диаграммой, на которой теплота 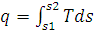 , т.е. площади под кривой процесса. В диаграмме Ts эта площадь определяет в масштабе количество теплоты, подведенной к рабочему телу, если ds>0 или отведенной от него, если ds<0.
, т.е. площади под кривой процесса. В диаграмме Ts эта площадь определяет в масштабе количество теплоты, подведенной к рабочему телу, если ds>0 или отведенной от него, если ds<0.
Уясните, почему для всех процессов, в которых рабочим телом является идеальные газ, всегда du = cv dT а dh = cPdT .
Литература: [1] с. 40—57, [2] с. 45—78.
Вопросы для самопроверки
1. Что такое внутренняя энергия рабочего тела? 2. Что такое теплота и работа процесса? 3. В чем сущность первого закона термодинамики? 4. Что такое энтальпия и энтропия? В чем они выражаются? 5. В чем разница между функцией состояния и функцией процесса? 6. Как доказать на примере идеального газа, что энтальпия и энтропия являются функциями состояния? 7. Как графически изобразить работу и теплоту процесса? 8. Что такое теплоемкость? Какие существуют теплоемкости? 9. В чем разница между средней и истинной теплоемкостями? 10. Как вычислить теплоемкость смеси идеальных газов? 11. Каков физический смысл удельной газовой постоянной? В чем физический смысл уравнения Майера? 12. Как вычислить изменение энтропии идеального газа?
Тема 3.Второй закон термодинамики
Круговые термодинамические процессы (циклы). Прямой и обратный (обратимый) циклы Карно. Сущность второго закона термодинамики и его основные формулировки. Аналитическое выражение второго закона термодинамики аналитическое выражение второго закона термодинамики. Изменение энтропии изолированной термодинамической системы. Максимальная работа и понятие об эксергии.
Дата добавления: 2022-05-27; просмотров: 228;











