Примесные выбросы ТЭС
При выходе в атмосферу выбросы содержат продукты реакций в твердой, жидкой и газовой фазах. Изменения состава выбросов после их выхода могут проявляться в виде: осаждения тяжелых фракция; распада на компоненты по массе и размерам; химических реакций с компонентами воздуха; взаимодействия с воздушными течениями, с облаками, с атмосферными осадками, с солнечным излучением различной частоты (фотохимические реакции) и др.
Газообразные выбросы образуют соединения углерода, серы и азота. Окислы азота практически не взаимодействуют с другими веществами в атмосфере и время их существования почти не ограничено. К числу таких примесей относятся прежде всего окись и двуокись углерода.
Сера. Одним из наиболее токсичных газообразных выбрасов энегоустановок является сернистый ангидрид – SO2. Он составляет примерно 99% выбросов сернистых соединений, содержащихся в уходящих газах котлоагрегатов (остальное количество приходится на SO3). Его удельная масса 2,93 кг/м3, температура кипения 195ºС. Продолжительность пребывания SO2 в атмосфере сравнительно невелика. Сернистый ангидрид принимает участие в каталитических, фотохимических и других реакциях, в результате которых окисляется и выпадает в сульфаты. В присутствии значительных количеств аммиака NH3 и некоторых других веществ время жизни SO2 исчисляется несколькими часами. В сравнительно чистом воздухе оно достигает 15-20 суток. В присутствии кислорода SO2 доокисляется до SO3 и вступает в реакцию с водой, образуя серную кислоту.
Конечные продукты реакций с участием SO2 распределяются следующим образом: в виде осадков выпадает на поверхность литосферы 43% и на поверхность гидросферы 32%; поглощается растениями 12%, и поверхностью гидросферы 13%. Накопление серосодержащих соединений происходит в основном в мировом океане.
Азот. В процессах горения азот образуется с кислородом ряд соединений: N2O, NO, N2O3, NO2, N2O4 и N2O5, свойства которых существенно различаются.
Окись азота NO – бесцветный слаборастворимый газ.
O2+N2→NO2+N-196 кДж/моль,
N+O2→NO+O+16 кДж/моль,
N2+O2↔2NO-90 кДж/моль.
Вследствие обратимости последней реакции равновесия концентрация может быть подсчитана по формуле:
(NO)p=4,6(NO2)1/2exp(-21500/RT),
т.е. с ростом температуры равновесная концентрация NO возрастает (здесь R – газовая постоянная). В присутствии воздуха NO доокисляется до NO2. Одновременно снижается время достижения равновесной концентрации. Например, при температуре 1700К для установления концентрации требуется 140 с.
Азотный ангидрид N2O5 — сильный окислитель. Взаимодействуя с водой, образует азотную кислоту.
Ввиду скоротечности реакций образования окислов азота и их взаимодействий друг с другом и с компонентами атмосферы, атакже из-за излучения учесть точное количество каждого из окислов невозможно. Поэтому обычно суммарное количество NOx приводят к NO2. Но для оценок токсического воздействия необходимо учитывать, что соединения азота, выбрасываемые в атмосферу, имеют различную активность и продолжительность существования: NO2 — около 100 ч, N2O — 4,5 года.
Аэрозоли подразделяются на первичные — непосредственно выбрасываемые в атмосферу, и вторичные — образующиеся при превращениях в атмосфере. Время существования аэрозолей в атмосфере колеблется в широких пределах — от минут до месяцев, в зависимости от многих факторов. Крупные аэрозоли в атмосфере на высоте до 1 км существуют 2—3 суток, в тропосфере — 5—10 суток, в стратосфере — до нескольких месяцев.
Подобно аэрозолям ведут себя и канцерогенные вещества, выбрасываемые или образующиеся в атмосфере. Однако точных данных о поведении этих веществ в воздухе практически нет.
Выбросы твердых частиц.Как показано в предыдущей главе, размеры частиц, выбрасываемых с продуктами сгорания топлива в атмосферу, могут сильно различаться. Скорость осаждения частиц определяется в зависимости от их размеров (D) и свойств (вязкости η, плотности ρ и др.), а также от свойств воздуха по уравнению вида
V = f(Dп, ρп, ρв, ηв …).
где индекс «п» относится к примеси, а «в» — к воздуху.
Выбросы влаги.Поступление влаги в атмосферу от энергетических объектов вызывается различными процессами, имеющими различные температуры и энергии (сгорание топлива, продувки, протечки и др.)-
Поведение влаги в атмосфере, в свою очередь, отличается разнообразием и связано с локальными концентрациями и фазовыми переходами. Несмотря на то, что фазовые переходы, в частности «парообразование — конденсация» и «затвердевание— плавление», изучены для многих случаев, протекание этих процессов для систем «водяной пар – вода - лед» в многообразных атмосферных условиях во многом еще неясно.
Фотохимические реакции. В поведении примесных выбросов в атмосфере важную роль играют фотохимические реакции.
Большая группа фотохимических реакций обусловлена присутствием в выбросах углеводородов и других органических веществ (в результате неполного сгорания), которые взаимодействуют с атмосферным водородом:
RH+O→R+OH
Образующиеся свободные радикалы R окисляются
R+O2+M→RO2+M
и взаимодействуют с кислородом, способствуя образованию озона:
RO2+O2→RO+O3
Упругость паров нитратов, образующихся при взаимодействии органических соединений с окислами азота, ниже, чем у исходных веществ. Поэтому они конденсируются, образуя весьма токсичные примеси. Например,
RO2+NO2→ПАН
где ПАН — пероксиацетилнитрат, весьма токсичное вещество. Значительная группа фотохимических реакций относится к соединениям серы. Сернистый газ, например, взаимодействует с атомарным кислородом и получается:
SO2+O+M→SO3+M,
2SO2+O2+hv→2SO3,
SO3+H2O→H2SO4
Вследствие низкой упругости пара серная кислота образует жидкий аэрозоль.
Предметом изучения экологии является охрана окружающей среды. Данное направление связано с энергетикой, так как энергетические объекты могут отрицательно воздействовать на окружающую среду, загрязняя ее.
Окружающая среда включает биосферу, которая охватывает нижнюю часть атмосферы, гидросферу и верхнюю часть литосферы (земная кора и верхняя мантия).
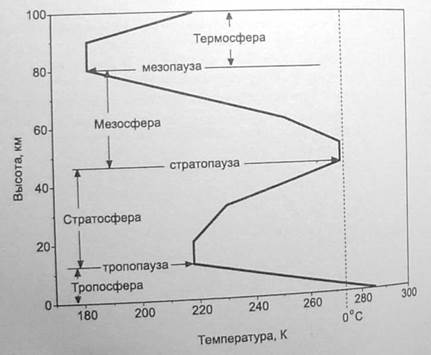
Атмосфера включает по высоте четыре области:
• тропосферу - от 0 до 10-12 км с падением температуры до -55 °С и давления до 41,0 мм рт. ст.;
• стратосферу - от 10-12 до 50-65 км с ростом температуры до 0 °С и падением давления до 8,9 мм рт. ст. в средней стратосфере и до 0,63 мм рт. ст. в верхней;
• мезосферу - от 50-55 до 80-90 км с падением температуры до -90 °С и давления до 0,04 мм рт.ст.;
• термосферу, простирающуюся от 80-90 до 200-300 км с непрерывным повышением температуры до сотен градусов.
Каждая зона атмосферы завершается областью постоянной температуры: тропопаузой, стратопаузой и мезопа-узой. Газы, накапливаясь в верхних слоях тропосферы и стратосферы, препятствуют выходу теплового инфракрасного излучения с поверхности Земли, нагретой Солнцем. Атмосфера и поверхность Земли нагреваются, пока уходящие потоки энергии не уравняются с приходящими.
Это явление представляет собой парниковый эффект.
В средней атмосфере присутствует озоновый слой. Молекулы озона поглощают солнечное излучение с длиной волн короче 290 нм и инфракрасное излучение с поверхности Земли с длиной волн 9-10 мкм, усиливая парниковый эффект.
Таким образом, озоновый слой участвует в обеспечении безопасного уровня ультрафиолетовой радиации и поддерживает устойчивый климат на Земле. В тропосфере и стратосфере озон также оказывает воздействие на антропогенные примеси, поступающие в атмосферу в результате деятельности человека, разрушая их.
Перечень рекомендованных Международным бюро по защите окружающей среды приоритетных мероприятий в области энергетики, направленных на снижение парникового эффекта.
♦ Более эффективное производство, передача и распределение энергии.
♦ Уменьшение энергоемкости обработки основных материалов.
♦ Внедрение энергоэффективных моторов и приводов.
♦ Повышение эффективности освещения и водяного отопления и, как следствие, снижение потребления первичного топлива.
♦ Использование возобновляемых видов энергии, и в частности фотоэлектрической, солнечно-тепловой, ветровой.
♦Производство биомассы для замены ископаемого твердого топлива, газификация биомассы.
♦ Внедрение совершенных, энергоэффективных га турбинных циклов.
♦ Развитие малой гидроэнергетики.
♦ Переход на природный газ.
Дата добавления: 2017-11-21; просмотров: 1390;











