Ядовитые газообразные примеси рудничного воздуха
Окись углерода (СО) — газ без цвета и запаха, удельный вес 0,97. Взрывается при концентрации 12,8—75%, температура воспламенения взрывчатой смеси с воздухом 630—810° С.
Окись углерода образуется при взрывных работах по породам и негорючим полезным ископаемым вследствие разложения взрывчатых веществ, а при взрывании по углю и сланцу, кроме того, выделяется из участвующих во взрыве угольной и сланцевой пыли и мелочи. Поэтому в настоящее время рекомендуется при расчете проветривания считать, что при взрывании по породе образуется 40 л условной окиси углерода на 1 кг взрывчатых веществ, а при взрывании по углю и сланцам — 100 л. При этом под условной окисью углерода понимается собственно СО, образовавшаяся при взрыве ВВ. и двуокись азота, пересчитанная на СО, считая 1 л NO2 равным 6,5 л СО.
В больших количествах образуется окись углерода при работе дизельных двигателей и двигателей внутреннего сгорания в случае применения для откатки при проведении тоннелей большого сечения , на открытых разработках и в калийных рудниках автотранспорта.
Громадные количества окиси углерода образуются при подземных пожарах и взрывах угольной пыли, а также при взрывах гремучего газа, если в этих взрывах принимает некоторое участие и угольная пыль. Особую опасность в этом отношении представляют пожары от самовозгорания углей, так как они часто не сразу обнаруживаются и в выработки начинает поступать окись углерода, которая может вызвать отравление людей.
В буроугольных шахтах комбината Александрияуголь происходит непрерывный процесс образования окиси углерода за счет низкотемпературного окисления угля. При остановках вентиляторов главного проветривания в очистных забоях этих шахт через 30 - 40 мин, а л подготовительных через 1—1,5 ч содержание окиси углерода обычно превышает санитарную норму, а через 3 - 4 ч достигает уже 0,01%. Газовая съемка показала, что выделение СО в очистных забоях на шахте № 2—3 этого комбината составляет в среднем 0.008 м3 /т. а на шахте № 3-бис 0,0055 м3/т. В подготовительных выработках газовыделение составляет на шахте № 2—3 в среднем 0,002 м3'мин на километр выработки, а на шахте № 3-бис 0.0014 м3/мин.
Отравляющее действие окиси углерода объясняется тем, что она значительно легче кислорода соединяется с гемоглобином крови (в 250—300 раз) и вместо оксигемоглобина (гемоглобин + кислород) по телу человека начинает циркулировать карбоксигомоглобин (гемоглобин + окись углерода), не поддерживающий жизненных функций организма, что приводит к кислородному голоданию. Степень отравления зависит от количества гемоглобина, связанного с окисью углерода. Если это количество превышает 60%, то человек теряет сознание и может наступить быстрая смерть. В легких случаях при отравлении возникают головная боль, головокружение, боль в висках, тошнота, мышечная слабость. Малые концентрации окиси углерода не вызывают отравления, однако они также оказывают вредное воздействие на человеческий организм.
Предельно допустимая концентрация окиси углерода в подземных выработках составляет 0.03 мг/ л, или 0,0017% по объему,
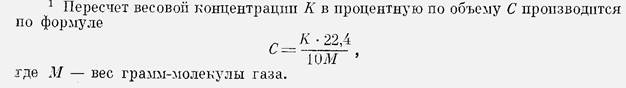
однако, в соответствии с Правилами безопасности, допуск рабочих в забои после взрывных работ разрешается при содержании ядовитых газов в пересчете на условную окись углерода, не превышающем 0,008%.
Тяжелое отравление окисью углерода может возникнуть после пребывания человека в течение 0,5—1 ч в атмосфере, содержащей 0,128% СО, а при концентрации 0.4% СО даже кратковременное вдыхание такого воздуха является смертельно опасным.
Сероводород (H2S) — газ, обладающий резким запахом тухлых яиц. удельный вес 1.19. При концентрациях 4,3 - 45,5% взрывается. Образуется в шахтах при гниении органических веществ, разложении водой серного колчедана и гипса, горении угольных пластов, при взрывных работах (неполные взрывы) и при горении огнепроводного шнура. Сероводород выделяется из пород и полезного ископаемого совместно с другими газами (из угля, каменной соли, из нефтяных, озокеритовых и серных месторождений), а также из минеральных источников, пересекаемых выработками.
Иногда в трещинах и пустотах скапливается большое количество сероводорода, вследствие чего имели место случаи бурных выделении этого газа при обуривании забоев и при взрывных работах.
Сероводород хорошо растворяется в воде. Так, при нормальных условиях в одном объеме воды растворяется 3,24 объема сероводорода. Поэтому необходимо соблюдать осторожность при передвижении по обводненным выработкам, в воздухе которых ощущается залах сероводорода, так как при возмущении воды газ может выделиться из нее. Эта особенность сероводорода известна давно. Еще И. IIIлаттер в своем курсе горного искусства (1760 г.) писал: «Сей род худого воздуха наипаче ложится на воде, в ямах находящейся наподобие синей перепонки. Когда оная вода каким-нибудь случаем перемутится, то вредительные пары подымаются и причиняют опасные следствия».
При больших концентрациях сероводорода в атмосфере выработок он обладает сильным отравляющим действием, так как нарушает внутритканевое дыхание (ткани перестают усваивать кислород). При легком отравлении возникает раздражение слизистых оболочек глаз и верхних дыхательных путей, начинаются головная боль, одышка, сердцебиение. В тяжелых случаях при содержании в воздухе более 0,066% H2S человек теряет сознание, в дальнейшем возможен отек легких.
Предельно допустимая концентрация сероводорода в воздухе подземных выработок — 0,00066 %. Присутствие небольших количеств этого газа в воздухе легко обнаруживается по запаху, а при большой концентрации сероводород производит на органы обоняния анестезирующее действие и по запаху не обнаруживается.
Сернистый газ (SO2) — тяжелый газ с удельным весом 2,2, обладающий резким запахом и действующий раздражающе на слизистые оболочки глаз и дыхательных путей. Выделяется иногда из пород и полезного ископаемого вместе с другими газами. Известны случаи выделения SO2 совместно с метаном из углей. В рудниках сернистый газ образуется при ведении взрывных работ по серным и колчеданным рудам в результате сгорания и взрывов серосодержащей пыли, осевшей на стенках шпуров и поверхности выработок вблизи забоя. Борьба с образованием сернистого газа в этих случаях ведется путем тщательной очистки шпуров от буровой мелочи и обильного орошения водой забоя и примыкающей к нему части выработки.
Длительное вдыхание воздуха, содержащего небольшие количества сернистого газа, приводит к заболеванию хроническим гастритом, бронхитом, ларингитом и эмфиземой легких. При высоких содержаниях возникают тяжелый бронхит и спазмы голосовой щели. Предельно допустимая концентрация этого газа равна 0.01 мг/'л, или 0,00035% по объему. При вдыхании в течение часа воздуха, содержащего 0,02% сернистого газа, может возникнуть опасное отравление. Присутствие в воздухе сернистого газа даже в незначительных концентрациях обнаруживается по резкому запаху и разъедающему действию, вызывающему слезотечение.
О к и с л ы азота образуются при взрывчатом разложении нитроглицериновых и аммиачно-селитренных взрывчатых веществ. Наибольшей устойчивостью обладает двуокись азота NO2 — газ бурого цвета с удельным весом 1,6. Этот газ легко обнаруживается по цвету и резкому запаху задолго до возникновения опасной концентрации.
Окислы азота хорошо растворяются в воде, вследствие чего при взрывных работах в сырых забоях концентрация их с течением времени даже при неудовлетворительном проветривании снижается. Газ действует раздражающе на слизистые оболочки дыхательных путей, однако его действие проявляется не сразу, а только через 6 ч и более.
При легкой степени отравления появляется кашель, общее недомогание, иногда рвота. Тяжелая степень отравления приводит к отеку легких. Предельно допустимая концентрация равна 0,004 мг/л, или 0,0002% по объему, смертельная опасность возникает при концентрации около 0,02%.
Формальдегид НСНО — бесцветный газ с удельным весом 1,035, обладающий резким удушливым запахом. Действует на слизистые оболочки и центральную нервную систему и вызывает конъюнктивиты, насморк, бронхиты. Содержится в выхлопных газах бензиновых двигателей и двигателей внутреннего сгорания совместно с окисью углерода и окислами азота. При работе двигателей под нагрузкой содержание альдегидов в выхлопных газах бензиновых двигателей по некоторым данным может достигать 0,137%, а двигателей внутреннего сгорания — 0,031 %. Предельно допустимая концентрация равна 0,005 мг!л, или 0,00037% по объему.
Пары акролеина. Акролеин — бесцветная легколетучая жидкость с резким запахом пригорелых жиров, образующаяся при разложении дизельного топлива под воздействием высоких температур. Тяжелые пары акролеина с удельным весом около 1,9 встречаются в тех горных выработках, где работают автосамосвалы (дизелевозы). Пары акролеина ядовиты и вызывают раздражение слизистых оболочек, головокружение, тошноту. Предельно допустимая концентрация их в воздухе равна 0,002 мг/л, или 0,00008% по объему. Кратковременное пребывание в атмосфере, содержащей 0,014% акролеина, смертельно.
Эманации радиоактивных веществ.Газообразные эманации радиоактивных веществ представлены радоном, тороном и актиноном, которые образуются в процессе альфа-распада радия, тория и актиния.
Эманации накапливаются в порах и трещинах горных пород и вместе с другими газами мигрируют в сторону горных выработок. Период полураспада у радонаравен 3,825 суток, у торона 54,5 сек, у актинона 3,92 сек.
Торон и актинон вследствие малого периода полураспада перемещаются по трещинам на короткие расстояния и редко встречаются в горных выработках в опасных концентрациях.
Основную опасность представляет радон, который несмотря на малую проникающую способность выделяемых им альфа-лучей приводит к заболеванию организма лучевой болезнью, так как проникает в легкие вместе с вдыхаемым воздухом и растворяется в крови.
Компрессорные газы. Так называются вредные газообразные примеси (в основном окись углерода и метан), которые иногда обнаруживаются в сжатом воздухе, приводящем в действие пневматические шахтные механизмы. Компрессорные газы возникают при возгонке смазочного масла под действием нагретых деталей компрессора. Чтобы избежать образования этих газов, смазку компрессоров необходимо производить только специально предназначенным для этого маслом.
Газы, образующиеся при взрывных работах. При разложении взрывчатых веществ образуется смесь газов, состоящая из углекислого газа, окиси углерода, азота и его окислов — NO, NO2 и иногда N2O5, а также сернистого газа S02, который образуется главным образом при взрывании по колчеданным рудам. В небольшом количестве может образовываться сероводород, главным образом при горении огнепроводного шнура.
Характеристика перечисленных газов приведена выше. Для получения представления об общей токсичности смеси этих газов их пересчитывают на условную окись углерода, принимая 1 л N02 эквивалентным 6,5 л СО. Общее количество и состав образующихся при взрывании ВВ ядовитых газов непостоянны и зависят от вида ВВ. влажности, полноты детонации, минерального состава среды, в которой производится взрыв, и ряда других факторов.
В настоящее время, как указывалось выше, принято считать, что при взрывных работах по рудам и породам при взрыве 1 кг ВВ образуется 40 л условной окиси углерода, а при взрывании по углю 100 л.
Близкое к этому количество газов выделяется и при ведении взрывных работ по горючим сланцам.
РУДНИЧНЫЙ ГАЗ
Термин «рудничный газ» обычно применяют для обозначения смеси газов, главным компонентом которой является метан. Газ этот опасен тем, что в смеси с воздухом он способен взрываться. Чаще всего метан выделяется на угольных шахтах, однако он встречается и при разработке месторождений других полезных ископаемых . Единичные взрывы рудничного газа в Англии происходили еще в XVI1 —XV111 вв. Так Шлаттер указывал, что он был очевидцем взрыла на одной из шахт Ньюкастля в 1724 г., когда при взрыве «дикого огня», как его тогда называли, погибли 31 человек и 19 лошадей. В XIX в. взрывы участились, и только во Франции с 1820 по 1882 г. произошло 800 взрывов.
Первый анализ выделяющегося в угольных шахтах рудничного газа был произведен Дэви в 1813 г. Анализ показал, что газ состоит из метана, азота и углекислого газа, а в некоторых случаях в нем содержатся также водород и этилен.
В России рудничный газ появился впервые в конце 70-х годов прошлого века в шахтах Донбасса. В 80-х годах выделения были уже настолько интенсивными, что в ряде забоев в специально пробуренные шпуры вставлялись металлические трубки («рожки»), по которым выделялся газ. Газ этот поджигался и горел иногда в течение нескольких лет, давая пламя высотой до 1 м.
Первый анализ проб рудничного газа, взятых в «Ново-Калимальной» шахте Иловайского в 1888 г., показал содержание метана до 20,5 %, присутствие углекислого газа и азота. В пробах, взятых в 1890 г. в Рыковских копях из «рожка», содержание СН4 составляло 51,96%, СО, — 0,29%, О2 — 8,09% и N2 — 39,66%.
В январе 1891 г. в Рыковских копях произошел первый в России крупный взрыв рудничного газа, сопровождавшийся гибелью 54 человек.
Метан.
Свойства метана
Метан (СН4) — газ без цвета и запаха, удельный вес 0,554. При концентрации до 4,5% горит в месте соприкосновения с источником воспламенения голубым пламенем, при содержании 4,5—16 % взрывается, давая взрыв максимальной силы при 9,5% СН4. При содержании метана, превышающем 10%, будучи воспламенен, он горит, но лишь при условии притока кислорода извне. Указанные пределы справедливы лишь для чистого метана. Примесь водорода и этана снижает нижний предел образования взрывчатой смеси, а уменьшение содержания кислорода в воздухе повышает нижний и понижает верхний пределы взрываемости.
Температура воспламенения метана около 650—750о С. При соприкосновении с источником воспламенения метан взрывается не сразу, а с некоторым опозданием, величина которого при температуре воспламенителя Т = 650° С достигает 10 сек, а с увеличением Т уменьшается и при 1000е С сокращается до 1 сек. Примесь к метану других горючих газов, например водорода, также сокращает время запаздывания и при примеси 30% Н2 запаздывания не наблюдается.
Метан при концентрации свыше 4,5% способен не только взрываться, но и гореть сравнительно спокойным пламенем. Этим свойством метана широко пользовались при работе в шахтах, опасных по газу, в прошлом столетии, «выжитая» метан перед началом рабочей смены. По мере перехода на искусственное проветривание шахт и значительного увеличения подачи свежего воздуха от этого опасного способа борьбы с выделяющимся рудничным газом повсеместно отказались. Спокойное горение метана может перейти во взрыв, если возникают условия, способствующие сжатию метана (сужение выработок, наличие в них предметов, загромождающих живое сечение), а также причины, со действующие возмущению взрывоопасной смеси.
Взрывы метана сопровождаются прямым и обратным ударами. Прямой удар возникает за счёт расширения воздуха в месте взрыва под влиянием высокой температуры, доходящей до 2650 С, воздушная волна при этом направлена от места взрыва.
Процесс сгорания метана идет в соответствии с реакцией
СН4 + 2О2 = СО2 + 2Н2О.
Так как образующиеся пары воды конденсируются, то из трех объемов воздушно-газовой смеси, принимающих участие во взрыве, остается только один объем СО2 и в области взрыва создается зона пониженного давления, в которую устремляется воздух из других выработок, создавая обратный удар. Обратный удар может причинить не меньшие разрушения, чем прямой, так как распространяется по выработкам, уже подвергшимся действию взрывной волны.
Дата добавления: 2017-11-21; просмотров: 4673;











