Основные классы и номенклатура неорганических соединений
По функциональным признакам неорганические соединения подразделяются на классы в зависимости от характерных свойств, проявляемых ими в химических реакциях. Существует четыре класса неорганических соединений: оксиды, основания, кислоты и соли.6
Оксиды – это соединения элементов с кислородом, в которых кислород проявляет степень окисления 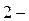 .7 По химическим свойствам оксиды подразделяют на несолеобразующие (безразличные) и солеобразующие. Последние в свою очередь делят на основные, кислотные и амфотерные.
.7 По химическим свойствам оксиды подразделяют на несолеобразующие (безразличные) и солеобразующие. Последние в свою очередь делят на основные, кислотные и амфотерные.
Основныминазываются оксиды,которые образуют соли при взаимодействии с кислотами или кислотными оксидами 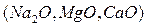 :
:
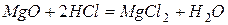 ,
,
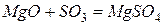 .
.
Кислотными оксидаминазываются оксиды, образующие соли при взаимодействии с основаниями или основными оксидами:
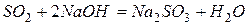 ,
,
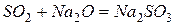 .
.
Присоединяя прямо или косвенно воду, кислотные оксиды образуют кислоты:
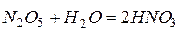 ,
,
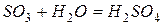 .
.
Поскольку кислотные оксиды могут быть получены и обратным путём – за счёт выделения воды из кислот, то их также называют ангидридами кислот.
Амфотерными называются оксиды,которые образуют соли при взаимодействии как с кислотами, так и с основаниями. К амфотерным оксидам относятся, например, 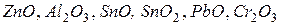 и т.д.:
и т.д.:
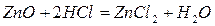
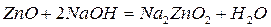
Несолеобразующие оксиды(их немного) не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся: 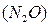 – оксид азота
– оксид азота 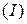 8,
8, 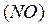 – оксид азота
– оксид азота 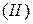 ,
, 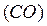 – оксид углерода
– оксид углерода 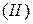 и др.
и др.
Структурные формулы оксидов и других соединений играют важную роль в понимании структурных и химических свойств соединений, поэтому необходимо научиться правильно составлять их. При изображении графических формул следует пользоваться понятием «валентность» или «степень окисления», причём каждой «единице» валентности или степени окисления соответствует валентный штрих: 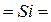 ,
, 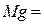 ,
, 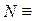 . Это означает, что речь идёт о кремнии
. Это означает, что речь идёт о кремнии 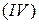 , магнии
, магнии 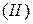 , азоте
, азоте 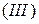 .
.
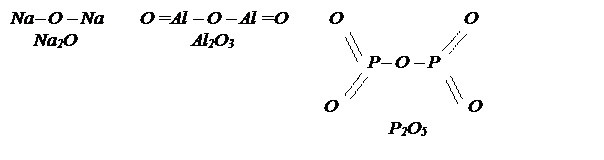
Другой принцип построения графических формул заключается в том, что в большинстве молекул оксидов атомы элементов, если их больше одного, соединяются через кислород:
Кислоты –это сложные вещества,содержащие атомы водорода, которые могут замещаться атомами металла. Общая формула кислот:
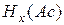 ,
,
где 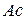 – кислотный остаток (от английского слова
– кислотный остаток (от английского слова 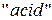 - кислота);
- кислота); 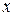 – число атомов водорода, равное валентности кислотного остатка.
– число атомов водорода, равное валентности кислотного остатка.
Примеры кислот: 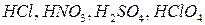
Классификацию кислот производят:
а) по основности, т.е. по числу атомов водорода, которые в молекуле кислоты могут замещаться атомами металла.
По основности кислоты делятся на:
-одноосновные ( 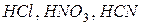 и др.);
и др.);
- двухосновные ( 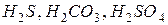 и др.) и т.д.
и др.) и т.д.
Кислоты, молекулы которых содержат два и более атомов водорода, называются многоосновными;
б) по содержанию атомов кислорода в молекуле кислоты делятся на:
- бескислородные ( 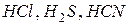 и др.);
и др.);
- кислородсодержащие ( 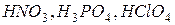 и др.).
и др.).
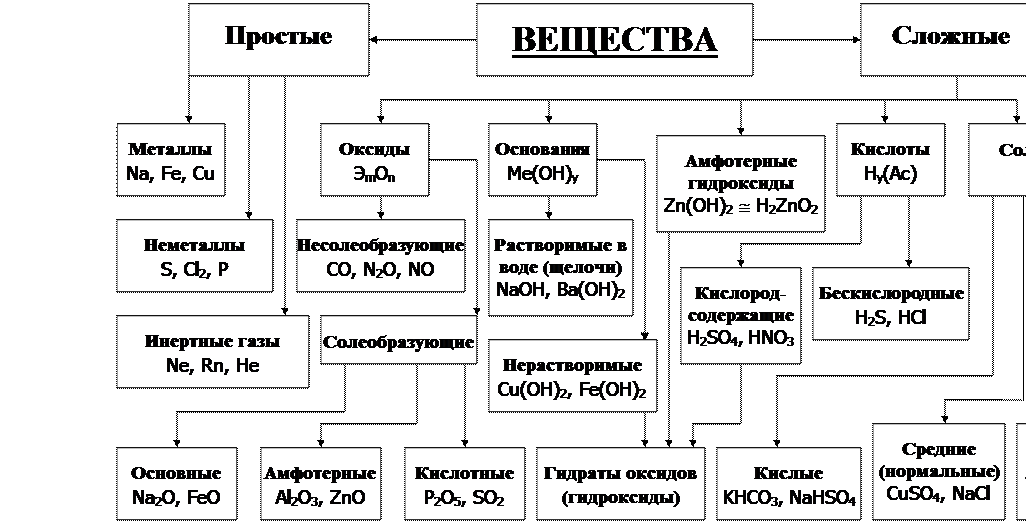 Таблица 1.1 – Основные классы неорганических веществ
Таблица 1.1 – Основные классы неорганических веществ
Кислородсодержащие кислоты называются оксокислотами.Они являются гидратами кислотных оксидов, т.е. продуктами соединения кислотных оксидов с водой.
Например:
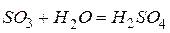
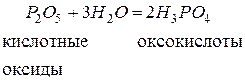
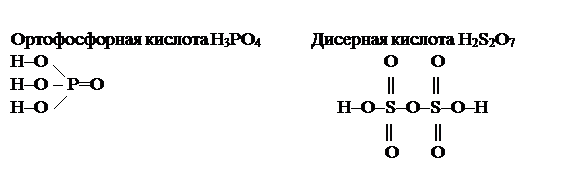 |
Графические формулы молекул кислот строят следующим образом. Если в эмпирической формуле кислоты в кислотном остатке содержится два центральных атома, то они соединяются через кислород:
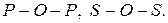 Атомы водорода присоединяются к центральному атому через кислород, а остающиеся атомы присоединяются к центральному атому двумя валентными штрихами. Если центральных атомов два, то атомы водорода и кислорода делятся между ними поровну:
Атомы водорода присоединяются к центральному атому через кислород, а остающиеся атомы присоединяются к центральному атому двумя валентными штрихами. Если центральных атомов два, то атомы водорода и кислорода делятся между ними поровну:
Основания–это сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксильных групп 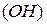 . Общая формула оснований
. Общая формула оснований 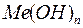 , где
, где 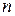 - число гидроксильных групп, равное валентности металла.
- число гидроксильных групп, равное валентности металла.
Примеры оснований: 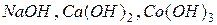 .
.
Классификацию оснований проводят:
а) по числу гидроксильных групп в молекуле. Количество гидроксильных групп в молекуле основания зависит от валентности металла и определяет кислотность основания.По этому признаку основания делятся на однокислотные ( 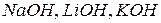 и др.), двукислотные (
и др.), двукислотные ( 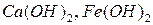 и др.) и т.д.
и др.) и т.д.
Двух- и трёхкислотные основания называются многокислотными;
б) по растворимости в воде основания делятся на:
 - растворимые (
- растворимые ( 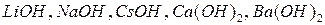 );
);
- нерастворимые ( 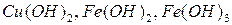 и др.). Растворимые в воде основания называются щелочами.
и др.). Растворимые в воде основания называются щелочами.
Среди оснований выделяют такжеамфотерные гидроксиды -сложные вещества, которые имеют свойства кислот и свойства оснований.
Примеры амфотерных гидроксидов:
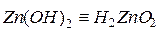
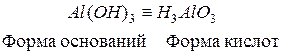
Для удобства амфотерным гидроксидам можно придать форму либо кислоты, либо основания, например, 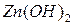 и
и 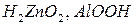 и
и 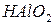
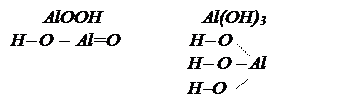 |
. Традиционно их называют и как кислоты, и как основания:
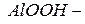 гидроксид оксоалюминия или метаалюминиевая кислота;
гидроксид оксоалюминия или метаалюминиевая кислота; 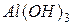 или
или 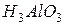 - тригидроксид алюминия или ортоалюминиевая кислота. Графическое изображение амфотерных гидроксидов строятся по аналогии с основными гидроксидами и кислотами:
- тригидроксид алюминия или ортоалюминиевая кислота. Графическое изображение амфотерных гидроксидов строятся по аналогии с основными гидроксидами и кислотами:
Соли– это сложные вещества, которые являются продуктами замещения атомов водорода в молекулах кислот атомами металла или продуктами замещения гидроксильных групп в молекулах оснований кислотными остатками.
Например:
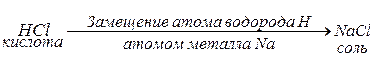 ;
;
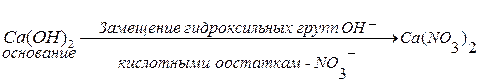 .
.
Состав нормальных (средних) солей выражается общей формулой:
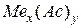 ,
,
где 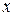 – число атомов металла;
– число атомов металла; 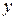 – число кислотных остатков.
– число кислотных остатков.
Соли делятся на три типа: нормальные (средние), кислые и основные.
Нормальные (средние) соли – это продукты полного замещения атомов водорода в молекуле кислоты атомами металла или продуктами полного замещения гидроксильных групп в молекуле основания кислотными остатаками.
 |
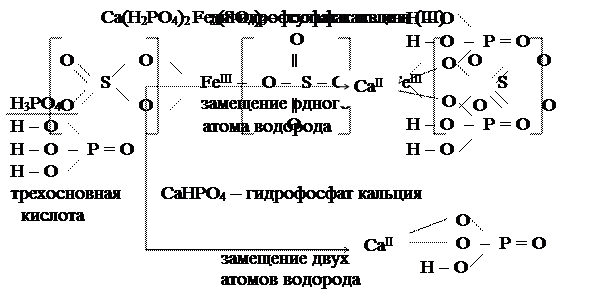
Кислые соли – это продукты неполного замещения атомов водорода в молекулах многоосновных кислот атомами металла.
Например:
Двухосновная кислота с любым металлом образует одну нормальную соль и одну кислую соль.
Трёхосновная кислота с любым металлом образует нормальную соль и две кислые соли.
Названия кислых солей состоят из приставки «гидро-» или «дигидро-» и в круглых скобках указывается валентность металла. Например: 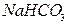 – гидрокарбанат натрия,
– гидрокарбанат натрия, 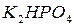 – гидрофосфат калия,
– гидрофосфат калия, 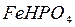 – гидрофосфат железа
– гидрофосфат железа 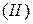 .
.
Приставка «дигидро-» используется, если в молекуле кислой соли с одним кислотным остатком связаны два атома водорода.
Например: 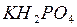 - дигидрофосфат калия.
- дигидрофосфат калия.
Основные соли – это продукты неполного замещения гидроксильных групп в молекулах многокислотных оснований кислотными остатками. Примеры основных солей: 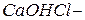 гидроксохлорид кальция;
гидроксохлорид кальция; 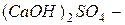 гидроксосульфат кальция;
гидроксосульфат кальция; 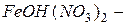 гидроксодинитрат железа
гидроксодинитрат железа 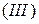 .
.
Молекулы основных солей содержат гидроксильные группы (сокращенное название гидроксильной группы – «гидроксо-»), поэтому в их названиях содержится эта приставка.
Приставка «дигидроксо-» используется, если в молекуле основной соли с одним атомом металла связаны две гидроксильные группы.
Например: 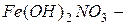 дигидроксонитрат железа
дигидроксонитрат железа 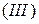 .
.
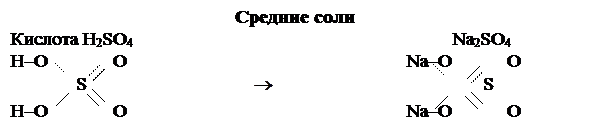
В графических формулах солей должны сохраняться графические формулы кислотных и основных остатков. Если кислотный остаток произведён от кислородной кислоты, то атом металла присоединяется к кислотному остатку через кислород. Например:
Кислые соли
Основные соли
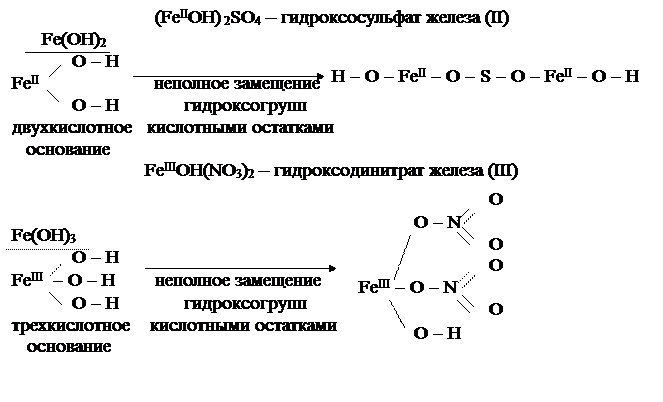
Систематическое название неорганического соединениячитается справа налево по изображённой формуле, записанной по определённым правилам, согласно которым на первое место всегда ставится электроположительная (катион), а на второе – электроотрицательная (анион) составляющие.
Бинарные (двухэлементные) соединения–соединения элементов с кислородом (оксиды), галогенами (галиды), серой (сульфиды), азотом (нитриды), фосфором (фосфиды), углеродом (карбиды), соединения металлов с водородом (гидриды). Названия бинарных соединений образуются из названия более электроотрицательного элемента с окончанием «ид» и русского названия менее электроотрицательного элемента. Например: 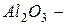 оксид алюминия, а с другой стороны
оксид алюминия, а с другой стороны 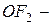 фторид кислорода, так как фтор более электроотрицательный элемент, чем кислород;
фторид кислорода, так как фтор более электроотрицательный элемент, чем кислород; 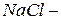 хлорид натрия,
хлорид натрия, 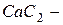 карбид кальция и т. д. Если менее электроотрицательный элемент может находиться в различных состояниях окисления, то в скобках указывают римскими цифрами его степень окисления:
карбид кальция и т. д. Если менее электроотрицательный элемент может находиться в различных состояниях окисления, то в скобках указывают римскими цифрами его степень окисления: 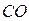 – оксид углерода
– оксид углерода 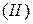 ,
, 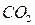 - оксид углерода
- оксид углерода 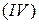 ,
, 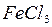 – хлорид железа
– хлорид железа 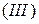 .
.
Вместо степени окисления менее электроотрицательного атома в названии бинарного соединения можно указывать греческими числами (моно – один, ди – два, три – три, тетра – четыре, пента – пять, гекса – шесть и т.д.) число атомов более электроотрицательного элемента, входящих в состав соединения: СО – монооксид углерода, СО2 – диоксид углерода, FeCl3 – трихлорид железа, 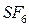 – гексофторид серы.
– гексофторид серы.
В соединениях металлов друг с другом (интерметаллидах) символы элементов указываются в алфавитном порядке: 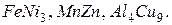
Количество одинаковых атомов или атомных групп в формуле указывается арабскими цифрами в виде правого нижнего индекса в круглых или квадратных скобках9
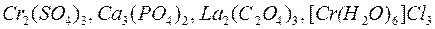 .
.
В кристаллогидратах число молекул воды указывается арабскими цифрами:
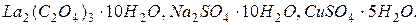
Одноатомные катионыназывают по русскому названию элемента в родительном падеже с указанием степени окисления в скобках в виде арабской 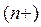 или римской цифры:
или римской цифры: 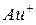 - катион золота
- катион золота 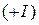 ,
, 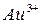 - катион золота
- катион золота 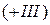 ,
, 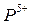 - катион фоcфора
- катион фоcфора 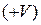 .
.
Указание степени окисления опускают, если возможен только один катион: 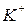 - катион калия,
- катион калия, 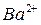 - катион бария.
- катион бария.
Сложные катионы,образованные присоединением протона к нейтральной молекуле, называются с прибавлением окончания «-оний» или «-ий»: 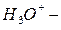 катион оксония (оксоний),
катион оксония (оксоний), 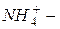 катион аммония (аммоний).
катион аммония (аммоний).
Сложные катионы многозарядных ионов металлов, содержащие кислород, называются с прибавлением окончания «-ил» к корню русского названия элемента: 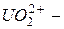 уранил,
уранил, 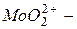 молебденил,
молебденил, 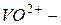 ванадил.
ванадил.
Анионы,состоящие из одного атома или нескольких одинаковых атомов, называют по элементу с окончанием «-ид»:
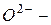 оксид,
оксид, 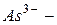 арсенид,
арсенид, 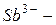 антимонид,
антимонид, 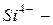 силицид,
силицид, 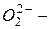 пероксид,
пероксид, 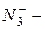 азид.
азид.
Некоторые многоатомные анионы имеют собственное название: 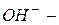 гидроксид,
гидроксид, 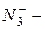 азид,
азид, 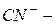 цианид,
цианид, 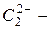 ацетиленид.
ацетиленид.
Сложные гетероатомные анионыэлементов в высшей степени окисления оканчиваются на «-ат» ( 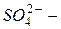 сульфат,
сульфат, 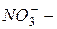 нитрат,
нитрат, 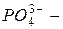 фосфат); окончание «-ит» указывает на более низкую степень окисления (
фосфат); окончание «-ит» указывает на более низкую степень окисления ( 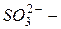 сульфит,
сульфит, 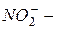 нитрит,
нитрит, 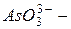 арсенит).
арсенит).
Название соли начинается с аниона в именительном падеже с соответствующим окончанием («-ид», «-ат», «-ит») и катиона в родительном падеже ( 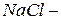 хлорид натрия,
хлорид натрия, 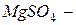 сульфат магния,
сульфат магния, 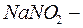 нитрит натрия).
нитрит натрия).
[1] Индекс 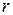 начальная буква слова
начальная буква слова 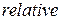 - относительный.
- относительный.
[2] Основность кислоты определяется числом атомов водорода, входящих в её состав.
[3] Кислотность основания определяется числом гидроксильных групп (ОН), входящих в его состав.
4 Нормальные условия (н.у): 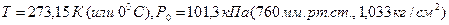 .
.
5 Стандартные условия: 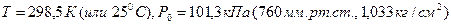 .
.
6 При чтении этого раздела внимательно изучите таблицу 1.1, в которой указаны важнейшие классы неорганических соединений и их взаимосвязи.
7 С чем связано такое определение? Оказывается существуют соединения элементов с кислородом, которые по своему составу относятся к классу оксидов, но по своему строению и свойствам принадлежат к классу солей. Это так называемые пероксиды – соли пероксида водорода H2O2, например, Na2O2, BaO2. Характерной особенностью строения этих соединений является наличие в их структуре двух связанных между собой атомов кислорода: – O – O –. Другой пример, это немногочисленные соединения типа OF2. Каждый из указанных соединений проявляет свойства, отличающие их от оксидов. Так, пероксид натрия Na2O2 при действии на него кислоты образует H2O2, а не воду, OF2 при взаимодействии с кислотами и щелочами выделяет кислород.
8 В этом разделе и в дальнейшем часто используются арабские цифры – 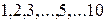 ;
;
римские цифры – 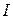 ,
, 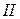 ,
, 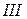 ,
, 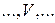 ,
, 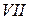 ,
, 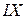 ,
, 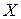 .
.
9 Комплексный ион или нейтральное координационное соединение непременно заключается в квадратные скобки.
Дата добавления: 2016-06-05; просмотров: 5728;










