Очистка восстановлением
При содержании в сточных водах легко восстанавливаемых соединений меди, хрома, мышьяка, ртути применяют методы восстановительной очистки.
Катионы меди, содержащиеся в кислых сточных водах, могут быть выделены цементацией на железном скрапе или никелевом песке. При этом протекают следующие реакции восстановления:
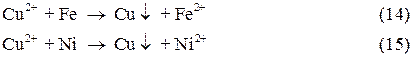
Медь выделяется на железе или никеле в виде металла, и вместо нее в раствор переходят катионы железа или никеля. Метод цементации применяют для грубой, предварительной очистки достаточно концентрированных по меди сточных вод. Очищенная цементацией вода затем нейтрализуется до 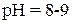 при одновременной доочистке ее от оставшихся катионов меди и перешедших в раствор катионов железа или никеля.
при одновременной доочистке ее от оставшихся катионов меди и перешедших в раствор катионов железа или никеля.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ОЧИСТКИ СТОЧНЫХ ВОД
Физико-химические методы играют существенную роль при обработке производственных сточных вод. К ним относятся следующие: коагуляция и флокуляция, сорбция, ионный обмен, экстракция, различные электрохимические методы, мембранные методы (обратный осмос, ультрафильтрация) и др. Эти методы используют как самостоятельно, так и в сочетании с механическими, биологическими и химическими методами очистки. В настоящее время область применения физико-химических методов очистки расширяется. Наиболее эффективное применение физико-химических методов достигается в локальных системах очистки сточных вод промышленных предприятий.
Коагуляция
Коагуляция – это процесс укрупнения дисперсных частиц за счет их взаимодействия и объединения в агрегаты. Мелкие (первичные) частицы в таких агрегатах соединены силами межмолекулярного взаимодействия. Вещества, способные вызвать коагуляцию частиц называют коагулянтами или гидролизующимися коагулянтами. Последние не только вызывают коагуляцию частиц загрязнений, но и образуют, гидролизуясь, малорастворимые продукты, способные объединяться в крупные хлопья.
При очистке производственных сточных вод основное применение нашел процесс гетерокоагуляции, который можно определить, как взаимодействие коллоидных и мелкодисперсных частиц сточных вод с агрегатами, образующимися при введении в сточную воду коагулянтов.
Наиболее часто в практике очистки сточных вод используют соли алюминия и железа, которые гидролизуются в соответствии со следующими реакциями:
Al2(S04)3 + 6Н20=2А1(ОН)3 + 3H2S04 (1)
FeCl3 + 3H20=Fe(OH)3 + 3HC1 (2)
FeS04 + 2H20=Fe(OH)2 + H2S04 (3)
В результате протекания указанных реакций образуются малорастворимые гидроксиды алюминия и железа, обладающие развитой хлопьевидной поверхностью, на которой сорбируются мелкодисперсные и коллоидные примеси, оседающие затем на дно отстойника и образующие осадок. Образующиеся по приведенным реакциям кислоты (HCl, H2S04) нейтрализуют щелочными реагентами. Возможна также нейтрализация указанных кислот за счет взаимодействия с бикарбонатионами, присутствующими в сточных водах.
Рассмотрим в качестве примера строение мицеллы гидроксида железа (рис. 1). Основу коллоидной частицы составляют микрокристаллы труднорастворимого Fe(OH)3 называемые агрегатами. В результате избирательной адсорбции на поверхности агрегата образуется положительно заряженный слой, состоящий из nионов водорода (потенциалообразующие ионы, сокращенно).
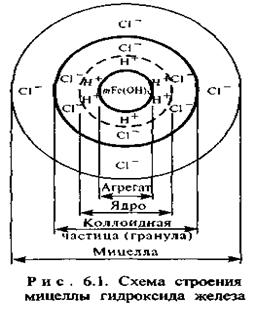 |
Агрегат вместе с потенциалообразующими ионами образует ядро. Под действием электростатических сил притяжения у ядра формируются слой ионов противоположного знака – противоионов, компенсирующих частично заряд ядра. В рассмотренном примере их роль выполняют ионы Сl-. Частицу с окружающим ее плотным слоем ионов называют гранулой.
Гранула характеризуется двойным электрическим слоем, который образуется из потенциалообразующих ионов и противоионов. Потенциал, характеризующий двойной слой ионов, называется электрокинетическим или ζ-потенциалом (дзета-потенциалом). Он представляет собой электрический потенциал в двойном слое на границе между частицей, способной к движению в электрическом поле и окружающей жидкостью.
Дата добавления: 2017-09-01; просмотров: 1638;











