От температуры воды (по А.Н. Державину)
| Средняя температура воды, °С | |||||||||
| Часы | 80.0 | 71.0 | 64.3 | 59.8 | 55.9 | 52.5 | 19.3 | 46.5 | 44.0 |
Различные стадии развития одного и того же вида могут характеризоваться разной шириной диапазона оптимальных температур. Его ширина увеличивается по мере дифференцировки организма — от начала дробления зиготы до конца гаструляции начала нейруляции. Однако из этого правила существуют исключения, оно более приемлемо для эвритермных рыб, эмбриональное развитие которых происходит в относительно узком диапазоне температур, начинаясь с вполне определённых нерестовых температур и расширяясь к концу эмбриогенеза и далее в постэмбриональном развитии.
У эвритермных рыб диапазон температурной толерантности расширяется также и в процессе онтогенеза. При этом важным фактором является не только величина температуры, но и диапазон, а также частота перемен её величин, то есть осцилляция. Установлено, что осцилляция температуры в пределах экологической валентности вида ускоряет рост особей относительно выращиваемых при стабильных температурах и приравнивается к темпу роста при верхней границе диапазона температурного оптимума. Амплитуда и частота колебаний температуры, а также скорость её изменения видоспецифичны для оптимального роста рыб. У стенотермных видов указанные параметры значительно ниже, чему эвритермных. Степень этого различия коррелирует с температурой, наблюдаемой в термике естественных местообитаний рыб. Существенное повышение скорости роста, улучшение физиологического состояния и более эффективное использование потребленной энергии на рост, отмечаемые у молоди рыб при переменном термическом режиме, говорят о перспективности его использования в индустриальных условиях. Наблюдаемый эффект, видимо, обусловлен как большей полиморфностью ферментных систем эвритермных рыб, так и большей эффективностью работы мономорфной ферментной системы при осцилляции температуры. Осцилляция температур при наличии полиморфности ферментнысистем увеличивает суммарный эффект работы ферментов, поскольку каждый изофермент при осцилляции температуры проходит через свой температурный оптимум.
Температура влияет как на рост рыб и обменные процессы в организме, так и на их морфологические параметры. Например, с понижением температуры в период эмбрионального и личиночного развития увеличивается количество меристических признаков, в частности, число позвонков, миомеров. Эти закономерности надо учитывать при заводском воспроизводстве рыб.
Помимо температуры, важным фактором, влияющим на эмбриогенез рыб, не только морских, но и пресноводных является солёность воды. Так, изучение влияния солёности воды на эмбриональное развитие пресноводных рыб и проходных лососевых показало, что устойчивость развивающейся икры к повышению солёности закономерно меняется в онтогенезе. Установленные пределы солёности воды для выживаемости на отдельных этапах эмбриогенеза икры сёмги, микижи и радужной форели, например, показали, что нормальное развитие икры этих видов на всех этапах эмбриогенеза возможно в воде солёностью 5-6%. При этом снижается вероятность поражения икры сапролегнией и увеличивается процент выхода предличинок. Эти данные легли в основу практических рекомендаций по инкубации икры лососевых рыб в солоноватой воде.
Важнейшими составными частями среды обитания рыб являются газы (количественное содержание и качественный состав), наибольшее значение из них имеет кислород. Наличие высоких концентраций диоксида углерода, сероводорода, аммиака и других отрицательно сказывается на эмбриогенезе. Так, избыток диоксида углерода угнетает жизнедеятельность рыб, но в ещё большей мере его негативное влияние на них проявляется из-за изменения при этом рН среды. Аммиак, а тем более сероводород, являющиеся продуктами метаболизма рыб и особенно гнилостных процессов, интенсифицирующихся в среде при недоиспользовании кормов, непосредственно влияют на метаболизм рыб — сдерживают темп роста, а иногда приводят к гибели всего населения водоёма.
Наличие кислорода в воде является обязательным для любых рыб на всех этапах развития. Однако кислородные потребности у разных видов значительно различаются. Так, реофильные рыбы и обитатели пелагиали морских вод, особенно с высокой двигательной активностью (форель, хариус, кефали), наиболее чувствительны к недостатку кислорода. Лимнофильные рыбы, и в частности донные обитатели, а также малоподвижные рыбы, имеющие дополнительные органы потребления кислорода (африканский сом Clarias gariepinus, караси Carassius spp.), нетребовательны к дефициту кислорода.
Не только недостаток, но и избыток кислорода вреден для рыб. Перенасыщение воды кислородом приводит к уменьшению темпа роста рыб и увеличению перекисного окисления жиров в их теле, что снижает защитные реакции и увеличивает предрасположенность рыб к заболеваниям. В эмбриональном периоде развития перенасыщение воды кислородом обуславливает недоразвитие эмбриональной кровеносной системы, отсутствие эритроцитов, не заполнение плавательного пузыря воздухом у некоторых видов рыб.
Изучение влияния концентрации кислорода в воде на эмбриогенез рыб показало, что наиболее ранним внешним проявлением её действия является изменение скорости развития и роста в ряду концентраций от нижней летальной до величин, значительно превышающих его естественное содержание, то есть заведомо больших, чем критические концентрации кислорода. Так, у эмбрионов щуки скорость развития возрастает с увеличением содержания кислорода в воде при инкубации икры, причём во всём возможном для их развития диапазоне его концентраций — от нижней (2,3 мг/л) до верхней (40-41 мг/л) летальной границы.
В позднем эмбриогенезе избыток кислорода задерживает процессы, связанные с вылуплением предличинок из оболочки. В случаях предельных концентраций происходит полная резорбция желтка эмбриона, так и не вылупившегося из оболочки. Если инкубацию икры осуществляют при интенсивном барботаже воды воздухом или кислородом, то время вылупления личинок рассчитывают по градусодням с прекращением барботажа к моменту расчётного вылупления. Это способствует их вылуплению, как и любой другой способ уменьшения содержания кислорода в среде перед вылуплением предличинок. Примером может быть использование инкубационных аппаратов, позволяющих инкубировать значительное количество икры фитофильных карповых рыб, а также осетровых в одном аппарате, где икра поддерживается во взвешенном или периодически взвешенном состоянии, а вылупление происходит после полного прекращения подачи воды в аппарат на 5-15 минут. Этот способ позволяет существенно экономить воду, а также использовать биологически активные вещества в процессе инкубации икры.
Не последнюю роль после инкубации икры играет сама доступность воздуха для личинок при заполнении плавательного пузыря. Так, одной из обычных причин не заполнения плавательного пузыря карповых рыб является наличие бактериальной плёнки на поверхности воды: личинка захватывает пузырёк воздуха в ротовую полость и глотку, но не способна протолкнуть его через ductus pneumaticus в плавательный пузырь, что приводит к массовой гибели личинок.
Особую опасность для рыб представляет атомарный кислород, поступающий в водную среду в виде озона и наиболее часто появляющийся в замкнутых системах, где для бактерицидной обработки воды или используют ультрафиолетовое излучение, или озонируют саму воду. Озон вызывает гибель объектов разведения, провоцируя свободно-радикальное перекисное окисление липидов, хотя его применение основано на бактерицидном свойстве ультрафиолетового излучения. Для удаления озона применяют фильтры с активированным углём, переводящим озон в молекулярный кислород. В любом случае необходимо контролировать содержание кислорода в воде — оно должно соответствовать нормам для каждого объекта выращивания.
Другой причиной не заполнения плавательного пузыря является использование для выдерживания предличинок фитофильных рыб. в частности карпа (с момента вылупления предличинок до перехода их на плав), аппаратов, где вода подаётся снизу через щели на специальное устройство, обеспечивающее вращение воды в аппарате. При этом из-за вращения воды стремящиеся к поверхности личинки проходят столь длинный путь, двигаясь по спирали, что оказываются не в состоянии достичь поверхности. Они расходуют столько энергии. что к моменту перехода на плав полностью резорбируют запасы желточного мешка и ложатся на дно с незаполненным плавательным пузырём. Во избежание этого следует применять любую конструкцию для выдерживания, позволяющую личинке отдыхать (используя железы прикрепления) и затрачивать минимум энергии.
При отсутствии кислорода в воде эмбрион погибает от удушья. Пониженное содержание кислорода в воде замедляет развитие эмбриона. Если же недостаточность кислорода проявляется при повышенной температуре (по сравнению с оптимумом), то развитие эмбриона идёт ненормально, что приводит к уродству, а в дальнейшем к гибели. Подобное явление наблюдается и при высоких концентрациях диоксида углерода (СО2), которые могут быть при инкубации большого количества икры при ограниченном расходе воды. В этом случае диоксид углерода сдвигает водородный показатель в кислую сторону и нарушает газовый обмен в клетках эмбриона.
Отношение эмбрионов к температуре, газовому режиму солёности, свету, механическим воздействиям на отдельных стадиях этапов развития различно. Одни стадии более чувствительны к резким изменениям абиотических условий среды, что приводит к увеличению количества уродливых эмбрионов и их гибели, другие — менее чувствительны. Повышенная чувствительность к резким изменениям среды проявляется на стадиях первых этапов (оплодотворение — гаструляция) и на этапе перед вылуплением.
Следовательно, инкубацию икры можно проводить только в таких условиях, при которых факторы внешней среды обеспечивают нормальное течение эмбриогенеза.
Вылупившаяся предличинка, первое время ведёт пассивный образ жизни. Она питается за счёт питательных веществ, содержащихся в желточном мешке. Желточный мешок является также провизорным органом дыхания предличинки. По мере роста предличинки желточный мешок постепенно уменьшается. Незадолго до окончательной его резорбции заканчивается предличиночный и начинается личиночный период развития. Предличинка становится личинкой, которая переходит на смешанное питание. На этом этапе развития личинка использует питательные вещества, содержащиеся в желточном мешке, и потребляет корм из внешней среды.
Желточный мешок у личинки вскоре полностью резорбируется и она окончательно переходит на внешнее питание. Продолжительность личиночного периода развития, как и эмбрионального, у разных видов рыб неодинакова (от нескольких суток у весеннее нерестующих рыб, до месяца — у осенне-нерестующих). У каждого вида она увеличивается при низких и уменьшается при высоких температурах, а также зависит от других факторов внешней среды.
Личинка растёт, развивается и через некоторое время превращается в малька, который по внешнему виду ничем не отличается от взрослой рыбы.
Эмбриональный период развития осетровых (по А.С. Гинзбург, Т.А. Детлаф, О.И. Шмальгаузен, 1981). В эмбриональном развитии осетровых рыб выделяют пять последовательных этапов, включающих 35 стадий (табл. 2).
1-й этап — оплодотворение (1-3-я стадии) (рис. 30-31) Следствием осеменения является набухание оболочек, совпадающее со значительным увеличением прочности. Через несколько минут наблюдается поворот яйца: вегетативное полушарие переходит вниз, а анимальное вверх. Затем между анимальной областью и оболочками создаётся перивителлиниовое пространство.
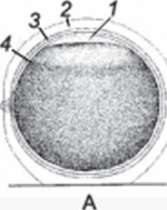
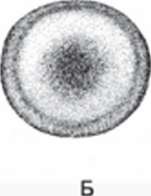
Рис. 30. Стадия 2 — яйцо осетра после поворота и выделения
Дата добавления: 2021-09-07; просмотров: 539;











