Классификация и строение молекул алкадиенов.
Возможны три разных способа взаиморасположения двойных связей в диеновом углеводороде относительно друг друга:
1) Двойные связи расположены вплотную одна к другой:
СН2=С=СН−СН2−СН3
Такие углеводороды называются кумуленовыми. Рассмотрение химических свойств кумуленовых углеводородов выходит за рамки данного курса. Единственно, что отметим, что атом углерода при двух двойных связях находится в sp-гибридизации.
CH2 = C = CH2 − пропадиен (аллен).
2) Двойные связи разделены более чем одной одинарной связью:
СН2=СН−СН2−СН=СН2
Такие алкадиены носят название изолированных. Их химические свойства ничем не отличаются от свойств обычных алкенов (разумеется, с учетом того, что в реакцию могут вступать две никак не зависящие друг от друга двойные связи).
3) Если двойные связи разделены в цепи только одной s-связью, то их называют сопряженными. В этом случае в молекуле двойные и одинарные связи чередуются, как, например, в бутадиене-1,3 СН2=СН−СН=СН2, который является простейшим сопряженным алкадиеном.
Соединения с чередующимся расположением двойных связей отличаются по свойствам как от алкенов, так и от других типов алкадиенов. Особенности химического поведения этих соединений объясняются наличием сопряжения.
Сопряжение − образование единого электронного облака в результате взаимодействия негибридизованных р-орбиталей в молекуле с чередующимися двойными и одинарными связями.
Большой интерес представляют диены с сопряженными двойными связями, так как они имеют некоторые свойства, обусловливающие их широкое применение в химической промышленности. Особые свойства таких диеновых углеводородов объясняются их электронным строением. Рассмотрим строение бутадиена. Экспериментально установлено расположение всех атомов углерода в одной плоскости, определены межатомные расстояния. Оказалось, что длина связи между углеродными атомами (в нм) такова:
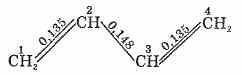
Крайние связи (C1−С2 и С3−С4) имеют несколько большую длину, чем двойная связь в этилене (0,132 нм), центральная связь С2−С3 короче простой связи О−С (0,154 нм). Чтобы объяснить это, обратимся к электронному строению бутадиена.
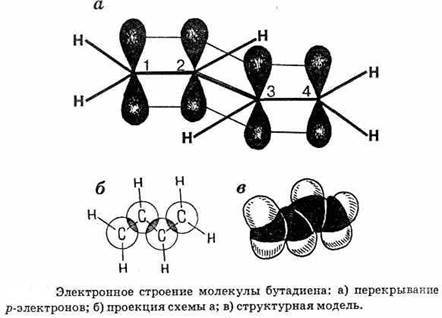
У каждого атома углерода имеются три гибридные sp2-орбитали, которые при перекрывании образуют s-связи. Негибридиованные р-электронные орбитали (их четыре), образующие p-связи, перекрываются не только между первым и вторым, третьим и четвертым атомами углерода, но также между вторым и третьим. Хотя 2,3-перекрывание меньше 1,2- и 3,4-перекрывания, все же оно вызывает уменьшение длины центральной связи С2−С3.
При перекрывании р-орбиталей в бутадиене получаются не отдельные, обособленные p-связи, а единое, общее p-электронное облако. В этом случае говорят о сопряжении двойных связей, приводящем к некоторому выравниванию связей. Сопряжение связей часто изображают пунктиром:
1 2 3 4
CH2 = = =CH = = = CH = = = CH2
 |
0,136нм 0,146 нм 0,136 нм
Основная особенность сопряженной системы заключается в том, что она реагирует как единое целое и определяет реакционную способность алкадиенов.
Дата добавления: 2017-03-12; просмотров: 3627;










