Ое начало термодинамики
Итак, мы отметили, что существует теплообмен, как способ изменения внутренней энергии. Это означает, что если две изолированные системы, находящиеся в равновесии привести в контакт, то равновесие нарушается, и согласно исходному основному постулату (поскольку вместе они изолированы) эта объединенная система должна прийти в результате теплообмена в новое состояние равновесия. Следовательно, состояние термодинамического равновесия определяется не только ее внешними параметрами xi, но и еще одной величиной (назовем ее τ), характеризующая ее внутреннее состояние, причем для различных равновесных систем, находящихся в тепловом контакте значение τ становится одинаковым. Более того, оно остается таковым и после устранения контакта
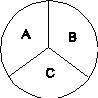 Еще отметим свойство транзитивности этого состояния равновесия: если есть три равновесных системы A,B и C, и если системы А и В порознь находится в равновесии с системой С, то А и В также находятся в равновесии между собой. Величина τ у всех систем будет одинаковая: τА = τВ = τС.
Еще отметим свойство транзитивности этого состояния равновесия: если есть три равновесных системы A,B и C, и если системы А и В порознь находится в равновесии с системой С, то А и В также находятся в равновесии между собой. Величина τ у всех систем будет одинаковая: τА = τВ = τС.
Величина, выражающая внутреннее состояние равновесной системы, имеющая одно и тоже значение для всех частей сложной равновесной системы и определяемая внешними параметрами и энергией системы называется тепературой.
Так вот, существование температуры τ = Ф(X, U) и является вторым основным постулатом ТД или 0-м началом ТД.
Ранее говорили о внутренних и внешних параметрах, причем внутренние параметры зависят от внутреннего движения молекул системы и внешних параметров. Теперь установим, что состояние равновесия определяется внешними параметрами и температурой. Следовательно остальные внутренние параметры не являются независимыми, они являются функциями внешних параметров и температуры.
Другая формулировка 0-го начала: все внутренние параметры равновесной системы являются внешних параметров и температуры.
Поскольку τ = Ф(x, U), то U = Ф-1(x,τ) – т.о. в этом определении можно заменить τ на U.
Все внутренние параметры – функции внешних и энергии системы.
Отметим, что мы ввели τ из качественных рассуждений, не пользовались математикой. Можно, однако, строго математически доказать, что из аддитивности энергии транзитивности равновесия следует существование τ.
Отметим, что пока τ(xi,U) – неоднозначная функция , можно взять τ = Ω(ε). Чтобы конкретизировать понятие положим, что τ растет с U, так удобнее.
Еще один опытный факт: при равновесии системы возьмем одно совершенно определенное распределение энергии по ее частям. При увеличении общей энергии системы (при неизменных внешних параметрах) растут и энергии ее частей.
Отсюда следует τ = Ф(U, xi) должна быть монотонной функцией U. Будем брать только возрастающие.
Температурные шкалы
Наиболее удобно по идеальному газу pV = RT (опытный факт!) Но нужно выбрать реперные точки.
Цельсий:
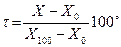 , где для идеального газа X = PV. Из опыта:
, где для идеального газа X = PV. Из опыта:
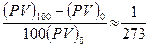 , и тогда по Цельсию
, и тогда по Цельсию 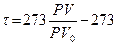 . Абсолютная температура (по идеальному газу)
. Абсолютная температура (по идеальному газу) 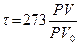
Теплоемкость
Перепишем (I)
đQ* = dU + đA = dU + pdV + 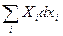 (1)
(1)
где 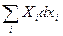 – работа остальных обобщенных сил. U = U(T, xi). Определим теплоемкость
– работа остальных обобщенных сил. U = U(T, xi). Определим теплоемкость
С = đQ*/dT (2)
– количество тепла необходимое для изменения температуры на одну единицу (например, градус). T – зависит от способа, которым передается тепло. С – функция процесса, а не состояния!
Продолжим:
đQ* = 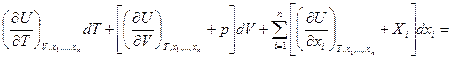
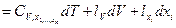
Здесь 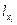 - скрытые теплоты расширения. Скрытой теплотой изменения какого-либо внешнего параметра называется количество теплоты, необходимое для увеличения этого параметра на единицу при постоянных температуре и других внешних параметрах.
- скрытые теплоты расширения. Скрытой теплотой изменения какого-либо внешнего параметра называется количество теплоты, необходимое для увеличения этого параметра на единицу при постоянных температуре и других внешних параметрах.
В простейшем случае все xi = const вычислим
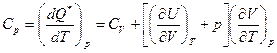
Поскольку T монотонно растет с U,
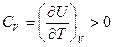
Идеальный газ PV = RT; 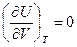 . Внутренняя энергия не зависит от объема. Физически – т.к. нет взаимодействия между молекулами и не важны расстояния между ними.
. Внутренняя энергия не зависит от объема. Физически – т.к. нет взаимодействия между молекулами и не важны расстояния между ними.
Cp = CV + R – соотношение Майера.
Дата добавления: 2021-05-28; просмотров: 116;










