Ускоренная коммутация.
Если при установке добавочных полюсов были какие-либо технологические неточности и созданная ими ЭДС получилась больше реактивной, то ток получаемый от разницы этих ЭДС направлен так, что искрить начинает набегающий край щетки.
Химические источники тока.
Это устройства, преобразующие химическую энергию в электрическую. К ним относятся:
1) Гальванические элементы (не способны заряжаться от внешнего электрического поля).
2) Аккумуляторы (заряжаются от внешнего поля).
Емкость – это способность химического элемента отдавать электроэнергию, то есть это количество запасенного электричества.
Номинальная емкость – это произведение номинального (расчетного) тока при подключении нагрузки на время в течении которого источник разрядится до минимально допустимой ЭДС.
Саморазряд – это самопроизвольное уменьшение емкости с течением времени. Внутри источника из-за малого сопротивления электролита протекает ток, который и дает уменьшение емкости.
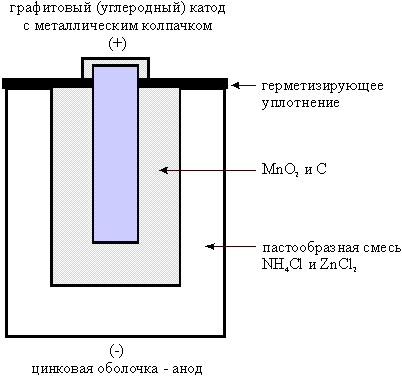 Гальванические элементы.
Гальванические элементы.
Это химические источники тока, которые отдают электроэнергию и не накапливают ее под действием внешнего поля, из-за необратимости реакции при разряде, то есть образовании нерастворимых в электролите солей.
Наиболее распространенный марганцево-цинковый элемент. Анодом сухого элемента служит цинковый электрод, катодом - графитовый стержень, окруженный слоем оксида марганца и углерода. В качестве электролита используется паста из хлорида цинка, хлорида аммония.
Аккумуляторы.
Бывают:
1. Кислотные аккумуляторы.
Положительный электрод оксид свинца PbO2, отрицательный губчатый (для увеличения соприкосновения активной массы с электролитом) свинец Pb.
Электролит 25 – 34% раствор серной кислоты H2SO4.
При растворении кислоты в воде, вода разбивает молекулу кислоты на ионы H2 + и SO4-.
Отрицательный ион кислотного остатка ищет пару для нейтрализации и, вступая в реакцию со свинцом, забирает у губчатого свинца положительные ионы. Таким образом, свинцовая пластина зарядится отрицательно.
Положительный ион водорода забирает электроны у оксида свинца, и эта пластина заряжается положительно.
На пластинах возникает разность потенциалов.
При разряде электроны с отрицательной пластины переходят по нагрузке на положительную пластину, создавая ток. Электрическое равновесие, достигнутое химической реакцией нарушается, и реакция теоретически продолжается до тех пор, пока не истощатся активные массы, либо не закончатся ионы в растворе электролита. Практически, разряд прекращают намного раньше, иначе произойдет сульфатация. При сульфатации мелкие кристаллы сернокислого свинца превращаются в более крупные кристаллы, неразмываемые электролитом при заряде и аккумулятор теряет емкость.
Сульфатация происходит при неправильной эксплуатации свинцового аккумулятора:
· Разряде ниже 1,7 – 1,8 В.
· Хранении в полуразряженном , или полностью разряженном состоянии.
· Хроническом недозаряде.
· Пониженном уровне электролита.
· Большой плотности электролита.
При разряде в результате химической реакции образуется вода, поэтому плотность электролита падает.
При заряде от постороннего источника, мелкокристаллическая соль растворяется в электролите, активные массы восстанавливаются. Полностью заряженный аккумулятор кипит. Напряжение его около 2,8 В.
Ток саморазряда у него около 20% в месяц, поэтому необходима периодическая подзарядка.
2. Щелочные аккумуляторы.
· Никель-железные.
Активная масса положительного электрода: гидрат окиси никеля NiOОH с добавлением графита (для лучшей электропроводности) и окиси бария (для продления срока службы).
Активная масса отрицательного электрода: порошковое железо и его окислы.
Электролит: 20% раствор едкого калия КОН с примесью моногидрата лития.
· Никель-кадмиевые.
Активная масса положительного электрода: гидрат окиси никеля NiOОH с добавлением графита (для лучшей электропроводности) и окиси бария (для продления срока службы).
Активная масса отрицательного электрода: порошковый кадмий.
Электролит: 20% раствор едкого калия КОН с примесью моногидрата лития.
Заряд щелочных аккумуляторов ведут до тех пор, пока не будет сообщена вся номинальная емкость (по паспорту).
Зарядный ток: заряжают током, равным четверти от номинальной емкости.
При бурном газовыделении уменьшают зарядный ток, продолжая заряжать. Их лучше перезарядить, чем недозарядить.
При работе плотность электролита не меняется.
Емкость аккумуляторов зависит от:
1) Площади соприкосновения пластин с электролитом, то есть от уровня электролита.
2) Режима разряда. Чем выше разрядный ток, тем меньше емкость.
3) От температуры окружающей среды. Эксплуатация от -40 до +45°С.
При повышении температуры улучшается ионный обмен, емкость растет, но при сильном увеличении температуры резко уменьшается сопротивление электролита, ток саморазряда растет, емкость падает.
4) От плотности электролита. Летом необходимо снижать плотность.
Достоинства и недостатки щелочных аккумуляторов по сравнению с кислотными.
Достоинства:
1) Долгое время могут находиться в полуразряженном и даже полностью разряженном состоянии.
2) Не выходят из строя при действии низких температур.
3) Выдерживают большие токи разряда и заряда из-за большого внутреннего сопротивления.
4) Из-за этого же выдерживают небольшие внутренние к.з.
5) Большая механическая прочность.
6) Больший срок службы и хранения.
7) Саморазряд меньше, чем у кислотных. За 9 месяцев у щелочных такой же, как за месяц у кислотных.
8) Нет вредных выделений паров.
Недостатки:
1) Напряжение при разряде на 40% ниже, чем у кислотных, значит нужно большее количество аккумуляторов для при одинаковом напряжении.
2) Напряжение при разряде быстро падает из-за большого внутреннего сопротивления.
Дата добавления: 2016-12-16; просмотров: 2013;











