Комплексообразователь
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + nL =[MLn]
где M – нейтральный атом, положительно или отрицательно заряженный условный ион, объединяющий (координирующий) вокруг себя другие атомы, ионы или молекулы L. Атом M получил название комплексообразователя или центрального атома.
В комплексных ионах [Cu(NH3)4]2+, [SiF6]2- , [Fe(CN)6]4-,[BF4]- комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III).
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления.
Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония [NH4]+ и т.п.
Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO)4] и [Fe(CO)5], содержат атомы никеля(0) и железа(0).
Комплексообразователь (выделен желтым цветом) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например:
Ag+ + 2NH3 = [Ag(NH3)2]+;
Ag+ + 2CN- = [Ag(CN)2]-
так и находясь в составе молекулы:
SiF4 + 2F- =[SiF6]2-;
I2 + I- = [I(I)2]-;
PH3 + H+ =[PH4]+;
BF3 + NH3 =[B(NH3)F3]
В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах.
Комплексное соединение может включать несколько комплексных ионов, в каждом из которых содержится свой комплексообразователь.
Например, в одноядерном комплексном соединении состава [Cu(NH3)4][PtCl6]комплексообразователи – Cu(II) и Pt(IV).
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число (КЧ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя.
Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др.), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными координационными числами являются 4 и 6.
Между значениями координационного числа и степенью окисления элемента-комплексообразователя существует определенная зависимость. Так, для элементов-комплексообразователей, имеющих степень окисления +I [Ag(I), Cu(I), Au(I), (II) и др.] наиболее характерно координационное число 2 – например, в комплексах типа [Ag+1(NH3)2]+, [Cu+1(CN)2]-, [IBr2]-.
Элементы-комплексообразователи со степенью окисления +II [Zn(II), Pt(II), Pd(II), Cu(II) и др.) часто образуют комплексы, в которых проявляют координационное число 4, такие как [Zn+2(NH3)4]2+, [Pt+2Cl4]2-, [Pd+2(NH3)2Cl2]0, [ZnI4]2-, [Cu(NH3)4]2+.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6: [Fe(H2O)6]2+, [Mg(H2O)6]2+, [Ni(H2O)6]2+.
Элементы-комплексообразователи, обладающие степенью окисления +III и +IV [Pt(IV), Al(III), Co(III), Cr(III), Fe(III)], имеют в комплексах, как правило, КЧ 6.
Например, [Co+3(NH3)6]3+, [Cr+3(OH)6]3-, [Pt+4Cl6]2- , [AlF6]3-, [Fe(CN)6]3-.
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах [Al(OH)4]- и [Al(H2O)2(OH)4]-.
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9[Bi(NCS)12].
Лиганды
В комплексном ионе или нейтральном комплексе вокруг комплексообразователя координируются ионы, атомы или простые молекулы (L). Все эти частицы, имеющие химические связи с комплексообразователем, называются лигандами (от латинского "ligare" - связывать). В комплексных ионах [SnCl6]2- и [Fe(CN)6]4- лигандами являются ионы Cl- и CN-, а в нейтральном комплексе [Cr(NH3)3(NCS)3] лиганды – молекулы NH3 и ионы NCS-.
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. Лигандами могут быть различные неорганические и органические ионы и молекулы. Важнейшими лигандами являются ионы CN-1, F-1 , Cl-1, Br-1, I-1, NO2-1, OH-1, SO3,S2-, C2O42-, CO32-, молекулы H2O, NH3, CO, карбамида (NH2)2CO, органических соединений – этилендиамина NH2CH2CH2NH2, α-аминоуксусной кислоты NH2CH2COOH и этилендиаминтетрауксусной кислоты (ЭДТА) и другие.
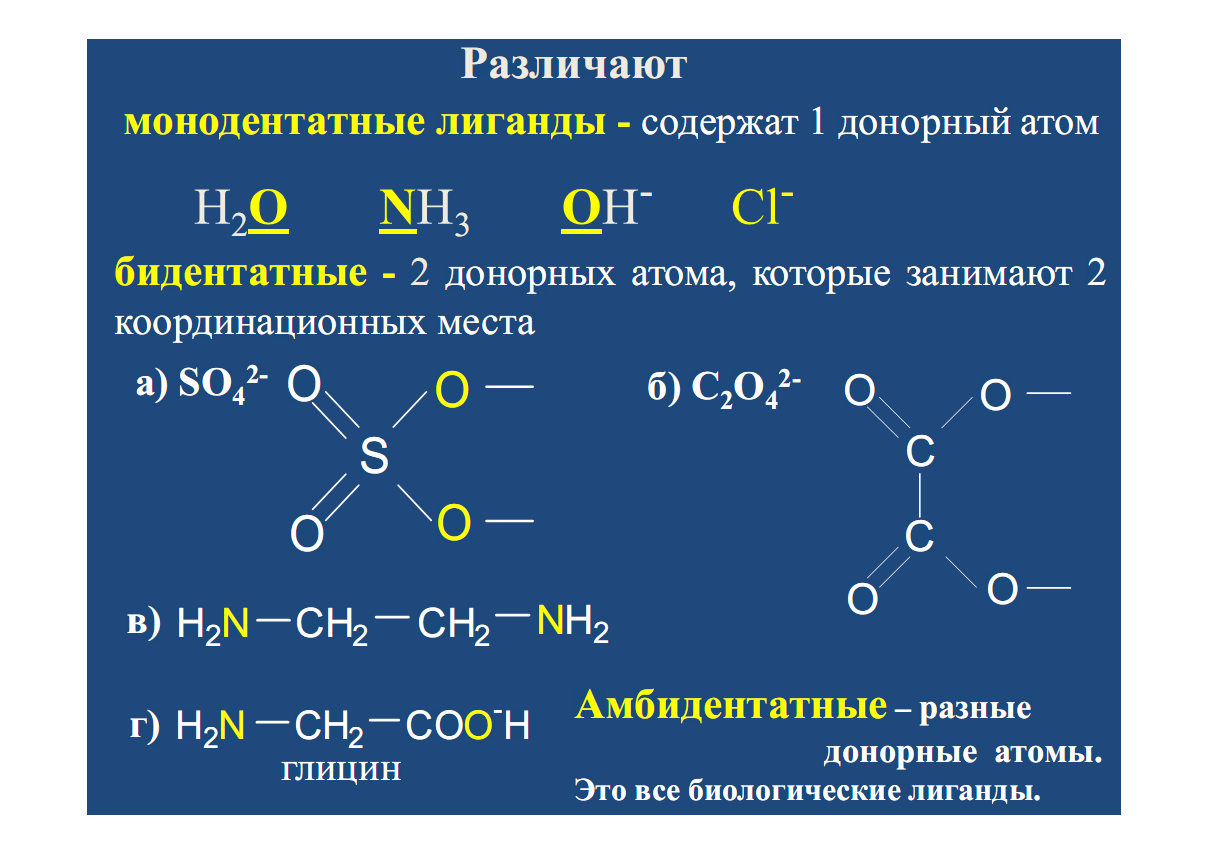
Чаще всего лиганд бывает связан с комплексообразователем через один из своих атомов одной двухцентровой химической связью. Такого рода лиганды получили название монодентатных. К числу монодентатных лигандов относятся все галогенид-ионы, цианид-ион, аммиак, вода и другие.
Некоторые распространенные лиганды типа молекул воды H2O, гидроксид-иона OH-, тиоцианат-иона NCS-, амид-иона NH2-, монооксида углерода CO в комплексах преимущественно монодентатны, хотя в отдельных случаях (в мостиковых структурах) становятся бидентатными.
Существует целый ряд лигандов, которые в комплексах являются практически всегда бидентатными. Это этилендиамин, карбонат-ион, оксалат-ион и т.п. Каждая молекула или ион бидентатного лиганда образует с комплексообразователем две химические связи в соответствии с особенностями своего строения.
Например, в комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- - образует две связи с комплексообразователем – условным ионом Co(III), а каждая молекула лиганда NH3 – только одну связь. [Cu(CO3)2]-2
Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
Дентатность лиганда – число координационных мест комплексообразователя, которое лиганд занимает в комплексе.
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа.
4.4 Внутренняя и внешняя сфера комплексного соединения
Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса.
Так, в комплексном катионе [Cu(NH3)4]2+ внутренняя сфера образована атомом комплексообразователя – меди(II) и молекулами аммиака, непосредственно с ним связанными.
Обозначается внутренняя сфера квадратными скобками: [Fe(CN)6]3-, [HgI4]2-, [SnCl6]2-.
В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например, [Al(H2O)6]3+, либо отрицательный, например, [Ag(S2O3)2]3-, или нулевой заряд, например, как для [Cr(NH3)3(NCS)3]0.
Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения.
Например, в комплексном соединении [Zn(NH3)4]Cl2 два иона Cl- находятся во внешней сфере. Внешнесферные ионы Cl- находятся на более значительном удалении от комплексообразователя, чем молекулы NH3, иначе говоря, расстояние Zn – Cl больше, чем длина химической связи Zn – N. Более того, химическая связь комплексного катиона [Zn(NH3)4]2+ и хлорид-ионов Cl- имеет ионный характер, в то время как молекулы аммиака NH3, входящие во внутреннюю сферу, образуют с комплексообразователем Zn(II) ковалентные связи по донорно-акцепторному механизму (донором неподеленных пар электронов являются атомы азота в NH3). Таким образом, различие между лигандами внутренней сферы и ионами внешней сферы очень существенно.
Изображая формулу комплексного соединения, внешнесферные ионы располагают за квадратными скобками.
Например, в соединениях [Cu(NH3)4](OH)2 и K2[HgI4] внешнесферными ионами являются соответственно ионы OH- и K+. Вполне понятно, что в нейтральных комплексах [Cr(NH3)3(NCS)3]0 и [Pd(NH3)2Cl2]0 внешняя сфера отсутствует.
Обычно внешнюю сферу составляют простые одноатомные или многоатомные ионы. Однако возможны случаи, когда комплексное соединение состоит из двух и более внутренних сфер, выполняющих функции катионной и анионной части соединения. Здесь каждая из внутренних сфер является внешней по отношению к другой.
Например, в соединениях [Co(NH3)6][Cr(CN)6], [Cu(NH3)4][PtCl6] и [Ni(NH3)6]2[Fe(CN)6] формально функции внешнесферных ионов могут выполнять:
комплексные катионы [Cu(NH3)4]2+ и [Ni(NH3)6]2+,
комплексные анионы [PtCl6]2- и [Fe(CN)6]4-.
При растворении в воде комплексные соединения необратимо диссоциируют на ионы:
[Cu(NH3)4](OH)2 = [Cu(NH3)4]2+ + 2OH-
[Ni(NH3)6]2[Fe(CN)6] = 2[Ni(NH3)6]2+ + [Fe(CN)6]4-
Кислоты с комплексными анионами в водном растворе подвергаются необратимому протолизу:
H2[SiF6] + 2H2O = 2H3O+ + [SiF6]2-
Такие кислоты относятся к категории сильных кислот.
Дата добавления: 2021-03-18; просмотров: 684;











