Ионотропные глутаматные рецепторы AMPA – каинатный подтип
1) AMPA подтип глутаматных рецепторов, селективным агонистом которых является AMPA. Они содержат как сайт связывающийся с конкурирующими агонистами и антагонистами (глутаматный), так и сайты взаимодействия с неконкурентными (аллостерическими) ингибиторами.
2) Каинатный подтип глутаматных рецепторов, селективным агонистом которых является каиновая кислота.
Агонисты
Молекула AMPA представляет собой аналог глутаминовой кислоты, в которой роль терминальной карбоксильной группы играет кислая гидроксиизоксазольная группа. Активность к соответствующему рецептору проявляет только S‑изомер AMPA, в то время как R‑изомер практически не активен. Замена атомов водорода метильной группы на галоген (-СF3, -CH2Cl) приводит к агонистам с активностью близкой к активности AMPA. Однако введение объемной третбутильной группировки приводит к потере агонистической активности по отношению к каинатному рецептору. Замена гидроксильной группы в изоксазоле на карбоксильную группировку приводит к пятикратному повышению активности как антагониста.
К сильным агонистам AMPA относятся и природный β‑оксозиламино‑L‑аланин.
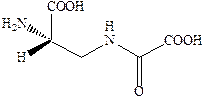
Структуры известных в настоящее время агонистов каиновых рецепторов довольно близки к самой каиновой кислоте. Интересным примером конструирования агониста AMPA каинатного рецептора является объединение в одной молекуле фрагмента AMPA и каиновой кислоты.
Производные пролина обладают слабой агонистической активностью по отношению к рецептору AMPA, но также способно к связыванию с рецептором AMDA.
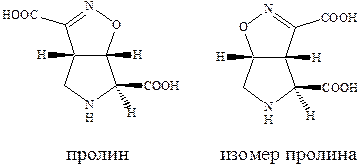
Изомер пролина является высоко аффинным и активным агонистом AMPA каинатных рецепторов, хотя, как можно было ожидать, и не слишком селективным по отношению к каждому из подтипов. Очень сильным и очень селективным лигандом каинатного рецептора является такое простое соединение как 4‑метилглутаминовая кислота, которая в 3000 раз более селективна к каинатному, чем к рецептору AMPA и в 200 раз более селективна к каинатному рецептору, чем рецептору NMDA.
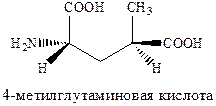
Структурные требования к выбору селективных агонистов сайта связывания глутаминовой кислоты AMPA каинатных рецепторов, отличающих их от таковых для рецепторов NMDA, не вполне ясны за исключением предпочтительности S‑конфигурации хирального аминокислотного центра.
Дата добавления: 2019-09-30; просмотров: 850;











