Аллостерическая регуляция
Аллостерические ферменты построены из двух и более субъединиц: одни субъединицы содержат каталитический центр, другие имеют аллостерический центр и являются регуляторными. Присоединение эффектора к аллостерической (регуляторной) субъединице изменяет конформацию белка и, соответственно, активность каталитической субъединицы.
Аллостерические ферменты обычно стоят в начале метаболических путей, и от их активности зависит течение многих последующих реакций. Поэтому они часто называются ключевыми ферментами.
Белок-белковое взаимодействие
Термин белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.
Ковалентная (химическая) модификация
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
Активность фермента выражается в скоростинакопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент.
В практике обычно используют:
· единицы количества вещества – моль (и его производные ммоль, мкмоль), грамм (кг, мг),
· единицы времени – минута, час, секунда,
· единицы массы или объема – грамм (кг, мг), литр (мл).
Активно используются и другие производные – катал (моль/с), международная единица активности (МЕ, Unit) соответствует мкмоль/мин.
Таким образом, активность фермента может выражаться, например, в ммоль/с×л, г/час×л, МЕ/л, кат/мл и т.д.
Кинетика ферментативных реакций. Константа Михаэлиса. Скорость ферментативных реакций. Зависимость скорости ферментативных реакций от концентрации субстрата и фермента, температуры и рН среды.
Кинетика ферментативных реакций – наука о скоростях ферментативных реакций, их зависимости от различных факторов. Скорость ферментативной реакции определяется химическим количеством прореагировавшего субстрата или образовавшегося продукта реакции в единицу времени в единице объема при определенных условиях:
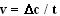 ,
,
где v – скорость ферментативной реакции, 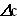 – изменение концентрации субстрата или продукта реакции, t – время.
– изменение концентрации субстрата или продукта реакции, t – время.
Уравнение Михаэлиса-Ментен показывает взаимосвязь максимально возможной скорости, реальной скорости реакции, константы Михаэлиса и концентрации субстрата.
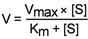 уравнение Михаэлиса-Ментена.
уравнение Михаэлиса-Ментена.
Дата добавления: 2022-04-12; просмотров: 283;











