Иммунопатологические аспекты в диагностике лимфопролиферативных заболеваний. Принципы иммунодиагностики гемобластозов.
ГЕМОБЛАСТОЗЫ.
Гемобластозы — опухолевые заболевания кроветворной и лимфатической ткани. Гемобластозы подразделяют на системные заболевания — лейкозы, а также регионарные — лимфомы.
Отличия между лейкозами и лимфомами заключаются не только в наличии или отсутствии системности поражения. Известно, что в терминальной стадии лимфомы дают обширное метастазирование, в том числе и в кост-ный мозг. Другим важным отличием лейкозов от лимфом является то, что при лейкозах опухоль первично возникает на "территории" костного мозга, а при лимфомах костный мозг поражается вторично в результате ме-тастазирования.
При лейкозах опухолевые клетки, как правило, обнаруживаются в крови, поэтому в литературе используется термин для обозначения лейкозов, предложенный еще Р.Вирховым, "лейкемия". В последние годы в литера-туре широко обсуждается вопрос о существовании предопухолевой стадии лейкозов и лимфом. Предлагаются термины "предлейкоз" и "предлимфо-ма" для обозначения состояний с различными качественными и количественными изменениями кроветворной ткани, нередко предшествующими развитию гемобластозов.
Эпидемиология. Опухоли кроветворной и лимфоидной ткани в числе пяти самых распространенных опухолей человека. Среди опухолей детей пер-вых 5 лет жизни на их долю приходится 30 % случаев.
Этиология. Как все опухоли, гемобластозы могут вызываться разнообраз-ными мутагенными факторами экзогенного и эндогенного происхождения, действующими на стволовые и полустволовые клетки-предшественницы. Большое значение в возникновении ряда гемобластозов имеет наследст-венный фактор. Роль ионизирующей радиации в возникновении гемоблас-тозов доказывается наблюдениями за пациентами, заболевшими лейкозами и лимфомами через определенное время после атомной бомбардировки Японии, аварий на АЭС, ядерных испытаний. Описаны случаи заболева-ний у людей, получавших радиотерапию, а также у врачей-радиологов. Известен цитогенетический маркер радиационного поражения — кольцевидная хромосома. Достоверно установлена связь между радиационным поражением и развитием острого и хронического миелолейкоза, острого эритромиелоза и острого лимфобластного лейкоза у детей.
Роль химических канцерогенов доказывается данными экспериментов, наблюдениями за пациентами, работавшими на вредных предприятиях с использованием бензола, а также за больными, получавшими цитостати-ческую терапию по поводу других онкологических заболеваний. Использование таких цитостатических препаратов, как мелфалан, азатио-прин, лейкеран, миелосан, антибиотика левомицетина, может приводить к возникновению острого и хронического миелолейкоза, острого миеломо-нобластного лейкоза и эритромиелоза.
Роль вирусов в качестве этиологического фактора гемобластозов трактуется неоднозначно. В развитии гемобластозов человека доказано участие лишь двух вирусов: вируса Эпштейна — Барр (африканская лимфома Беркитта) и Т-лимфоцитарного вируса лейкоза человека первого типа (Т-клеточная лимфома и Т-клеточные лейкозы). Имеются экспериментальные данные, доказывающие прямое канцерогенное действие вирусов на гемопоэтические клетки посредством вирусных онкогенов. Однако в большинстве ситуаций внедрение вирусов в клетку вызывает лишь иммортализацию (бессмертие) последней, на фоне которой возникают дополнительные перестройки генома, ведущие к злокачественной трансформации (многоступенчатый канцерогенез).
Роль наследственности в развитии гемобластозов подтверждается частым развитием лейкозов у людей с наследственными заболеваниями со спон-танными разрывами хромосом (болезни Дауна, Блума, анемия Фанкони), с нерасхождением половых хромосом (болезни Клайнфелтера, Тернера), а также существованием "лейкозных семей". Нередко лейкозы развиваются у пациентов с наследственными дефектами иммунитета (атаксия-телеан-гиэктазия, или синдром Луи-Бар, синдром Вискотта — Олдриджа, болезнь Братона).
Патогенез. Множество этиологических факторов, воздействуя на стволо-вые и полустволовые гемопоэтические клетки, приводят к одинаковым результатам — злокачественной трансформации. Следовательно, сущес-твует так называемое узкое место, через которое могут осуществлять свое воздействие различные агенты. Такое место, вероятнее всего, находится в геноме клеток, где располагаются протоонкогены и антионкогены. При этом могут происходить усиление экспрессии, амплификация, точечная мутация или другие изменения протоонкогенов, превращение их в клеточ-ные онкогены, что приводит к развитию опухоли. Хромосомные перестройки могут привести к передислокации протоонкогена в зону влияния гена-энхансера, превращению его в клеточный онкоген и усилению экспрессии. Так, при лимфоме Беркитта происходит реципрокная транслокация между хромосомами 8 и 14g32. Клеточный онкоген с-мус из хромосомы 8 перемещается на хромосому 14 и попадает в зону действия генов, регули-рующих синтез тяжелых цепочек иммуноглобулинов. Описанные измене-ния сочетаются также с точечной мутацией N-ras.
При хроническом миелолейкозе нередко встречается филадельфийская хромосома, образовавшаяся в результате реципрокной транслокации меж-ду хромосомами 9 и 22. Образуется новый ген-гибрид с-abl-bcr, белковый продукт которого обладает тирозинкиназной активностью. Онкогены обычно встраиваются в разрывы хромосом. Так, при В-лимфоцитарных лимфомах и лейкозах происходят разрывы в хромосоме 14 в локусе 32q, где локализуются гены тяжелых цепочек иммуноглобулинов. При Т-лим-фоцитарных лейкозах и лимфомах — в локусе 11q гена α-цепочек рецеп-торов Т-лимфоцитов.
Морфогенез. Развитие гемобластозов начинается с малигнизации одной стволовой или полустволовой клетки, дающей пул опухолевых клеток. Это означает, что все гемобластозы имеют моноклоновое происхождение. Моноклоновость происхождения подтверждается экспериментальными и клиническими данными по обнаружению во всех опухолевых клетках одного и того же больного клоновой метки — хромосомной или изофер-ментной. Например, во всех опухолевых клетках при хроническом миелолейкозе присутствует филадельфийская хромосома.
Стволовые клетки составляют примерно 0,01—0,001 % всей популяции костномозговых клеток. Рост и дифференцировка стволовых и полуство-ловых клеток-предшественниц управляются факторами роста и стромаль-ным микроокружением, что подтверждается экспериментами с клеточны-ми культурами, где рост и дифференцировка клеток происходят только в присутствии факторов роста или стромальных клеток. Стромальные клет-ки, вероятно, также выделяют факторы роста, связанные с их клеточными мембранами, а также гепарансульфатами стромы, обеспечивая тем самым локальный рост.
схема 52.
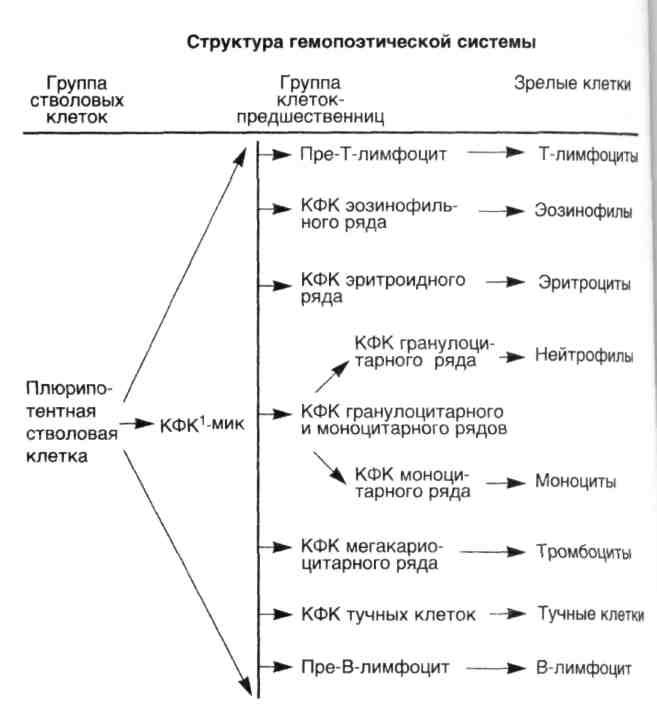
Результаты работ по изучению морфологии и клеточной кинетики гемо-бластозов, в первую очередь лейкозов, показали, что при развитии опухо-лей происходит не только малигнизация на уровне стволовых и полуство-ловых клеток-предшественниц, но также развивается блок дифференци-ровки в пуле опухолевых клеток.
ЛЕЙКОЗЫ.
При лейкозах опухолевая ткань первоначально разрастается на "террито-рии" костного мозга и постепенно замещает нормальные ростки кровет-ворения. Механизмы этого явления мало изучены. Вероятно, речь идет не о простом механическом вытеснении, а скорее о подавлении нормальных ростков клоном лейкозных клеток с участием особых факторов и контак-тного торможения. В результате этого процесса у больных лейкозами закономерно развиваются различные варианты цитопений — анемия, тром-боцитопения, лимфоцитопения, гранулоцитопения, что приводит к повы-шенной кровоточивости, кровоизлияниям, подавлению иммунитета с при-соединением инфекционных осложнений.
Метастазирование при лейкозах сопровождается появлением лейкозных инфильтратов в различных органах — печени, селезенке, лимфатических узлах и др. В органах могут развиваться изменения, обусловленные обту-рацией сосудов опухолевыми клетками — инфаркты, язвенно-некротичес-кие осложнения.
Принципы классификации лейкозов. Выделяют пять основных принципов классификации:
1. по характеру течения лейкозов;
2. по степени дифференцировки опухолевых клеток;
3. в соответствии с цитогенезом;
4. на основе иммунного фенотипа опухолевых клеток;
5. по общему числу лейкоцитов и наличию бластных клеток в периферической крови.
1. По характеру течения выделяют острые, протекающие менее года, и хронические, существующие длительное время.
2. По степени дифференцировки опухолевых клеток выделяют недиффе-ренцированные, бластные и цитарные лейкозы.
При высоком блоке дифференцировки лейкозные клетки могут напоми-нать стволовые и бластные клетки первых четырех классов клеток-пред-шественниц. Поэтому по степени дифференцировки эти лейкозы называют бластными и недифференцированными. Поскольку они протекают остро, то можно говорить, что острые лейкозы — это бластные и недифферен-цированные лейкозы. При низком блоке дифференцировки лейкозные клетки напоминают процитарные и цитарные клетки-предшественницы, лейкозы протекают менее злокачественно, хронически и называются цитарными.
3. Цитогенетические варианты лейкозов основываются на представлениях о кроветворении. Острые лейкозы по цитогенезу подразделяются на лимфобластный, миелобластный, монобластный, миеломонобластный, эритромиелобластный, мегакариобластный, недифференцированный. Хронические лейкозы представлены лейкозами миелоцитарного происхождения (хронический миелоцитарный лейкоз, хронический нейтрофильный лейкоз, хронический эозинофильный лейкоз, хронический базофильный лейкоз, миелосклероз и др.), лимфоцитарного происхожде-ния (хронический лимфолейкоз, парапротеинемические лейкозы: миело-мная болезнь, первичная макроглобулинемия Вальденстрема, болезнь тяжелых цепей Франк лина; лимфоматоз кожи — болезнь Сезари и др.), моноцитарного происхождения (хронический моноцитарный лейкоз, гистиоцитоз X).
4. Иммунный фенотип опухолевых клеток. В настоящее время стало возможным проводить более точное типирование опухолевых клеток в зависимости от их иммунного фенотипа по экспрессии СD19, СD20, СD5, легких цепочек иммуноглобулинов и других антигенных маркеров.
5. По общему числу лейкоцитов в периферической крови и наличию лей-козных клеток выделяют лейкемические (более 50—80 • 109/л лейкоцитов, в том числе бластов). Сублейкемические (50—80 • 109/л, в том числе бласты), лейкопенические (содержание лейкоцитов в периферической крови ниже нормы, то есть бласты), алейкемические (содержание лейко-цитов в периферической крови ниже нормы, бласты отсутствуют).
Морфологическое исследование имеет большое значение в диагностике лейкозов. Основными методами прижизненной морфологической диаг-ностики являются исследования мазков периферической крови и биоптатов костного мозга, которые получают при трепанации гребешка подвздошной кости или пункции грудины, а также других органов.
Острые лейкозы. Различные формы острого лейкоза имеют стереотипные морфологические проявления: лейкозная инфильтрация костного мозга в виде очаговых и диффузных инфильтратов из клеток с крупными светлы-ми ядрами, содержащими по нескольку ядрышек. Размеры и очертания ядер, а также ширина ободка цитоплазмы могут варьировать. Бласты составляют 10—20 % костномозговых клеток. Цитогенетическую принадлеж-ность бластов, как правило, можно выявить только с помощью специаль-ных методов исследования — цитохимических и иммуногистохимиче-ских. Применяются реакции на пероксидазу, окраска на липиды Суданом черным, ШИК-реакция, гистоферментохимические реакции на выявление неспецифической эстеразы, хлорацетатэстеразы, кислой фосфатазы. Иммуногистохимически возможно определение маркеров В-, Т-лимфоци-тов, клеток миелоидного и моноцитарного рядов.
В периферической крови и в костном мозге описывается феномен лейке-мического провала , развивающийся за счет наличия только бластных и дифференцированных клеток и отсутствия промежуточных форм.
В костномозговой ткани происходят вытеснение нормальных клеток гемо-поэза опухолевыми, истончение и резорбция ретикулярных волокон, не-редко развивается миелофиброз. При цитостатической терапии происходит опустошение костного мозга с гибелью бластных форм, увеличивается число жировых клеток и разрастается соединительная ткань.
Лейкозные инфильтраты в виде диффузных или очаговых скоплений обнаруживаются в лимфатических узлах, селезенке и печени. Это приводит к увеличению размеров этих органов. В печени характерно развитие жировой дистрофии. В связи с лейкозной инфильтрацией слизистых оболочек полости рта и ткани миндалин появляются некротический гингивит, тонзиллит — некротическая ангина. Иногда присоединяется вторичная инфекция и развивается сепсис, приводящий больных к смерти.
В результате тромбоцитопении, повреждения печени и стенок сосудов у больных острыми лейкозами нередко возникает геморрагический синдром вплоть до развития смертельных осложнений — кровоизлияний в головной мозг и желудочно-кишечных кровотечений.
Использование активной цитостатической терапии повлияло на течение острых лейкозов, т.е. привело к индуцированному лекарственному пато-морфозу. В связи с этим в настоящее время выделяют следующие клинические стадии заболевания:
*первая атака,
*ремиссия (полная или неполная),
*рецидив (первый, повторный).
Наибольшее значение среди острых лейкозов имеют острый лимфобластный и острый миелобластный лейкозы.
Острый лимфобластный лейкоз.

| Клетки лимфобластного лейкоза. |
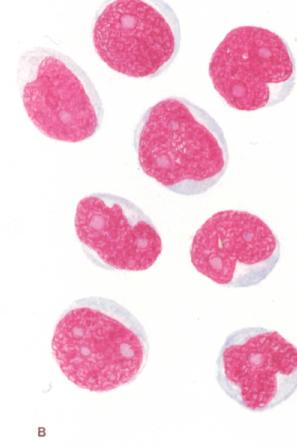
| Клетки лимфобластного лейкоза. |
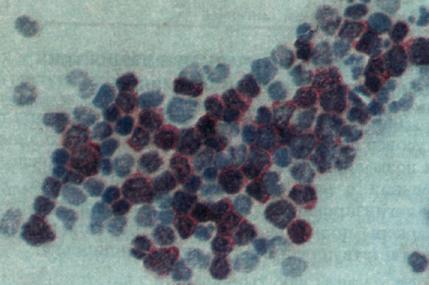
| а. Выявление лимфобластов у больного острым лимфобластным лейкозом. После центрифугирования клетки окрашивали на терминальную дезоксинуклеотидилтрансферазу (ТdТ) (вначале их обрабатывали мышиными моноклональными антителами к ТdТ, затем - антителами к мышиным Ig и после этого - иммунными комплексами мышиных антител к щелочной фосфатазе с самой фосфатазой; в заключение проводили цветную реакцию на фермент, дающую красно-фиолетовое окрашивание). Среди немеченых нормальных клеток костного мозга видны многочисленные лимфобласты. |
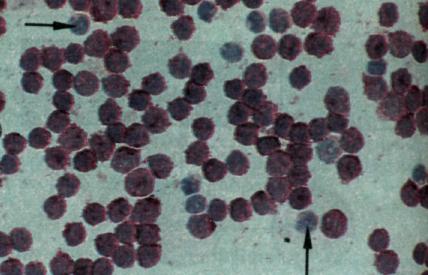
| б. Выявление общего антигена острого лимфобластного лейкоза (САLLА) в клетках костного мозга больного, страдающего этим заболеванием иммунофосфатазным методом, с помощью специфических моноклональных антител к САLLА (антитела 15). Большинство клеток интенсивно окрашены. Две неокрашенные клетки отмечены стрелками. |
Самый распространенный лейкоз в детском и юношеском возрасте. Пик заболеваемости приходится на возраст от 1 года до 6 лет. Протекает с поражением костного мозга, лимфатических узлов, селезенки, вилочковой железы, а также других органов. Централь-ная нервная система обычно вовлекается при рецидивах заболевания после химиотерапии. В костном мозге, периферической крови и в других органах обнаруживаются опухолевые клетки типа лимфобластов с ШИК-положительными гранулами в цитоплазме, не дающие реакций на пероксидазу, эстеразы и не содержащие липиды. В 2/3 случаев в опухолевых клетках обнаруживаются цитогенетические нарушения в виде полиплоидии, фила-дельфийской хромосомы и реципрокной транслокации между хромосома-ми 8 и 14. Цитогенез острого лимфобластного лейкоза связан с предшественниками Т- и В-лимфоцитов. На Т-клеточные лейкозы в странах Европы приходится 10—15 % наблюдений. Преобладают В- клеточные лейкозы. Руководствуясь иммунологическими фенотипами опухолевых клеток, выделяют несколько форм лимфобластного лейкоза, что имеет значение для выбора терапии и прогноза. Преобладающие В-лимфобла-стные лейкозы представлены ранним, промежуточным и поздним вариан-тами, отличающимися по экспрессии параглобулина СD 10, поверхнос-тного иммуноглобулина и активности терминальной диоксинуклеотид-трансферазы. Маркерами Т-лимфобластного лейкоза являются антигены С7 и Т-рецепторов. У детей преобладает промежуточный вариант, у взрослых — ранний и промежуточный. Прогноз у детей значительно луч-ше, чем у взрослых. Выживаемость составляет соответственно 60 и 30 %. Наихудший прогноз при Т-лимфобластном лейкозе.
Острый миелобластный лейкоз.
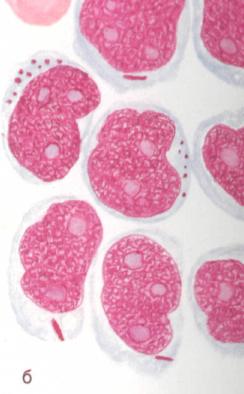 Клетки миелобластного лейкоза.
Клетки миелобластного лейкоза.
|
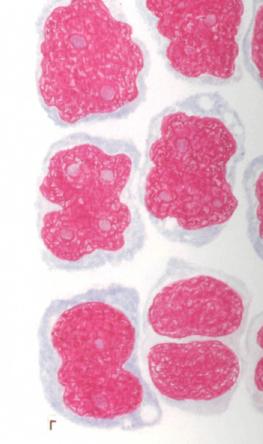 Клетки миелобластного лейкоза.
Клетки миелобластного лейкоза.
|
Наиболее частая форма заболевания у взрослых с относительно хорошим прогнозом — ремиссии наступают у 70—80 % больных, полные ремиссии — у 25 % больных.
Описываются наблюдения развития острого миелобластного лейкоза у людей, подвергшихся радиационному воздействию, контактирующих с бензолом (кожевенная индустрия в Турции, производство синтетических клеев и др.), принимавших цитостатические препараты, а также у страдающих наследственными заболеваниями — болезнью Дауна, анемией Фанкони, синдромом Блума.
Дата добавления: 2016-09-06; просмотров: 1756;











