Упругость насыщенных газов
Упругость (давление насыщенного пара) углеводородов характеризует то давление, при котором газ начинает конденсироваться и переходить в жидкое состояние. У индивидуальных углеводородов в чистом виде упругость паров (Qi) есть функция только температуры: Qi =ƒ(Т).
Величина упругости насыщенных паров углеводородов повышается с ростом температуры.Это повышение тем выше, чем ниже плотность углеводорода. Аналогично с ростом молекулярной массы углеводорода величина упругости насыщенный паров углеводородов уменьшаетсяпри равных температурах (рис. 2.11).
Анализ зависимостей, представленных ниже (рис. 2.11) свидетельствует, что давление паров метана наибольшее. При нормальных условиях метан нельзя превратить в жидкость (пунктирная линия), так как его критическая температура (Ткр) = –82,4 оС (190,75 К).
Зависимости изменения объёма жидкого и парообразного пропана от давления при конкретной температуре (рис. 2.12 а) имеют гиперболическую форму. При сжатии пропана от точки М до точки А он находится в состоянии перегретого (ненасыщенного) пара.Ненасыщенными(перегретыми) парами называются пары, которые при данной температуре и давлении образуют только однофазную паровую систему.
Ненасыщенные пары могут существоватьпри данном давлении, если их температура выше температуры насыщенных паров, или при данной температуре, если их давление меньше давления насыщенных паров.
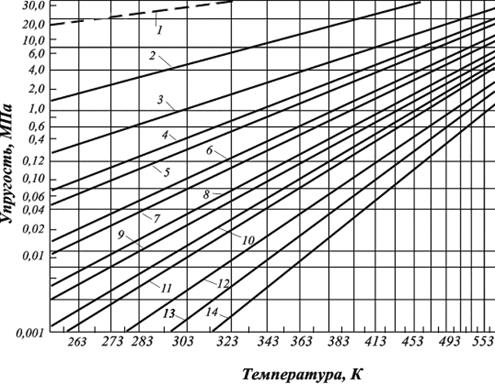
Рис. 2.11. Кривые упругости насыщенных паров чистых углеводородов:
1 – метан; 2 – этан; 3 – пропан; 4 – изобутан; 5 – бутан;
6 – изопентан; 7 – пентан; 8 – изогексан; 9 – гексан;
10 – изогептан; 11 – гептан; 12 – октан; 13 – нонан; 14 – декан
В точке А пар становится насыщенным, а при дальнейшем изменении объёма (участок АВ) он постепенно переходит в жидкость при неизменном давлении. В точке В заканчивается переход пара в жидкость. При дальнейшем сжатии пара будет резко повышаться давление при почти неизменном объёме. Горизонтальный участок АВ соответствует неизменности давления в процессе конденсации паровой фазы в жидкую фазу. Величина этого давления называется упругостью насыщенных паров природного газа при температуре опыта и обозначаетсяQ.Чем ближе значение температуры, при которой измеряется упругость насыщенного пара газового компонента к значению критической температуре, тем короче горизонтальный участок. На основе полученных данных строят кривые упругости насыщенных паров, представляющие зависимости давления от температуры испарения данной жидкости (рис. 2. 12 б).
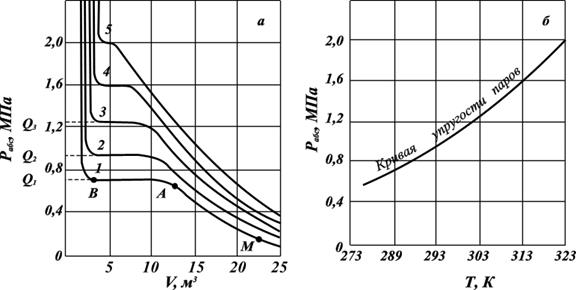
Рис. 2.12. Зависимости объёма жидкости от давления и температуры (а) и кривая упругости насыщенных паров (б) при температурах, К:
1 – 283; 2 – 293; 3 – 303; 4 – 313; 5 – 323
Насыщенным называется пар (газ), находящийся в равновесии с жидкостью. Для однокомпонентной системы условия равновесного сосуществования фаз определяются температурой и давлением. Между этими параметрами при равновесии существует взаимно однозначное соответствие: чем выше температура системы, тем выше давление, при котором находится данная равновесная система (рис. 2.13).

Рис. 2.13. Общий вид зависимости давления насыщенных паров от температуры:
АК – кривая давления насыщенных паров; I – область жидкой фазы; II – область перегретых (ненасыщенных) паров
Каждая точка кривой АК (рис. 2.13), например точка С, связывает давление насыщенных паров с температурой кипения жидкости.
Состояние вещества, при котором исчезает различие между его жидкой и газообразной фазами, называется критическим.
Критическая температура (Ткр) – максимальная температура, при которой газ и жидкость могут ещё сосуществовать в равновесии.
Выше температуры, равной критической, газ ни каким повышением давления нельзя перевести в жидкость.
Давление насыщенных паров, соответствующее критической температуре называется критическим давлением (Ркр)
У смеси углеводородов величина упругости паров является функцией температуры и общего давления смеси: Qсм = ƒ(Т, Рсм). Величина её зависит от упругости паров отдельных компонентов при данной температуре и от их мольных концентрацийQсм = ƒ(Qi, Nxi). Общее давление смеси влияет на упругость паров каждого компонента и это влияние учитывается через константу распределения (Крi, равновесия), которая представляет собой отношение упругости паров индивидуального углеводорода (Qi) к давлению смеси (Рсм):
[u4]
Крi = Qi /Рсм. (2.42)
Зависимости Крi =ƒ(Рсм) строятся в логарифмических координатах (рис. 2.14). Упругость паров смеси компонентов повышается с увеличением общего давления. При низких давлениях (≈ до 1 МПа) это влияние ничтожно и вид зависимости прямолинейный, так как упругость паров индивидуальных углеводородов (Qi) мало изменяется от давления.
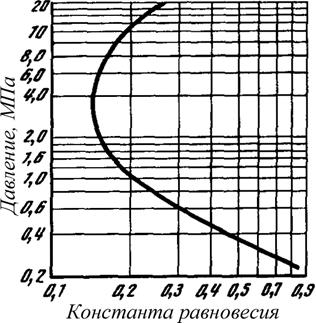
Рис. 2.14 Зависимость константы равновесия н-бутана при температуре 289 К от общего давления
При высоких давлениях (≈ 1 МПа, рис. 2.14) увеличение упругости паров (Qi) с повышением общего давления в системе становится значительным. Нарушается прямолинейная взаимосвязь этих параметров, и прямолинейный вид зависимости изменяется. Прямолинейная зависимость переходит в криволинейную. С повышением общего давления константа равновесия уменьшается медленнее, потому что сказывается увеличение упругости паров. Чем выше давление, тем быстрее растёт упругость паров с повышением общего давления. Эти закономерности выражаются более крутым изломом кривой, приближающейся в некоторой точке к вертикали (≈ 3 МПа, рис. 2.14). Эта точка соответствует такому давлению, при котором увеличение упругости паров пропорционально повышению общего давления, то есть когда числитель и знаменатель дроби в выражении (2.42) изменяются с одинаковой интенсивностью.
При очень высоких давлениях упругость паров увеличивается интенсивнее, чем общее давление. Это означает, что в области высоких давлений константа равновесия с увеличением давления возрастает, то есть жидкость становится более летучей.
Упругость паров жидкой смеси по закону Рауля зависит от упругости паров отдельных компонентов (Qi) при данной температуре и от молярных концентраций в жидкости (Nxi). Парциальное давление каждого компонента определяется как произведение его молярной концентрации в жидкости на упругость паров в чистом виде:
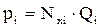 , (2.43)
, (2.43)
где рi – парциальное давление i-го компонента в газе;
Qi – упругость паров i-го компонента;
Nxi – мольрная доля i-го компонента в жидкости.
Сумма парциальных давлений всех компонентов равна общему давлению (Р) над смесью или упругости паров жидкой смеси
∑ рi = Р = ∑ Nxi ∙Qi. (2.44)
Дата добавления: 2019-02-08; просмотров: 1172;











