Хромофорні властивості іонів перехідних металів (теорія кристалічного поля, метод молекулярних орбіталей)
Розрізняють два типи процесів, що приводять до поглинання видимого світла у випадках, коли хромофорами є іони перехідних елементів: а) розщеплювання електронних рівнів центрального атома під дією поля лігандів. Це явище приводить до утворення лише слабкозабарвлених акво-іонів і деяких інших, б) перенесення електрона, найчастіше від ліганда на один з підрівнів центрального іона. Цей процес приводить до утворення інтенсивно забарвлених з'єднань, таких, як роданід, саліцилати та інші, тобто комплексів з безбарвними лігандами. На жаль, теорія процесів з перенесенням електрона ще дуже мало розроблена.
Теорія кристалічного поля прийшла на зміну теорії валентних зв'язків в 40-х роках XX сторіччя. У чистому вигляді вона зараз не застосовується, оскільки не може пояснити утворення ковалентних зв'язків в комплексних з'єднаннях і абсолютно не враховує дійсного стану лігандів (наприклад, їх дійсних розмірів) навіть у разі взаємодій, близьких до чисто електростатичних.
Вже з середини 50-х років спрощена теорія кристалічного поля була замінена вдосконаленою теорією поля лігандів, що враховує ковалентний характер хімічних зв'язків між комплексоутворювачем і лігандом.
Проте найбільш загальний підхід до пояснення утворення комплексних з'єднань дає теорія молекулярних орбіталей (МО), яка в даний час превалює над всіма останніми. Метод молекулярних орбіталей передбачає і чиста електростатична взаємодія за відсутності перекривання атомних орбіталей, і всю сукупність проміжних ступенів перекривання.
Розглянемо основні поняття теорії кристалічного поля, яка, як і теорія валентних зв'язків, все ще зберігає своє значення для якісного опису хімічних зв'язків в комплексних з'єднаннях із-за великої простоти і наочності.
У теорії кристалічного поля хімічний зв'язок комплексоутворювач – ліганд вважається за електростатичний. Відповідно до цієї теорії ліганди розташовуються навколо комплексоутворювача у вершинах правильних багатогранників (поліедрів) у вигляді точкових зарядів. Реальний об'єм ліганда теорією до уваги не береться.
Ліганди, як точкові заряди, створюють навколо комплексоутворювача електростатичне поле (“кристалічне поле”, якщо розглядати кристал комплексного з'єднання, або поле лігандів), в якому енергетичні рівні комплексоутворювача і перш за все d-підрівні розщеплюються, і їх енергія змінюється. Характер розщеплювання, енергія нових енергетичних рівнів залежить від симетрії розташування лігандів ( октаедричне, тетраедр або інше кристалічне поле ). Коли як ліганди координуються молекули H2O, NH3, CO та інші, їх розглядають як диполі, орієнтовані негативним зарядом до комплексоутворювача.
Розглянемо випадок октаедричного розташування лігандів (наприклад, [CoF6]3- або [Co(NH3)6]3+). В центрі октаедра знаходиться атом-комплексоутворювач М(+n) з електронами на d-атомных орбіталях, а в його вершинах – ліганди у вигляді точкових негативних зарядів (наприклад, іони F- або полярні молекули типу NH3). В умовному іоні М(+n), не пов'язаному з лігандами, енергії всіх п'яти d-АОоднакові (тобто атомні орбіталі вироджені).
Проте в октаедричному полі лігандів D-АО комплексоутворювача потрапляють в нерівноцінне положення. Атомні орбіталі d(z2) і d(x2- y2), витягнуті уздовж осей координат, щонайближче підходять до лігандів. Між цими орбіталями і лігандами, що знаходяться у вершинах октаедра, виникають значні сили відштовхування, що приводять до збільшення енергії орбіталей. Інакше кажучи, дані атомні орбіталі піддаються максимальній дії поля лігандів. Фізичною моделлю такої взаємодії може служити сильно стисла пружина.


Інші три d-АО – d(xy), d(xz) і d(yz), розташовані між осями координат і між лігандами, знаходяться на значнішій відстані від них. Взаємодія таких D-АО з лігандами мінімальна, а отже – енергія d(xy), d(xz) і d(yz) -АО знижується в порівнянні з початковою.


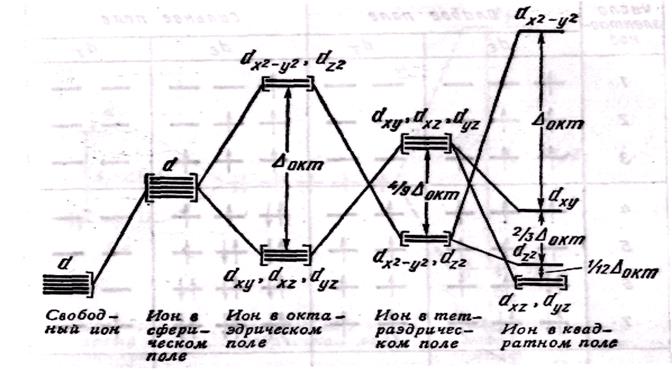
Таким чином, п'ятикратно вироджені d-АОкомплексоутворювача, потрапляючи в октаедричне поле лігандів, піддаються розщеплюванню на дві групи нових орбіталей – триразово вироджені орбіталі з нижчою енергією, d(xy), d(xz) і d(yz), і двократно вироджені орбіталі з вищою енергією, d(z2) і d(x2-y2). Ці нові групи d-орбиталейз нижчою і вищою енергією позначають deі dg:
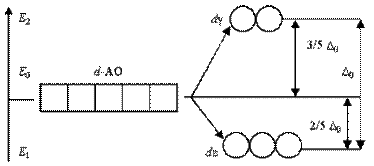
Різниця енергій двох нових підрівнів deі dgотримала назву параметра розщеплювання D0:
E2 – E1 = D0
Розташування двох нових енергетичних підрівнів deі dgпо відношенню до початкового (d-АО) на енергетичній діаграмі несиметричне:
(Е2 – Е0) > (Е0 – Е1).
Квантово-механічна теорія вимагає, щоб при повному заселенні нових енергетичних рівнів електронами загальна енергія залишилася без зміни, тобто вона повинна залишитися рівній Е0. Інакше кажучи, повинна виконуватися рівність
4(Е2 – Е0) = 6(Е0 – Е1),
де 4 і 6 – максимальне число електронів на dg-і de-АО. З цієї рівності виходить, що
(Е2 – Е0) / (Е0 – Е1) = 3/2
і
(Е2 – Е1) / (Е0 – Е1>) = 5/2, або
D0 / (Е0 – Е1) = 5/2, звідки (Е0 – Е1) = 2/5 ´ D0.
Розміщення кожного електрона з шести максимально можливих на de-орбитали викликає зменшення (виграш) енергії на 2/5 D0.
Навпаки, розміщення кожного електрона з чотирьох можливих на dg-орбитали викликає збільшення (витрату) енергії на 3/5 D0.
Якщо заселити електронами de-і dg-орбитали повністю, то ніякого виграшу енергії не буде (як не буде і додаткової витрати енергії):
4 ´ 3/5 ´ D0 - 6 ´ 2/5 ´ D0 = 0.
Але якщо початкова d-АОзаселена тільки частково і містить від 1 до 6 електронів, і ці електрони розміщуються тільки на de-АО, то ми отримаємо значний виграш енергії. Виграш енергії за рахунок переважного заселення електронами de-атомнихорбіталей називають енергією стабілізації комплексу полем лігандів.
Специфіка кожного з лігандів позначається в тому, яке поле даний ліганд створює – сильне або слабке. Чим сильніше поле лігандів, чим більше значення параметра розщеплювання D0.
Вивчення параметра розщеплювання, як правило, засноване на спектроскопічних дослідженнях. Довжини хвиль смуг поглинання комплексів l в кристалічному стані або в розчині, обумовлені переходом електронів з de-на dg-АО, пов'язані з параметром розщеплювання D0 таким чином:
n = 1 / l; D0 = Е2 – Е1 = h ´ n = h ´ (c / l) = h ´ c ´ n,
де стала Планка h дорівнює 6,626´10-34 Дж.с; швидкість світла с=3´1010 см/с. Одиниця вимірювання D0 – та ж, що у хвильового числа n: см-1, що приблизно відповідає 12 Дж/моль.
Параметр розщеплювання, окрім типу ліганда, залежить від ступеня окислення і природи комплексоутворювача. У комплексних з'єднаннях, включаючих комплексоутворювачі одного і того ж періоду і однаковою мірою окислення, з одними і тими ж лігандами, параметр розщеплювання приблизно однаковий. Із зростанням ступеня окислення комплексоутворювача значення D0 збільшується. Так, для аквакомплексів [Mn(H2O)6]2+ і [Fe(H2O)6]2+ значення параметра розщеплювання складає 7800 і 10400 см-1, а для [Mn(H2O)6]3+ і [Fe(H2O)6]3+ - 13700 і 21000 см-1 відповідно.
При збільшенні заряду ядра атома-комплексоутворювача D0 теж росте. Катіони гексаамінкобальту (III) [Co(NH3)6]3+, гексаамінродію(III) [Rh(NH3)6]3+, гексаамініридію (III) [Ir(NH3)6]3+ (Z = 27, 45 і 77) характеризуються параметрами розщеплювання, рівними 22900, 34100 і 41000 см-1.
Залежність D0 від природи лігандів різноманітніша. В результаті дослідження численних комплексних з'єднань було встановлено, що по здатності збільшувати параметр розщеплювання металів-комплексоутворювачів, що знаходяться в своїх звичайних ступенях окислення, найбільш поширені ліганди можна розташувати в наступний спектрохімічний ряд, уздовж якого значення D0 монотонно росте:
I- < Br- < Cl- » NCS- < < NO3- < F- < OH- < H2O » H- < NH3 < NO2- < CN- » NO » CO.
Таким чином, найбільш сильне електростатичне поле навколо комплексоутворювача і найсильніше розщеплювання d-АОвикликають ліганди NO2-, CN- и CO.
Послідовність розташування лігандів в спектрохімічному ряду в рамках методу молекулярних орбіталейможна пояснити таким чином. Як відомо, чим більше ступінь перекривання початкових D0, тим більше енергетична відмінність між зв'язуючими і розпушуючими орбіталями і тим більше D.. Інакше кажучи, D росте з посиленням σ-зв’язування метал — ліганд. На величину D, крім того, істотний вплив робить π-- зв’язування між центральним атомом і лігандами.
Якщо ліганди мають орбіталі (порожні або заповнені), які за умовами симетрії здібні до перекривання з d- орбіталями центрального атома, то діаграма молекулярних орбиталей комплексу істотно ускладнюється. В цьому випадку до молекулярних орбіталей σ-типа додаються молекулярні орбіталі π-типу.
Залежно від співвідношення енергетичних рівнів орбіталей центрального атома і комбінованих з ними орбіталей лігандів величина D може збільшуватися або зменшуватися. Як видно на мал., якщо в π-взаємодії беруть участь орбіталі лігандів, лежачі вище, ніж орбіталі центрального атома, то D зростає. Подібний випадок має місце при участі в перекриванні вільних d- або πразр-орбиталей лігандів. При утворенні πзв-орбиталей комплексу частина електронної щільності центрального атома переноситься до лігандів  Таку π-взаємодію називають дативною.
Таку π-взаємодію називають дативною.
Якщо ж в π-взаємодії беруть участь орбіталі лігандів, енергетично нижчі, ніж d-орбіталі, то D стає менше величини, характерної для комплексів з одними лише σ- зв’язками (мал., б). Подібний випадок характерний за участю зайнятих електронами р- або πсв-орбиталей лігандів. При утворенні πразр обиталей комплексу деяка частина електронної щільності від лігандів переноситься до центрального атома  У такому разі π-взаємодію називають донорно-акцепторною.
У такому разі π-взаємодію називають донорно-акцепторною.
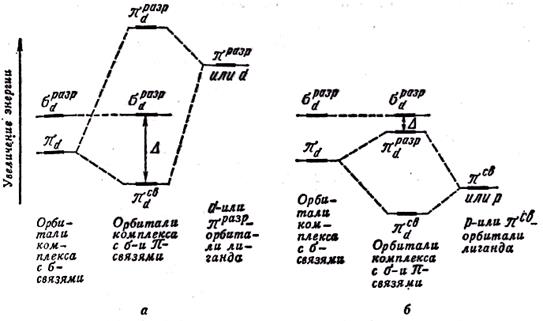
Мал. Вплив молекулярних π-орбиталей на величину D; енергія орбіталей лігандів вища (а) і нижча (б) за πd-орбиталей центрального атома
Таким чином, в комплексах між лігандами і центральним атомом окрім σ- зв’язування можливі два типи π-взаємодії:
 |
Ліганди, що є π-акцепторами, характеризуються великим Δ (викликають велике розщеплювання d-рівня); ліганди, що є π-донорами, навпаки, характеризуються малими Δ (викликають мале розщеплювання d-рівня). По характеру σ- і π-взаємодії ліганди можна підрозділити на наступні групи:
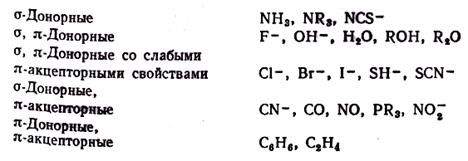
Сказане пояснює порядок розташування лігандів в спектрохімічному ряду:
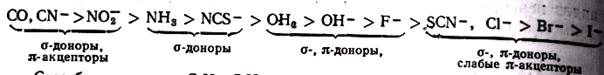
Розглянемо розподіл електронів по de- і dg-орбиталям в октаедричному полі лігандів. Заселення de- і dg-орбиталей відбувається в повній відповідності з правилом Гунда і принципом Паулі. При цьому незалежно від значення параметра розщеплювання перші три електрони займають квантові осередки de-подуровня:
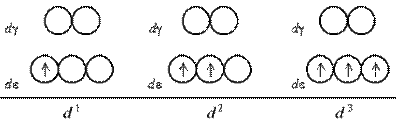
Якщо число електронів на d-подрівнікомплексоутворювача більше трьох, для розміщення їх по розщеплених підрівнях з'являється дві можливості. При низькому значенні параметра розщеплювання (слабке поле лігандів) електрони долають енергетичний бар'єр, розділяючий de- і dg-орбітали; четвертий, а потім і п'ятий електрони заселяють квантові осередки dg-підрівня. При сильному полі лігандів і високому значенні D0 заселення четвертим і п'ятим електроном dg-підрівнявиключено; відбувається заповнення de-орбиталей.
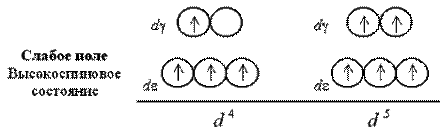
При слабкому полі лігандів заселяючі квантові осередки 4 або 5 електронів мають паралельні спини, тому отримуваний комплекс виявляється сильно парамагнитним. У сильному полі лігандів утворюються одна, а потім дві електронні пари на de-підрівні, так що парамагнетизм комплексу виявляється набагато слабкішим.
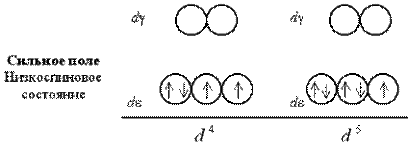
Шостий, сьомий і восьмий електрони у разі слабкого поля виявляються знову на de-підрівні, доповнюючи конфігурації до електронних пар (одній у разі d6, два – d7і три – d8):
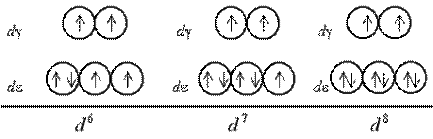
У разі сильного поля лігандів шостий електрон заселяє de-АО, приводячи до діамагнетизму комплексу, після чого сьомий і восьмий електрони поступають на dg-підрівень:
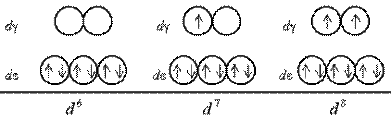
Очевидно, при восьмиелектронній конфігурації відмінності в будові між комплексами з лігандами слабкого і сильного поля зникають. Заселення орбіталей дев'ятим і десятим електроном також не розрізняється для комплексів обох типів:
Повернемося до розгляду електронної будови октаедричних комплексних іонів [Co(NH3)6]3+ і [CoF6]3-. Відповідно до розташування в спектрохімічному ряду, аміак NH3 належить до лігандів сильного поля, а фторид-іон F- – слабкого поля. Отже, заселення електронами атомних орбіталей в даних комплексах буде відбувається по схемі:
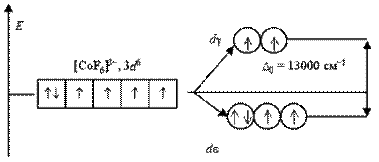
У аніоні [CoF6]3- ліганди F- створюють слабке кристалічне поле (D 0 = 13000 см-1), і всі електрони початкової 3d6-АО розміщуються на de- і dg-орбиталяхбез якого-небудь спаровування. Комплексний іон є високоспіновим і містить чотири неспарені електрони, тому він парамагнитний.
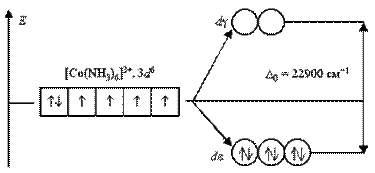
У іоні [Co(NH3)6]3+ ліганди NH3 створюють сильне кристалічне поле (D0 = 22900 см-1), всі 3d6-электроны розміщуються на більш енергетично вигіднії de-орбіталі. Перехід електронів з de- на dg-орбіталінеможливий з-за дуже високого енергетичного бар'єру. Тому даний комплексний катіон є низькоспіновим, він не містить неспарених електронів і діамагнитний.
Аналогічним чином можуть бути представлені схеми розподілу електронів по орбіталях в октаедричному полі для іонів [Fe(H2O)6]2+ і [Fe(CN)6]4-:
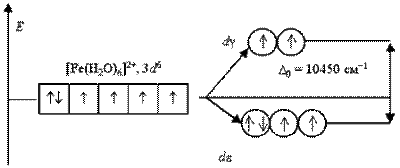
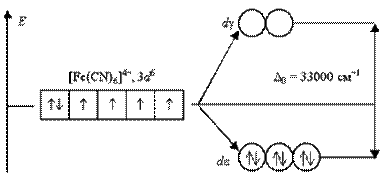
Ліганди H2O створюють слабке поле; обмін електронами між de- і dg-орбіталями не викликає ускладнень і тому число неспарених електронів в комплексному іоні таке ж, як і в умовному іоні Fe+II. Отримуваний аквакомплекс – високоспіновий, парамагнітний. Навпаки, ліганди CN- викликають значне розщеплювання d-АО, що становить 33000 см-1. Це означає, що існує сильна тенденція до розміщення всіх електронів на de-орбіталях.Виграш енергії, що отримується при такому заселенні орбіталей, багато більше енергетичних витрат, обумовлених спаровуванням електронів.
Багато комплексних з'єднань в кристалічному стані і водному розчині відрізняються яскравим забарвленням. Так, водний розчин, що містить катіони [Cu(NH3)4]2+, забарвлений в інтенсивно синій колір, катіони [Ti(H2O)6]3+ додають розчину фіолетове забарвлення, а катіони [Co(NH3)5H2O]2+ - червону. Теорія кристалічного поля дозволяє пояснити появу того або іншого забарвлення у комплексних з'єднань.
Поглинання квантів світла комплексами (наприклад, що мають октаедричну будову) пояснюється взаємодією світла з електронами, що знаходяться на de-підрівні, супроводжуване їх переходом на вакантні орбіталі dg-підрівня.
Наприклад, при пропусканні світла через водний розчин, що містить катіони гексаакватитану (III) [Ti(H2O)6]3+, виявляється смуга поглинання світла в жовто-зеленій області спектру (20300 см-1, l » 500 нм). Це пов'язано з переходом єдиного електрона комплексоутворювача з de-АО на dg-підрівень:

Тому розчин, що містить [Ti(H2O)6]3+, набуває фіолетового кольору (додатковий до поглиненого жовто-зеленого).
Розчин солі ванадію [V(H2O)6]Cl3 має зелений колір. Це також обумовлено відповідними переходами електронів при поглинанні ними частини енергії світлового променя. У основному стані, при електронній конфігурації ванадію(III) 3d2, два неспарені електрони займають de-підрівень:
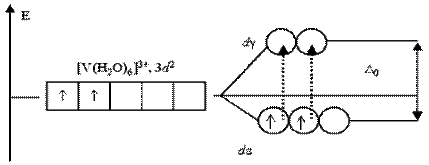
Існує всього два варіанти переходу двох електронів на dg-підрівень: або обидва електрони займають dg-АО, або тільки один з них. Будь-які інші переходи електронів, пов'язані із зменшенням сумарного спіну, заборонені.
Вказаним переходам електронів, що отримали надмірну енергію, відповідає смуга поглинання близько 400 нм в спектрі поглинання розчину хлориду гексаакваванадію (III). Поглинання пурпурно-фіолетової області спектру дає додатковий колір розчину – яскраво-зелений.
Якщо комплексоутворювач має електронну конфігурацію d0 або d10, то переходи електронів з de- на dg-підрівеньабо навпаки неможливі або через відсутність електронів, або через відсутність вакантних орбіталей. Тому розчини комплексів з такими комплексоутворювачами, як Sc(III), Cu(I), Zn(II), Cd(II) і тому подібне, не поглинають енергії у видимій частині спектру і здаються безбарвними:
Вибірковість поглинання світла залежить не тільки від комплексоутворювача і ступенів його окислення, але і від виду лігандів. При заміні в комплексному з'єднанні лігандів, що знаходяться в лівій частині спектрохімічного ряду, на ліганди, що створюють сильне електростатичне поле, спостерігається збільшення частки енергії, що поглинається електронами зі світла, що проходить, і як наслідок, – зменшення довжини хвилі відповідної смуги поглинання. Так, водний розчин, що містить катіони тетраакваміді (II) [Cu(H2O)4]2+, забарвлений в блакитний колір, а розчин сульфату тетраамінміді (II) [Cu(NH3)4]2+ має інтенсивно синє забарвлення.
Необхідно також звернути увагу, що теорія поля лігандів може пояснити зв'язок смуги поглинання з будовою комплексу тільки при симетричному полі кожного ліганду. Між тим для вживаних у фотометрії комплексів часто характерна несиметрична спрямованість поля «клешнеподібних» лігандів, наприклад саліцилату, оксихіноліну і тому подібне. Нарешті, у відповідністю із загальною думкою, теорія поля лігандів може пояснити тільки слабкі смуги поглинання, для яких Е складає від 1 до 100. Сильніші смуги комплексів елементів з d-електронами в зовнішньому (валентному) шарі найймовірніше обумовлені частковим перенесенням електронів від ліганда на вакантні орбіти центрального іона.
Існують правила відбору (заборони), дозволяючі заздалегідь визначити, які з переходів не повинні виявлятися або мають бути неінтенсивними в спектрах.
1. Заборонені переходи між енергетичними станами, що характеризуються різним спином (мультиплетністю). Ця властивість особливо важлива при інтерпретації спектрів люмінесценції, оскільки виникнення довгоживучих збуджених станів (поволі затухаючій люмінесценції, фосфоресценції) якраз обумовлене такою забороною.
2. Заборона переходу по симетрії (парності). Знаючи симетрію хвильових функцій основного і збудженого станів, можна заздалегідь знати, в яких випадках збудження не викликає зміни дипольного моменту речовини, тобто смуга не повинна виявлятися в спектрі.
Існують і інші, менш загальні, правила заборони.
Молярні коефіцієнти екстинкції (л/см•моль).
| Коеф. ек. | Тип переходу | Тип комплексу |
| 10-3-1 | заборонений по спіну і парності | d5 окт; [Mn(H2O)6]2+ |
| 1-10 | заборонений по спіну і парності дозв. по спіну, забор. по парності | тетр. d5; [MnBr4]2- [Ni(H2O)6]2+ |
| 10 -102 | заборонений по спіну і парності забор. по спіну, дозв. по парності | ков.тетр. d5окт.комп. с орг.ліг., тетр.-квад. [PdCl4]2- |
| 102-103 | дозволені по спіну, забор. по парності дозволені по спіну і парності | тетр. [NiCl4]2-; низкосим. квадратні смуги перенесення заряду (ППЗ) |
| 102-104 | дозволені по спіну, забор. по парності | низкосим. ков.(асас) |
| 103-104 | дозволені по спіну і парності | переходи з перенесенням заряду |
Дата добавления: 2016-07-27; просмотров: 1777;











