Зв'язок між будовою сполук та їх забарвленням
Теорії зафарбованості комплексних сполук
Вибіркове поглинання світла речовиною, тобто певна специфічність взаємодії світла з речовиною, завжди викликало увагу дослідників. Ця проблема не розв’язана і в теперішній час, незважаючи на велике число робіт і на достатньо успішне розв’язання окремих часткових питань.
Правильне, хоча б якісне, усвідомлення процесів поглинання світла стало можливим тільки після розвитку електронної теорії будови атома й квантової хімії. Правда, в органічній хімії ряд цінних узагальнень відносно зв’язку між будовою й забарвленням був зроблений ще до появи електронної теорії.
Електронна й квантова теорії лише надали певний фізичний зміст деяким уявленням, а в окремих випадках указали принципи розрахунку положення максимуму спектра поглинання або зсув цього поглинання при введенні замісників.
Для обчислень смуг поглинання забарвлених хімічних сполук (виходячи з їх структурних формул) існують квантовомеханічні методи, які в багатьох випадках дають результати, співпадаючі з експериментом. Розрахунки смуг поглинання барвників, молекули яких мають складну (особливо несиметричну) будову, поки важко здійсненні.
Зв'язок між будовою сполук та їх забарвленням
Теорія кольоровості виникла в зв’язку з розвитком хімії синтетичних органічних барвників. Вперше залежність між їх будовою й кольором дослідили К. Ліберман і К. Гребе (1869). О. Вітт припустив в 1876 р. так звану хромофорну теорію, відповідно до якої за колір органічних сполук відповідні групи атомів, які містять кратні зв’язки, наприклад —N=N—, —N=O. Ці групи були названі хромофорами (від грец. chroma — колір і phorós —який несе). Р. Нієцький та англ. хімік Г. Армстронг відзначили (1888) виключну роль хіноїдних хромофорів. Значний вплив на колір органічних речовин, відповідно до хромофорної теорії, мали групи —ОН, —SH, NH2—, C6H5O— и др., названі ауксохромами (від грец. auxo — збільшую). В. А. Ізмаїльський прийшов в 1915 до висновку, що істина будова барвників описується не класичною структурною формулою, а відповідає деякому проміжному стану, названому пізніше мезомерним. Для цього стану характерна делокалізація зв’язків і зарядів атомів в молекулі. Особливо легко така делокалізація відбувається в молекулах, що містять систему спряжених зв’язків в комбінації з розташованими на її кінцях електронодонорними й електроноакцепторними групами. Ця комбінація, характерна практично для усіх типів барвників, обумовлює як легкість поляризації молекул (внаслідок зміщення π-електронів по ланцюгу спряження), так і переходу молекул у збуджений стан. Перше визначає інтенсивність поглинання світла, друге — глибину забарвлення речовини.
Відчуття кольору виникає внаслідок впливу на зоровий нерв електромагнітного випромінення з частотами v в межах 3.8 х 10|4-7.6 х 1014 Гц, тобто з довжинами хвиль λ 380-760 нм (т. зв. видима частка спектра). Сумарна дія електромагнітних випромінень в усьому вказаному інтервалі викликає відчуття білого кольору, відсутність певного інтервалу довжин хвиль - забарвленого. В таблиці наведені приблизні межі інтервалів довжин хвиль монохроматичних світлових променів (так звані спектральні кольори) й додаткові кольори, які виникають в зоровому апараті, якщо з білого променя вилучається (поглинається) будь-який з спектральних кольорів.
Приблизні межі основних кольорів спектра
| λ, нм | Спектральній колір | Додатковий колір |
| 400-435 | Фіолетовий | Зеленувато-жовтий |
| 435-480 | Синій | Жовтий |
| 480-490 | Зеленувато-синій* | Оранжевий |
| 490-500 | Синювато-зелений* | Червоний |
| 500-560 | Зелений | Пурпуровий |
| 560-580 | Жовтувато- зелений | Фіолетовий |
| 580-595 | Жовтий | Синій |
| 595-605 | Оранжевий | Зеленувато-синій* |
| 605-730 | Червоний | Синювато-зелений* |
| 730-760 | Пурпурний | Зелений |
*Блакитний
Біле тіло практично цілком відбиває промені усієї видимої частки спектра, чорне - цілком поглинає їх, сіре - поглинає усе промені приблизно однаково, але не повністю, кольорове - вибірково поглинає деякі з них.
Енергія Е електромагнітного випромінення визначається рівнянням Планка: E=hv=hc/λ (h - стала Планка; с - швидкість світла; λ - довжина хвилі) й складає для видимої частки спектра ~ 158-300 кДж/моль. Для того щоб сполука була забарвлена, енергія збудження його молекули ΔE= E'- Е0 (Е0и E' - енергія молекули відповідно в основному і збудженому станах) повинна лежати в цих межах (при ΔE > 300 кДж/моль поглинання відбувається в УФ, при ΔE < 158 кДж/моль - в ІЧ частках спектра). Вказаним значенням енергії збудження відповідають переходи між різними електронними рівнями енергії молекул.
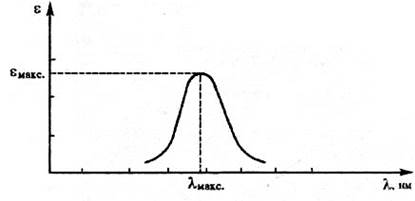
Рис. Спектральна крива поглинання.
Поглинання світла речовиною характеризується кривою поглинання, яка будується на основі вимірювання інтенсивностей поглинання світла певних довжин хвиль, обчислених за законом Бугера-Ламберта-Бера: I= I0exp(-εCL), де I0 и I -інтенсивності світлового променя до і після проходження через розчин речовини; С - молярна концентрація речовини; L - товщина шару розчину; ε- молярний коефіцієнт поглинання, або екстинкції, характерний для кожної речовини. Якщо крива поглинання побудована в координатах ε-λ, то положення її максимума на осі абсцис (λмакс) характеризує спектральний колір і є мірою енергії збудження, а положення максимума на осі ординат εмакс - інтенсивність забарвлення й є мірою імовірності електронного переходу.
Із зменшенням енергії збудження λмакс зміщується в довгохвильову частину спектру, при цьому забарвлення змінюється від жовтої до оранжевої, червоної і т. д.; така зміна кольору називається його поглибленням або батохромним зрушенням; збільшення енергії збудження, що приводить до зсуву λмакс в короткохвильову область і зміні забарвлення в зворотній послідовності, називається підвищенням кольору або гипсохромным зрушенням. Зміни в електронних спектрах поглинання характеризуються або збільшенням поглинання (гіперхромний ефект), або його зменшенням (гіпсохромний ефект). При одноелектронному переході смуга поглинання в електронному спектрі характеризується трьома основними параметрами: максимальним значенням молярного коефіцієнта світлопоглинання εмакс, хвильовим числом випромінювання (або довжиною хвилі λмакс), що поглинається, відповідним εмакс, і ефективною шириною смуги поглинання (напівширина смуги поглинання на половині її висоти).
Для забарвлених комплексних з'єднань зазвичай можна встановити, чи є центром (хромофором), що поглинає світло, іон металу або ліганд. Наприклад, саліцилова кислота утворює міцні комплекси з Al3+, In3+, Ga3+, Fe3+, Cu2+ і іншими металами. Проте перші три комплекси безбарвні, саліцилат заліза (при рН~7) червоний, а саліцилат міді зелений (суміш моно- і дисаліцилатів міді). Це дає підставу стверджувати, що в останніх двох комплексах хромофором є іон металу. По спектрах поглинання в ультрафіолеті також видно, що смуга поглинання саліцилової кислоти лише дуже мало зрушується при утворенні комплексу з алюмінієм.
Навпаки, у таких реактивів, як алізарин, дифенілтіокарбазон і т. п., якщо тільки вони утворюють комплекси з яким-небудь металом, ці комплекси завжди забарвлені. Очевидно, що хромофором тут є органічний ліганд.
У хімії органічних речовин, зокрема в хімії барвників, давно був встановлений зв'язок між забарвленням і ланцюгом простих і подвійних зв'язків, що чергується, в молекулі (ланцюг сполучення). У неорганічній хімії питання йде значно складніше, оскільки тут, мабуть, є різні типи процесів поглинання світла. Так, поза сумнівом, характер зв'язку складу речовини з поглинанням ним світла різний для таких різних речовин, як сульфід ртуті, иодид ртуті, дитизонат ртуті, берлінська блакить, роданід заліза, саліцилат заліза і так далі
Теорія Фаянса
Одне з перших узагальнень в області теорії забарвлення неорганічних з'єднань належить Фаянсу. Він зіставив ряд відомих раніше приватних закономірностей і спробував пов'язати забарвлення різних з'єднань з деформацією електронних оболонок їх аніонів. При цьому основне положення було наступним: чим більш «рихлою» є електронна оболонка аніона, інакше — чим сильніше можливість його деформації, тим інтенсивніше і глибше забарвлено з'єднання. Так, деформованість росте при збільшенні радіусу іона у ряді F-<Cl-<Br-<I-. Це відповідає відомим фактам, що фториди майже завжди безбарвні, тоді як хлориди, броміди і йодиди часто забарвлені, наприклад вісмуту, срібла, заліза і так далі. Аналогічно можна пояснювати інтенсивніше забарвлення сульфідів в порівнянні з оксидами; останні у свою чергу нерідко сильніше забарвлені, чим гідроокиси. По цій же теорії забарвлення залежить від деформуючої сили катіона. Для іонів з електронною оболонкою інертних газів їх деформуюча дія повинна збільшуватися при зростанні заряду. Цим можна пояснити, що тверді галогеніди дво- і тривалентних (не перехідних) металів безбарвні, а галогеніди чотиривалентних металів забарвлені тільки іони малого розміру (титан) і безбарвні, якщо це великі атоми, такі, як торій.
Тут забарвлення до певної міри зіставляється з міцністю зв'язку. До цього питання неодноразово поверталися багато дослідників. В окремих випадках такий зв'язок, ймовірно, має місце: чим міцніше зв'язок, тим важче він збуджується порівняно слабкими квантами видимого світла. Так, міцні фториди заліза безбарвні, тоді як хлоридні комплекси заліза забарвлені. Для дитизонатів міді, цинку і кобальту максимуми спектрів поглинання відповідно дорівнюють 504, 540 і 550 нм. Міцність комплексів зменшується в тому ж порядку.
Можна привести ще ряд подібних прикладів; проте загалом залежності складніші, тому висновки часто не відповідають дійсності. Перш за все, згідно загальним теоретичним положенням, збільшення міцності зв'язку може приводити до сильнішого порушення електронної системи компонентів. Тоді як сам факт утворення забарвлених з'єднань у водних розчинах спростовує спільність цього припущення. Дійсно, утворення будь-якого комплексу означає, що даний ліганд сильніше зв'язує катіон металу, чим цей катіон пов'язаний з молекулою води. Так, зв'язок NH3—Cu2+, очевидно, сильніше, ніж зв'язок Cu2+—Н2О, проте аміакат міді сильніше забарвлений. Далі, наприклад, у ряді AgCl—AgBr—Agl міцність зв'язку і забарвлення посилюється від хлориду до иодиду, що не відповідає названому вище положенню. Міцність зв'язку ZrIV — алізарин значно вище, ніж міцність зв'язку А13+ — алізарин; тим часом забарвлення цих комплексів мало відрізняється. Ще складніша ця залежність для з'єднань одного і того ж елементу з різними по характеру лігандами.
Спроби встановити зв'язок між міцністю комплексу і його забарвленням робилися в різний час; останнім часом для цієї мети використовуються положення квантової хімії. Проте ці спроби не можна вважати за успішні. Ймовірно, зв'язок між міцністю і забарвленням не пряма; обидві властивості є функціями деякої третьої величини, безпосередньо пов'язаною з будовою атомів і молекул. А саме, поза сумнівом, має значення спрямованість зв'язку, особливо для хелатних з'єднань.
Повертаючись до питання про зв'язок між складом з'єднання, його будовою і забарвленням, необхідно відзначити наступні недоліки теорії Фаянсу і близьких до неї положень. Перш за все ці погляди не розповсюджувалися на перехідні елементи; зазвичай автори відзначали, що перехідні елементи показують ряд виключень. Тим часом добре відомо, що саме перехідні елементи є хромофорами в багатьох забарвлених з'єднаннях. Далі, в теорії Фаянсу центром, що поглинає світло, передбачається електронегативний компонент, хоча сам по собі він не забарвлений. Тим часом в багатьох з'єднаннях хромофором є метал. Для підтвердження цього досить порівняти безбарвний сульфід цинку, жовтий сульфід кадмію і чорний сульфід свинцю. З розчинних комплексів можна порівняти, наприклад, безбарвний (хоча і високоміцний) роданідний комплекс ртуті з інтенсивно забарвленим (хоча і маломіцним) роданідним комплексом заліза. Ясно, що тут забарвлення не пов'язане з тією силою, що деформує іон металу. Очевидно, що хромофором є не роданід-іон, а іон заліза (III). Природно пов'язати це з тим фактом, що іон ртуті (II) має зовнішню стійку 18-електронну оболонку, а іон заліза (III) - легкорухливу 14-електронну з п'ятьма d-електронами. Ці зв'язки розглянуті нижче.
Дата добавления: 2016-07-27; просмотров: 1419;











