Реакция первого порядка
Реакция первого порядка может быть записана в общем виде:
A®продукты.
Примером такой реакции может служить реакция разложения диметилового эфира:
CH3OCH3® CH4 + H2 + CO.
Кинетическое уравнение реакции первого порядка можно представить в общем виде уравнением
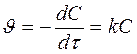 . (1.5)
. (1.5)
Разделив переменные и проинтегрировав, получим
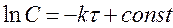 , (1.6)
, (1.6)
где С – концентрация в момент времени t.
Постоянная интегрирования может быть определена из начальных условий: при t = 0 С = С0 и ln C = ln С0; С0 – исходная концентрация.
И окончательно
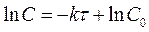 . (1.7)
. (1.7)
Итак, если реакция протекает по первому порядку, то концентрация реагирующего вещества во времени меняется по уравнению (1.7).
Из (1.7) можно легко получить:
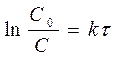 (1.8)
(1.8)
и
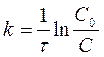 (1.9)
(1.9)
или
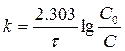 . (1.10)
. (1.10)
Из (1.8) следует, что концентрация исходного вещества со временем изменяется по экспоненциальному закону:
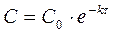 . (1.11)
. (1.11)
Рассчитаем период полураспада τ1/2, т.е. время, необходимое для того чтобы прореагировала половина исходного количества вещества.
Подставляя C = (1/2)C0 в (1.9), получим
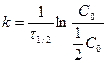 ,
,
откуда
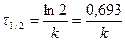 (1.12)
(1.12)
Особенностью реакции первого порядка является независимость периода полураспада от концентрации реагента.
Обратная величина константы скорости реакции первого порядка имеет физический смысл средней продолжительности жизни отдельной молекулы.
Дата добавления: 2020-07-18; просмотров: 170;










