ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
Объектом изучения термодинамики является термодинамическая система ‑ это совокупность тел, мысленно выделенная из пространства, в которой возможен массо- и теплообмен между всеми ее составными частями. По характеру взаимодействия с окружающей средой системы бывают:
1) изолированные - между системой и окружающей средой отсутствует обмен энергией и веществом;
2) закрытые - система и окружающая среда могут обмениваться между собой энергией без массообмена;
3) открытые - между системой и окружающей средой имеется обмен и веществом и энергией.
Состояние системы принято характеризовать термодинамическими параметрами (свойствами системы), которые подразделяют на интенсивные и экстенсивные. Интенсивные свойства не зависят от массы или количества вещества в системе (температура, давление, концентрация), а экстенсивные, наоборот, зависят от количества или массы вещества. К последним относятся, например, объем, энергия и др. При изменении хотя бы одного из своих параметров система переходит в другое состояние. Переход системы из начального состояния (состояние № 1) в конечное (состояние № 2) называется термодинамическим процессом. Если термодинамический процесс протекает при постоянстве какого-либо параметра, то его называют:
- изобарическим (р = const);
- изохорическим (V = const);
- изотермическим (T = const);
- адиабатическим (нет обмена теплотой или q = 0).
Для термодинамического описания системы принято использовать функции состояния - это какая-либо физическая величина, значение которой однозначно определяется термодинамическими свойствами системы. К особым свойствам функций состояния относят их независимость от пути (способа) достижения данного состояния.
Любая система обладает определенным запасом энергии, которую называют внутренней энергией U. Внутренняя энергия включает в себя энергию движения и взаимодействия молекул, атомов, ядер и других частиц, внутриядерную и другие виды энергий, кроме кинетической энергии движения системы, как целого, и потенциальной энергии ее положения. Количественный учет всех составляющих внутренней энергии невозможен, но для термодинамического анализа системы достаточно знать лишь изменение внутренней энергии при переходе системы из начального состояния в конечное DU = U2 - U1 .
Величина DU является функцией состояния системы. Значение DU положительно (DU > 0), если внутренняя энергия системы возрастает.
В ходе процессов, протекающих в изолированных системах, выполняется первый закон термодинамики: вся сообщенная системе теплота q расходуется на увеличение внутренней энергии системы DU и на совершение работы против внешних сил А
q = DU + А .
Теплота, работа и внутренняя энергия измеряются в джоулях или килоджоулях на единицу массы или количества вещества в системе (например, Дж/кг или кДж/моль). Положительной (А > 0) считается работа, совершаемая системой против внешних сил, а q > 0 в том случае, если тепло сообщается системе извне. Теплота и работа, в отличие от внутренней энергии, не является функциями состояния, так как их значения зависят от способа проведения процесса. Их называют функциями процесса.
Если на систему не действуют никакие другие силы, кроме постоянного внешнего давления, то при протекании химического процесса единственным видом работы является работа расширения А = p×DV .
В этом случае первый закон термодинамики примет вид
qp = DU + p×DV ,
где qp - теплота изобарического процесса.
Запишем более подробно
qp = U2 - U1 + pV2 - pV1 = (U2 + pV2) - (U1 + pV1).
Введем новую функцию состояния H = U + pV , называемую энтальпия. Тогда первый закон термодинамики для изобарического процесса можно записать следующим образом
qp = H2 - H1 = DH .
Для изохорического процесса работа расширения системы равна нулю, следовательно, первый закон термодинамики в этом случае будет выражаться уравнением
qV = DU ,
где qV - теплота изохорического процесса.
Для химических реакций изменение внутренней энергии и изменение энтальпии связаны между собой соотношением
DU = DH - Dn×R×T,
где Dn - изменение числа моль газообразных веществ в реакции, моль; T - температура, К; R = 8,314 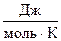 .
.
Пример 1.При постоянном давлении 1,01×105 Па газ расширили от объема 1×10-2 м3 до объема 1,6×10-2 м3, при этом система поглотила 125,6 Дж тепла. Вычислите изменение внутренней энергии в данном процессе.
Р е ш е н и е
1. Вычислим работу расширения системы
А = p×DV = 1,01×105 Па (1,6×10-2 - 1×10-2) м3 = 606 Дж;
2. Используем первый закон термодинамики
DU = q - A = 125,6 - 606 = -480,4 Дж .
Пример 2. Рассчитайте изменение внутренней энергии при испарении 100 г воды при 20°С, если на испарение 1 г воды расходуется 2,4 кДж тепла. Пар считать идеальным газом, а объемом жидкой воды пренебречь.
Р е ш е н и е
1. Вычислим количество теплоты, необходимое для испарения 100 г воды
q = 100 × 2,4= 240 кДж;
2. Так как при испарении жидкости давление и температура не изменяются, то работу расширения системы можно определить, используя закон Менделеева-Клапейрона
A = p(Vпара - Vжид) » pVпара = 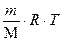 = =
= = 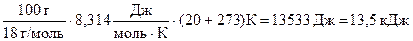 ;
;
3. Вычисляем изменение внутренней энергии
DU = q - A = 240 - 13,5 = 226,5 кДж .
Пример 3.Определите DU реакции 2Cl2, газ + 2Н2Огаз = 4НСlгаз + О2, газ при 298 К, если DН298реакции равно 114,5 кДж.
Р е ш е н и е
1. Вычислим Dn реакции
Dn = nHCl + nO2 - nCl2 - nH2O = 4 + 1 - 2 - 2 = 1 моль;
2. Тогда изменение внутренней энергии реакции составит
DU = DH - Dn×R×T = 114500 Дж - 1 моль×8,314 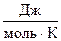 ×298 К = 112022 Дж .
×298 К = 112022 Дж .
ОСНОВЫ ТЕРМОХИМИИ
Термохимия - область науки, изучающая тепловые эффекты, которыми сопровождаются химические реакции. Тепловым эффектом химической реакции Q называют количество теплоты, которое поглощается или выделяется при полном необратимом протекании реакции в изобарно-изотермических или изохорно-изотермических условиях.
Если в результате реакции теплота выделяется во внешнюю среду, то Q считается положительным, а реакцию называют экзотермической. При протекании процесса с поглощением теплоты реакцию называют эндотермической, а Q считается отрицательным. Согласно принятой системе знаков, между Q и q должно выполняться следующее соотношение
Q = -q .
Тепловой эффект реакции, определенный в изобарно-изотермических условиях обозначается QP , а в изохорно-изотермических QV . Из первого закона термодинамики следует, что тепловой эффект реакции является функцией состояния системы, то есть не зависит от способа осуществления реакции. Математически это отражается уравнениями
QV = -qV = -DU ; QP = -qp = -DH .
Основным законом термохимии является закон Гесса: тепловой эффект химической реакции не зависит от пути ее протекания, то есть числа и характера промежуточных стадий, а зависит только от природы и состояния исходных веществ и продуктов реакции. Исторически закон Гесса был сформулирован раньше первого закона термодинамики.
Поясним закон Гесса на примере образования диоксида углерода. СО2 может быть получен двумя способами
I способ: С + О2 = СО2 + Q1 ;
II способ: 1) С + 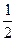 О2 = СО + Q2 ; 2) СО +
О2 = СО + Q2 ; 2) СО + 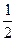 О2 = СО2 + Q3 .
О2 = СО2 + Q3 .
Согласно закону Гесса, тепловые эффекты образования СО2 по I и II способу должны быть равны, то есть Q1 = Q2 + Q3 .
Уравнение химической реакции, записанное с указанием его теплового эффекта, называется термохимическим уравнением. Такие уравнения имеют ряд особенностей:
1) указывается фазовое состояние или полиморфная модификация веществ, кроме очевидных случаев (г - газовое, ж - жидкое, к - кристаллическое, т - твердое, р - растворенное и др.);
2) допускаются дробные коэффициенты перед веществами;
3) имеется возможность производить с уравнениями некоторые алгебраические операции (сложение, вычитание, деление или умножение на целое число).
В термохимических уравнениях тепловой эффект принято записывать либо непосредственно в уравнении реакции, например:
Н2, г + 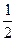 О2, г = Н2Ож + QP кДж
О2, г = Н2Ож + QP кДж
либо после уравнения Н2, г + 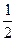 О2, г = Н2Ож , DН = -QP
О2, г = Н2Ож , DН = -QP 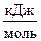 .
.
Последняя форма записи употребляется чаще, поэтому в дальнейшем будет использоваться только такая форма записи.
Для удобства тепловые эффекты различных процессов определяют при одинаковых условиях: давлении 101325 Па и температуре 298 К. Такие условия называются стандартными, а соответствующим им тепловой эффект - стандартным тепловым эффектом. Стандартные тепловые эффекты обозначают DH 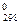 (DU
(DU 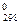 ).
).
Из закона Гесса вытекает несколько важных следствий. Рассмотрим некоторые из них.
Следствие 1: теплота, выделяющаяся при образовании вещества, равна теплоте, поглощаемой при разложении такого же его количества на исходные составные части (иначе это закон Лавуазье-Лапласа). Это означает, что, например, для реакций
СаСО3, т = СаОт + СО2, г , DН1;
СаОт + СО2, г = СаСО3, т , DН2
при одинаковых температурах будет выполняться соотношение DН1 = -DН2 .
Следствие 2: энтальпия химической реакции равна сумме энтальпий образования продуктов реакции минус сумма энтальпий образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции.
Для реакции общего вида aA + bB = dD + fF данное следствие означает
DН = dDН 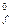 (D) + fDН
(D) + fDН 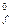 (F) - aDН
(F) - aDН 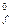 (A) - bDН
(A) - bDН 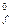 (B).
(B).
Энтальпией образования вещества DН 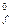 называют изменение энтальпии реакции образования 1 моль данного вещества из простых веществ. Если энтальпия образования вещества определена при стандартных условиях, то ее называют стандартная энтальпия образования вещества и обозначают DН
называют изменение энтальпии реакции образования 1 моль данного вещества из простых веществ. Если энтальпия образования вещества определена при стандартных условиях, то ее называют стандартная энтальпия образования вещества и обозначают DН 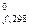 . Для большинства веществ DН
. Для большинства веществ DН 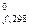 определены и приводятся в справочной литературе (значения некоторых из них см. в приложении). Стандартные энтальпии образования простых веществ, устойчивых при стандартных условиях, приняты равными нулю. Например, устойчивой модификацией углерода при стандартных условиях является графит, а неустойчивой - алмаз, поэтому DН
определены и приводятся в справочной литературе (значения некоторых из них см. в приложении). Стандартные энтальпии образования простых веществ, устойчивых при стандартных условиях, приняты равными нулю. Например, устойчивой модификацией углерода при стандартных условиях является графит, а неустойчивой - алмаз, поэтому DН 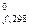 (Сграфит) = 0, а DН
(Сграфит) = 0, а DН 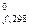 (Салмаз) = 1,9
(Салмаз) = 1,9 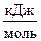 .
.
Следствие 3: энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ минус сумма энтальпий сгорания продуктов реакции с учетом стехиометрических коэффициентов в уравнении реакции.
Или математически для реакции вида aA + bB = dD + fF
DН = aDН 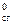 (A) + bDН
(A) + bDН 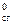 (B) - dDН
(B) - dDН 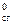 (D) - fDН
(D) - fDН 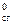 (F).
(F).
Энтальпией сгорания вещества DН 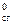 называют изменение энтальпии реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов. Значения энтальпий сгорания веществ имеются в справочной литературе. DН
называют изменение энтальпии реакции окисления кислородом элементов, входящих в состав вещества, до образования высших оксидов. Значения энтальпий сгорания веществ имеются в справочной литературе. DН 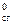 для высших оксидов равно нулю.
для высших оксидов равно нулю.
С помощью термохимических расчетов можно определить энергетические эффекты многих процессов: энергию образования химической связи, энергию кристаллической решетки, энергию межмолекулярного взаимодействия, энтальпию растворения и сольватации, энтальпию фазовых переходов и т.д.
Пример 1. Вычислите энтальпию реакции СН4, г + Cl2, г = СH3Clг + НClг , используя следующие термохимические уравнения:
1. СН4, г + 2О2, г = СО2, г + 2Н2Ож , DH 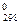 = -892,0 кДж;
= -892,0 кДж;
2. 2СН3Clг + 3О2, г = 2СО2, г + 2Н2Ож + 2HClг , DH 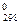 = -1374 кДж;
= -1374 кДж;
3. 2Н2,г + О2, г = 2Н2Ож , DH 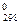 = -571,7 кДж;
= -571,7 кДж;
4. Н2, г + Сl2, г = 2НСlг , DH 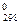 = -185,0 кДж .
= -185,0 кДж .
Р е ш е н и е
Из предлагаемого набора термохимических уравнений попытаемся получить уравнение, тепловой эффект которого просят найти. Для этого необходимо сложить реакции 1 и 4 и вычесть из этой суммы реакции 2 и 3, причем в реакциях 2 и 3 коэффициенты перед веществами следует уменьшить вдвое. Таким образом, требуется провести алгебраические действия, отвечающие схеме: (1) + (4) - 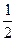 (2) -
(2) - 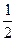 (3) .
(3) .
СН4, г + 2О2, г + Н2, г + Сl2, г - СН3Clг - 1,5О2, г - Н2,г - 0,5О2, г = СО2, г + 2Н2Ож +
+ 2НСlг - СО2, г - Н2Ож - HClг - Н2Ож .
После сокращения подобных членов и смены знаков перед веществами с минуса на плюс имеем уравнение СН4, г + Cl2, г = СH3Clг + НClг. Произведя аналогичные действия с тепловыми эффектами реакций 1- 4, получим требуемый тепловой эффект:
DH 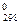 = DH
= DH 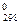 (1) + DH
(1) + DH 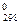 (4) -
(4) - 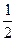 DH
DH 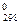 (2) -
(2) - 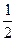 DH
DH 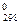 (3) =
(3) =
= - 892, 0 - 185,0 + 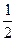 1374 +
1374 + 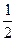 571,7 = - 104,2 кДж .
571,7 = - 104,2 кДж .
Пример 2. Вычислите DН 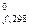 (N2O), если DН
(N2O), если DН 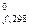 (СО2) = -393,5 кДж/моль, а DН
(СО2) = -393,5 кДж/моль, а DН 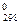 реакции Сграфит + 2N2O = CO2 + 2N2 равно -575,5 кДж.
реакции Сграфит + 2N2O = CO2 + 2N2 равно -575,5 кДж.
Р е ш е н и е
Используем второе следствие закона Гесса:
DН 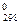 = DН
= DН 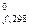 (СО2) + 2DН
(СО2) + 2DН 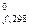 (N2) - DН
(N2) - DН 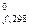 (Сграфит) - 2DН
(Сграфит) - 2DН 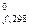 (N2O)
(N2O)
или DН 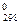 = DН
= DН 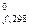 (СО2) - 2DН
(СО2) - 2DН 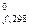 (N2O),
(N2O),
так как стандартные энтальпии образования простых веществ N2 и Сграфит равны нулю. Выразим DН 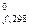 (N2O):
(N2O):
DН 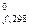 (N2O) =
(N2O) = 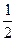 [DН
[DН 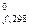 (СО2) - DН
(СО2) - DН 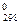 ] =
] = 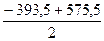 = 91 кДж/моль.
= 91 кДж/моль.
Пример 3. При взаимодействии 2,1 железа с серой выделилось 3,77 кДж тепла. Вычислите DН 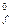 (FeS).
(FeS).
Р е ш е н и е
Запишем уравнение химической реакции: Fe + S = FeS . Следовательно, DН 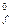 (FeS) - это тепловой эффект данной реакции в расчете на 1 моль сульфида железа (II). Учитывая, что при выделении системой тепла изменение энтальпии отрицательно, можно составить пропорцию:
(FeS) - это тепловой эффект данной реакции в расчете на 1 моль сульфида железа (II). Учитывая, что при выделении системой тепла изменение энтальпии отрицательно, можно составить пропорцию:
2,1 г Fe соответствует -3,77 кДж ,
55,8 г (1 моль Fe) соответствует DН 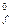 (FeS) .
(FeS) .
Тогда DН 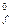 (FeS) = -
(FeS) = - 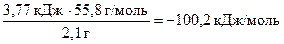 .
.
Пример 4. Вычислите DН 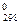 реакции 3Fe2O3,к + СОг = 2Fe3O4, к + СО2, г .
реакции 3Fe2O3,к + СОг = 2Fe3O4, к + СО2, г .
Р е ш е н и е
Согласно второму следствию закона Гесса
DН 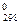 = DН
= DН 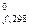 (СО2, г) + 2DН
(СО2, г) + 2DН 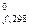 (Fe3O4, к) - 3DН
(Fe3O4, к) - 3DН 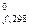 (Fe2O3, к) - DН
(Fe2O3, к) - DН 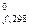 (СOг).
(СOг).
Тогда, используя справочные данные приложения, получим
DН 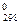 = -393,5 - 2×1120 + 3×825 + 110,5 = -48,0 кДж.
= -393,5 - 2×1120 + 3×825 + 110,5 = -48,0 кДж.
Пример 5. Вычислите энтальпию реакции в стандартных условиях, используя данные об энтальпиях сгорания веществ, 2Сграфит + О2 = 2СО.
Р е ш е н и е
По третьему следствию закона Гесса, используя данные приложения, получаем:
DН 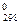 = 2DН
= 2DН 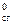 (Сгр) + DН
(Сгр) + DН 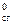 (O2) - 2DН
(O2) - 2DН 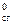 (СO) =
(СO) = 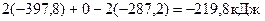
Дата добавления: 2018-11-26; просмотров: 402;










