Состав вещества. Смеси. Измерение вещества
Еще в 1748 г. основоположник отечественной химии М. В. Ломоносов писал: «Химическая наука рассматривает свойства и изменения тел ... , состав тел ... , объясняет причину того, что с веществами при химических превращениях происходит». Сравните определение, данное великим М. В. Ломоносовым, с современным определением.
Химия - это наука о составе, строении, свойствах и превращениях веществ.
Исходя из современного определения химической науки, которое удивительно близко к ломоносовскому, рассмотрим некоторые основные первоначальные понятия: вещество, атом, молекула, химический элемент и др.
Вещество- один из видов материи, который характеризуется массой покоя. Это совокупность атомов, ионов или молекул, состоящих из одного или нескольких химических элементов.
Какой же вид материи нельзя назвать веществом? Какой вид материи не имеет массы покоя? Из курса физики вы знаете, что к такому виду материи относятся различные поля, в том числе электромагнитное и гравитационное.
Атом- это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов
Атом - наименьшая частичка химического элемента, предел химической делимости материи.
Молекула- это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного или нескольких элементов, которая определяет химические свойства вещества.
Химический элемент- это совокупность атомов с одинаковым зарядом ядра.
Все элементы (и простые вещества) обычно делят на металлы и неметаллы. К неметаллам.относят 22 элемента: водород, бор, углерод, кремний, азот, фосфор, мышьяк, кислород, серу, селен, теллур, галогены и благородные газы; к металлам. - все остальные элементы.
Вещество, образованное одним химическим элементом, называют простым. Один и тот же химический элемент может образовать несколько простых веществ. Это явление называют аллотропией,а различные простые вещества, образованные одним элементом, - аллотропными видоизменениями, или аллотропными модификациями(например, алмаз и графит - это простые вещества, образованные одним и тем же элементом - углеродом).
Очень интересно, а в настоящее время и практически значимо превращение одной аллотропной модификации углерода (графита) в другую (алмаз):
С(графит) óС(алмаз)
Этот процесс используют для получения искусственных алмазов. В 1954 г. ученые лаборатории знаменитой американской фирмы «Дженерал Электрик» получили черные кристаллики искусственных алмазов массой 0,05 г при экстремальных условиях: давлении 100000 атм и температуре 2600ОС. Такие алмазы стоили в сотни раз дороже природных. Но уже в течение 10 лет были разработаны технологии, позволяющие получить в одной камере за несколько минут 20 и более граммов алмазов. Современное производство искусственных алмазов основано на их получении из графита не только при сверхвысоких, но и при низких давлениях. Такие алмазы сравнительно дешевы, однако используются преимущественно в технических целях в металлургии и машиностроении, радиоэлектронике и приборостроении, геологоразведке и горной промышленности.
Причиной трагического исхода некоторых экспедиций покорителей полярных (арктической и антарктической) «шапок» Земли явилось то, что исследователи не учли взаимопревращение аллотропных модификаций олова:
Sп(белое) ó Sn(cepoe)
Белое олово - это мягкий пластичный металл, с которым мы чаще всего и сталкиваемся. Однако при понижении температуры оно может превращаться в серое олово - порошок, обладающий свойствами неметаллов. Этот процесс ускоряется самим серым оловом: достаточно появиться всего лить одной пылинке серого олова, как начинается процесс, который уже невозможно остановить.
При этом изделие из белого блестящего металла превращается в серый невзрачный порошок. Такой процесс носит образное название «оловянная чума». Именно он и стал причиной гибели экспедиции Р. Скотта, пытавшегося в 1912 г. покорить Южный полюс. Экспедиция Скотта использовала для хранения продуктов и керосина железные канистры, запаянные оловом. На сильном морозе оловянный припой канистр рассыпался, и экспедиция осталась без топлива.
Для многих других химических элементов также характерно явление аллотропии. Так, кислород образует две модификации - кислород 02 и озон ОЗ (греч. ozon - пахнущий).
Озон содержится в верхних слоях атмосферы и интенсивно поглощает коротковолновые ультрафиолетовые лучи. Таким образом, атмосфера защищает жизнь на Земле от коротковолновых лучей.
Вместе с тем атмосфера пропускает инфракрасное излучение Солнца, но благодаря содержащемуся в атмосфере озону, углекислому газу и водяному пару она непрозрачна для инфракрасного излучения Земли. Если бы эти газы не содержались в атмосфере, Земля превратилась бы в безжизненный шар, средняя температура на поверхности которого была бы -23ОС, в то время как фактически она равна +14,8ОС.
Перед человечеством стоит насущная задача - сохранить этот жизнеобеспечивающий экран от разрушения, так как с космических спутников приходят тревожные данные об уменьшении толщины озонового слоя атмосферы - так называемых озоновых дырах ( рис. 1).
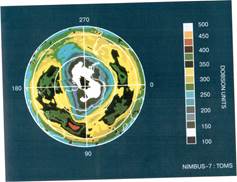
Рис. 1.Озоновый слой Земли на фото со спутника.
Белая область - наиболее тонкий слои озона
Озон и кислород будучи простым и веществами, образованными одним элементом, тем не менее обладают разными свойствами. Кислород не имеет запаха, а озон пахнет свежестью. озон в отличие от кислорода бактерициден; это свойство используют для обеззараживания питьевой воды (озонирование воды гораздо безопаснее для здоровья человека, чем хлорирование). Озон - гораздо более сильный окислитель, чем кислород, поэтому он энергично обесцвечивает краски, окисляет серебро, разрушает органические соединения. Последнее свойство позволяет использовать его для устранения неприятных запахов, т.е. дезодорирования.
Аллотропия является одним из факторов, обусловливающих многообразие веществ. Она вызывается двумя основными причинами:
1) переходом количественных изменений в качественные, в чем нетрудно убедиться на примере аллотропии кислорода;
2) различным кристаллическим строением аллотропных модификаций; например, все модификации углерода имеют атомную кристаллическую решетку, но у алмаза она объемная тетраэдрическая, а у графита слоистая, потому так непохожи свойства алмаза и графита.
Простые вещества- это вещества, образованные одним химическим элементом. Однако гораздо больше веществ сложных.
Вещества, состоящие из двух и более химических элементов, называют сложными.
Различают качественный и количественный состав веществ.
Качественный состав- это совокупность химических элементов и (или) атомных группировок, составляющих данное химическое вещество.
Количественный состав- это показатели, характеризующие количество или число атомов того или иного химического элемента и (или) атомных группировок, образующих данное химическое вещество.
Основные понятия и законы химии
Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или первой и одной из последующих букв латинских названий элементов.
Химический знак (символ)несет значительную информацию. Он обозначает название элемента, один атом его, один моль атомов этого элемента. По символу химического элемента можно определить его атомный номер и относительную атомную массу.
Химическая формула- это способ отображения химического состава вещества. Как и химический знак, химическая формула несет немалую информацию. Она обозначает название вещества, одну молекулу его, один моль этого вещества. По химической формуле можно определить качественный состав вещества, число атомов и количество вещества каждого элемента в одном моле вещества, его относительную молекулярную и молярную массы.
Формулы веществ составляют на основании еще одного важнейшего понятия химии - валентности.
Валентность - это способность атомов одного химического элемента соединяться со строго определенным числом атомов другого химического элемента.
Например, атом водорода одновалентен, поэтому в молекуле водорода Н2 он соединяется только с одним таким же атомом водорода. Атом кислорода двухвалентен, поэтому в молекуле воды Н2О он соединяется с двумя атомами водорода. Четырехвалентный углерод в молекуле метана СН4 соединяется с четырьмя атомами водорода, а в молекуле углекислого газа С02 - с двумя атомами двухвалентного кислорода.
Широко используются несколько видов химических формул.
1. Простейшая (эмnирическая) формула показывает качественный состав и соотношения, в которых находятся частицы: атомы, ионы, группы атомов, образующие данное вещество. Например, простейшая формула этана (органического вещества) СН4·
2. Молекулярная (истинная) формула отражает качественный состав и число составляющих вещество частиц (например, для этана - С2Н6), но не показывает порядок связей частиц в веществе, т. е. его структуру.
3. Графическая формула отражает порядок соединения атомов
| Н | Н | |||||
| l | l | |||||
| Н | — | С | — | С | — | Н |
| l | l | |||||
| Н | Н |
Кроме формул для наглядности нередко используют модели атомов и молекул простых и сложных веществ.
Массы атомов и молекул, из которых построены вещества, чрезвычайно малы. Однако современные методы исследования позволяют определять их с большой точностью. Так, масса атома углерода 12С равна 1,993х10-26 кг, масса атома кислорода изотопа 160 составляет 2,667 х 10-26 кг, а масса самого легкого атома - водорода IН равна 1,674 х10-27 кг.
Выражать массы атомов с помощью общепринятых единиц массы - килограммов, граммов или даже миллиграммов неудобно ввиду их очень малых значений. Поэтому в химии традиционно используют не абсолютные, а относительные значения масс.
В 1961 г. в химии и физике была принята единая углеродная атомная единица массы (а. е. м.), представляющая собой 1/12 массы атома углерода 12С:
1 а. е. м. = 1/12т(12С)= 1,66057' 10-27 кг.
· Относительная атомная масса (Аr) химического элемента - это величина, показывающая отношение средней массы атома природной изотопной смеси элемента к 1/12 массы атома углерода 12C.
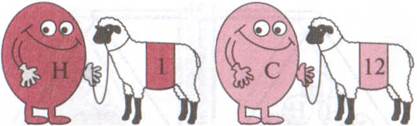 Относительная атомная масса - одна из основных характеристик химического элемента (рис. 1).
Относительная атомная масса - одна из основных характеристик химического элемента (рис. 1).
Рис. 1. Каждый химический элемент имеет свою относительную атомную массу
Относительная атомная масса самого легкого химического элемента водорода равна 1. Поэтому относительные атомные массы других элементов можно сравнивать с относительной атомной массой водорода (рис. 2)
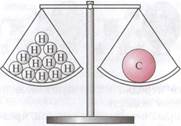
Рис. 1.2. Атом углерода в 12 раз тяжелее атома водорода 1Н
· Относительная молекулярная масса (Мr) равна сумме относительных атомных масс всех атомов, образующих молекулу вещества.

|

|

|
Если вещество не молекулярного, а, например, ионного строения, то и для такого вещества используют понятие относительной молекулярной массы, но рассчитывают ее по формульным единицам вещества (рис. .3, 4).
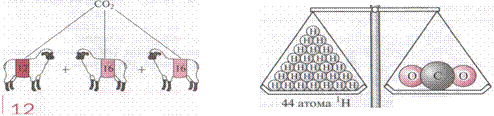
Рис. 3. Так рассчитывают относительную Рис. 4. Молекула углекислого газа СО2
молекулярную массу углекислого газа в 44 раза тяжелее атома водорода lH
Количество вещества (п или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества. Так как вещество состоит из огромного числа частиц, то количество вещества удобно измерять в крупных единицах, содержащих большое число частиц.
В Международной системе единиц (СИ) за единицу количества вещества принят моль.
· Моль- это количество вещества, содержащее столько же формульных единиц, сколько атомов содержат 0,012 кг изотопа углерода 12С
Для нахождения одного моля вещества можно руководствоваться следующим несложным правилом: моль - это количество вещества, масса которого, выраженная в граммах, численно равна относительной 'молекулярной массе.
Массу одного моля называют молярной массойи обозначают буквой М:
М = Мr. 1 г/моль.
Единицы измерения молярной массы - г/моль, кг/кмоль или мг/ммоль.
Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества (NA) и массу (то) отдельной молекулы(или атома):
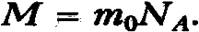
Массу молекулы (атома) в килограммах можно рассчитать по уравнению
mo= Мr,х1 а. е. м. = Мr x1,66x10-27 кг,
следовательно
М·x10-3 (кг/моль) = NAMrx1,66x10-27 (кг/моль).
Из этого выражения можно определить число молекул или атомов, содержащихся в одном моле любого вещества, которое называют постоянной Авогадро.
Постоянная Авогадро (NA) - число атомов или молекул (или других формульных единиц), содержащихся в одном моле вещества; она всегда равна 6,022·1023 моль-1 (NA = 6,022·1023 моль-1)
Количество вещества измеряют в молях, киломолях или миллимолях. Количество вещества рассчитывают как отношение: масы т вещества к его молярной массе; числа N молекул, атомов или формульных единиц к постоянной Авогадро; объема газа V при нормальных условиях (н. у.) к молярному объему Vт:
| n= | m | = | N | = | V |
| M | NA | Vm |
Контрольные вопросы
1. Что является предметом изучения химии? Дайте определение понятия «вещество». Как соотносятся понятия «вещество» и «материя»?
2. Какие частицы называют атомами и молекулами?
3. Дайте определение понятия «химический элемент».
4. Какие вещества называют простыми? Приведите примеры.
5. Охарактеризуйте явление аллотропии. Какие факторы его вызывают? Приведите примеры аллотропных модификаций кислорода. Сравните их. Укажите фактор, который вызывает аллотропию этого элемента.
6. Расскажите об аллотропии углерода. Сравните аллотропные модификации углерода. Назовите основные области их применения.
7. Охарактеризуйте техническое значение олова и области применения этого металла.
8. Подготовьте сообщение об истории получения искусственных алмазов и назовите области их применения.
9. Подготовьте сообщение на тему «Обеззараживание питьевой воды: пути и перспективы
10. Какое вещество называют сложным?
11. Какую информацию можно получить, анализируя качественный и количественный состав вещества?
12. Что показывает химическая формула?
13. Охарактеризуйте понятия «относительная атомная масса химического элемента», «относительная молекулярная масса вещества». Как рассчитывают эти характеристики?
14. Какие разновидности химических формул вы знаете?
15. Найдите относительные молекулярные массы веществ, состав которых описывается формулами: О3, H2S04, Саз(РО4)2, Cu(OH)2.
16. Дайте определение понятия «количество вещества». Назовите единицы измерения количества вещества.
17. Чем отличается относительная молекулярная масса вещества от молярной массы? Найдите молярную массу азотной кислоты, гидроксида натрия, сульфата алюминия.
18. Сколько молекул содержится в 32 г сернистого газа S02?
19. Какова масса 1,2·102З молекул аммиака NН3?
Литература:
1. Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с.
2. Габриелян О,С. Химия: учеб для студ. сред. проф. учеб. заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
| <== предыдущая лекция | | | следующая лекция ==> |
| СИСТЕМА НАЛОГОВ И СБОРОВ РОССИЙСКОЙ ФЕДЕРАЦИИ | | | Общий обзор стран Азии. Состав региона. Особенности хозяйства. Роль стран Азии в мире. Туризм |
Дата добавления: 2020-05-20; просмотров: 900;











