Методы гравиметрии (закон сохранения массы элемента)
Способ сравнения с эталоном при проведении количественного анализа методом гравиметрии следующий. Проводят химическую реакцию с реагентом, вступающим в химическую реакцию с определяемым компонентом в строго определенных соотношениях (стехиометрично), и точно измеряют массу (аналитический сигнал) гравиметрической формы – образующегося высокочистого вещества продукта реакции строго определенного состава и далее количественно выделенного из раствора.
Разновидности метода гравиметрии связаны с агрегатным состоянием вещества образующегося продукта реакции – твердым, жидким или газообразным.
Вещество сравнения в виде химического реактива или стандартного образца состава при проведении химического анализа методом гравиметрии, в отличие от методов титриметрии и физических методов анализа, не требуется. Оно используется в период разработки методики определения конкретного компонента в конкретном анализируемом веществе методом гравиметрии для выбора реагентов и условий проведения гравиметрических операций, обеспечивающих получение высокочистого вещества гравиметрической формы с химическим составом точно соответствующем химической формуле. Измеряя массу вещества гравиметрической формы и зная его молярную массу, по сути, определяют число частиц основного компонента в ней. Следовательно, вещество гравиметрической формы является внутренним веществом сравнения (внутренним стандартом).
Расчет содержания определяемого компонента производят на основе закона сохранения массы (следовательно, количества частиц) химических элементов при химических взаимодействиях из пропорции между массами и молярными массами определяемого компонента и основного компонента вещества сравнения – гравиметрической формы, с учетом стехиометрии реакции.
Гравиметрические методы подразделяют на две группы: 1) методы отгонки; 2) методы осаждения. Для получения гравиметрической формы (вещества сравнения) используют реакции обмена, замещения, разложения и комплексообразования, а также электрохимические реакции.
В методах осаждения навеску анализируемого вещества растворяют и прибавляют 1,5 - кратный избыток реагента-осадителя, соблюдая необходимые условия осаждения. Определяемый компонент вступает в химическую реакцию с реагентом, образуя малорастворимый продукт. Полученный осадок называютосаждаемой формой.Осадок отделяют от раствора (чаще всего фильтрованием), промывают, затем высушивают и прокаливают, получая гравиметрическую (весовую) форму. Твердый осадок известного химического состава взвешивают.
Например, содержание сульфатов в горной породе может быть определено методом гравиметрии после соответствующей подготовки пробы вещества горной породы (перевода в раствор с помощью сильных минеральных кислот). Содержание сульфатов в природных и сточных водах также может быть определено методом гравиметрии. Для этого используют свойство сульфатов образовывать малорастворимое соединение с ионами Ва2+,которое соответствующим образом выделяют количественно в сухом виде с минимальным содержанием примесей и взвешивают.
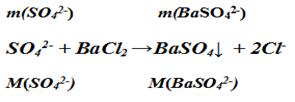
Расчет содержания сульфат-ионов производят на основе закона сохранения массы (следовательно, количества частиц) химических элементов при химических взаимодействиях из пропорции:
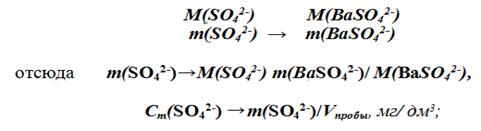
В методах отгонки определяемый компонент выделяется из пробы в виде газа; в этом случае анализ основан либо на определении массы отогнанного компонента, либо на определении массы остатка. Методы отгонки применяют в нескольких модификациях: а) определяемый компонент отгоняют из смеси, и образовавшийся отгон взвешивают; б) определяемый компонент отгоняют, поглощают каким-либо поглотителем и взвешивают поглотитель, по прибавке в массе определяют количество отогнанного компонента; в) определяемый компонент отгоняют из точной навески анализируемого вещества, после окончания отгонки навеску снова взвешивают и по разнице в массе определяют количество отгона. Методами отгонки часто определяют содержание двуокиси углерода в карбонатных породах, количество кристаллизационной воды в солях, минералах и т. д. Методы отгонки могут применяться только в том случае, если проба содержит летучий компонент или когда определяемый компонент может превращаться в летучее соединение по какой-либо реакции.
Таблица 1.1 Примеры гравиметрических определений
| Определя-емый компонент | Реагент | Уравнение и тип реакции | Измеряемая величина |
| BaCl2 | 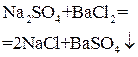 осаждение
осаждение
| Масса BaSO4 после прокаливания осадка |
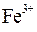
| NH4OH | 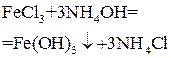 осаждение
осаждение
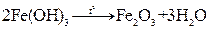 разложенние
разложенние
| Масса Fe2O3, полученного прокаливанием осадка Fe(OH)3 |
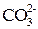
| HCl | 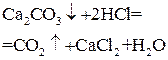 отгонка
отгонка
| Масса поглотителя после улавливания выделившегося СО2 |
| Диметил-глиоксим | 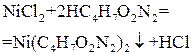 комплексообразование-осаждение
комплексообразование-осаждение
| Масса высушенного осадка Ni(C4H7O2N2)2 |
Объекты гравиметрического анализа в экологии и определяемые компоненты –
ПНД Ф 14.1:2:3:4.265-2011 Методика измерений массовой концентрации калия в питьевых, поверхностных, подземных пресных и сточных водах гравиметрическим методом.
РД 52.24.483-2005 Массовая концентрация сульфатов в водах. Методика выполнения измерений гравиметрическим методом
ПНД Ф 14.1:2:3:4.240-2007 (издание 2011 г.) Методика измерений массовой концентрации сульфат-ионов в питьевых, поверхностных, подземных и сточных водах гравиметрическим методом.
ПНД Ф 16.1:2:2.2:3.65-10 Методика измерений массовой доли диоксида кремния в пробах почв, грунтов, донных отложений, илов, отходов производства и потребления гравиметрическим методом.
ПНД Ф 16.1:2:2.2:3.53-08 Методика выполнения измерений массовой доли водорастворимых форм сульфат-ионов в почвах, илах, донных отложениях, отходах производства и потребления гравиметрическим методом.
ПНД Ф 16.1.41-04 Методика выполнения измерений массовой концентрации нефтепродуктов в пробах почв гравиметрическим методом
Виды анализа – количественный элементный и функциональный (ионы разной степени окисления) анализ; определение главных, сопутствующих и следовых компонентов; однокомпонентный анализ; макроанализ;
Метрологические характеристики гравиметрических методов анализа:прецизионный анализ, предел определения до 0,2 %; диапазон определяемого содержанияот n*10-3 до n*10 %; анализ жидкой фазы – поэтому используют подготовку проб: твердые пробы растворяют; не экспрессный анализ – несколько проб за смену.
Методы титриметрии (закон эквивалентов)
Способ сравнения с эталоном при проведении количественного анализа методом титриметрии следующий. Проводят химическую реакцию между определяемым компонентом А, находящимся в растворе,с точно определённым количеством реагента – компонентом В, который тоже находится в растворе и носит название титранта или рабочего эталона. Компонент В вступает в химическую реакцию с определяемым компонентом А без побочных реакций, без остатка, в строго определенных соотношениях (стехиометрично).
aA + bB = cC + dD
Этот рабочий эталон (стандартный или стандартизованный раствор титранта) хранит и воспроизводит концентрацию числа конкретных частиц – эквивалентов, выраженную в моль/дм3 через международные эталоны массы (1 кг), длины (1 м) и число Авогадро, отражающего число частиц в 1 моль.
Стандартный раствор титранта готовят путём растворения в мерной колбе точно измеренной массы вещества сравнения. В качестве вещества сравнения может быть использован химический реактив соответствующей степени чистоты, содержащий определяемый компонент в количестве более 99 %, или стандартный образец состава вещества, в котором содержание определяемого компонента известно с наивысшей точностью.
Разновидности метода титриметрии связаны с типом проводимой химической реакции. Тип реакции обусловлен химическими свойствами определяемого компонента. Это могут быть реакции нейтрализации, окисления-восстановления, комплексообразования, осаждения.
Реакция может быть переписана в условных частицах – эквивалентах, для которых стехиометрические коэффициенты для всех участников реакции равны единице:
1 [a/b A] + 1 [B] = 1 [c/b C] + 1 [d/b D]
Здесь эквивалентом компонента А является условная частица [a/b A], эквивалентом компонента В является условная частица [B], эквивалентом компонента С является условная частица [c/b C], эквивалентом компонента D является условная частица [d/b D]. Условные частицы – эквиваленты устанавливаются для каждого типа химической реакции по своим правилам.
Физический смысл записи уравнения реакции через условные частицы – эквиваленты следующий: один моль эквивалентов компонента А реагирут с одним молем эквивалентов компонента В и образуется по одному молю компонента С и D соответственно.
В этом случае согласно правилам математики* можно приравнять число частиц – эквивалентов nэ всех участников реакции друг другу, что является математической записью закона эквивалентов:
nэ (А) = nэ (В) = nэ (С) = nэ (D
_________________
*Примечание: приравнивать друг другу можно только одинаковые числа, однако некоторые студенты при решении задач на основании стехиометрии химической реакции записывают, например, для реакции H2SO4 + 2NaOH = Na2SO4 + 2H2O, что n(H2SO4) = 2n(NaOH), что неправильно.
Из закона эквивалентов следует, что если мы измерим число затраченных на реакцию частиц – эквивалентов эталона, следовательно, мы узнаем, сколько было частиц – эквивалентов определяемого компонента в пробе анализируемого вещества. Единицей измерения количества частиц эквивалентов компонента, как и реальных частиц,является 1 моль.
Число частиц эквивалентов, содержащихся в массе компонента А, m (А), рассчитывается по формуле:
nэ (A) = m (А) / Мэ (А), моль,
где Мэ (А) – молярная масса эквивалентов компонента А, г/моль
Молярной массой эквивалента компонента А,(Мэ(А)), называют массу 1 моль частиц эквивалентов этого компонента, равную произведению фактора эквивалентности на молярную массу компонента А, (М(А)):
Мэ(А)= fэкв(А) М(А), г/моль;
где fэкв(А) – фактор эквивалентности, безразмерная величина. Его находят из уравнения конкретной химической реакции (см. ПЗ 4).
Зная число частиц – эквивалентов определяемого компонента, мы можем рассчитать его массу:
m (А) = nэ (A) Мэ (А), г,
или мы можем рассчитать молярную концентрацию его эквивалентов СМэ (А) по формуле:
СМэ (А) = nэ (A) / Vм.к = m (А) / (Mэ (А) Vм.к), моль/дм;
С другой стороны, через значение молярной концентрации эквивалентов компонента можно выразить число частиц компонента:
nэ (A) = СМэ (А) Vм.к, моль;
и массу компонента
m(А) = СМэ(А)·Mэ(А) Vм.к, г
Однако не существует способов измерения числа частиц как структурных образований (конкретных наименований атомов, изотопов, ионов, молекул). Прореагировавшие массы компонентов А и В такжене могут быть измерены, так как они находятся в растворе, к тому же в виде каких-либо химических соединений. Фактически могут быть измерены только объемы растворов компонентов А и В, израсходованные на реакцию. Поэтому для практического использования вместо записи закона эквивалентов в виде nэ (А) = nэ (В) используют запись закона эквивалентов через измеряемые объемы растворов компонентов, участвующих в конкретной реакции:
СМэ (А) V (А)пип = СМэ (В) V (В)э,
Отсюда молярная концентрация эквивалентов определяемого компонента А, СМэ (А), может быть рассчитана как:
СМэ (А) = СМэ (В) V (В)э / V (А)пип; моль/дм3;
где СМэ (В) – молярная концентрация эквивалентов компонента В, моль/дм3, титранта, выполняющего роль рабочего эталона числа частиц, который готовится по специальной процедуре (см. 1.11.1.3) при проведении химического анализа методом титриметрии,
V (B)э. – эквивалентный объём титранта B, затраченный на реакцию с определяемым компонентом и измеренный по бюретке, см3, (аналитический сигнал);
V (А)пип – объём раствора, содержащего определяемый компонент А, отмеренный мерной пипеткой, см3.
Зная молярную концентрацию эквивалентов определяемого компонента А, можно рассчитать его массовую концентрацию Сm (A):
СМэ (А) = nэ (A) / Vм.к = m (А) / (Mэ (А) Vм.к) = Сm (A) / Mэ (А), моль/дм3;
отсюда
Сm (A) = СМэ (А) Mэ (А), г/дм3
Титриметрические методы подразделяют по типу реакции, лежащей в основе метода, на четыре больших группы. Из этих групп выделяют частные методы, связанные с применением того или иного титранта (табл.1.2 ).
Таблица 1.2 Классификация титриметрических методов анализа
| Тип реакции | Общее название метода | Титрант | Частное название метода |
| Взаимодействие кислот и оснований | Методы нейтрализации Кислотно-основное титрование | Сильная кислота (HCl, H2SO4). Сильное основание (KOH, NaOH) | Ацидиметрия. Алкалиметрия |
| Окисление-восстановление | Методы окисления - восстановления Окислительно-восстановительное титрование (редоксиметрия, оксидиметрия) | KMnO4 I2, Na2S2O3 K2Cr2O7 KBrO3 NH4VO3 (NH4)2[Ce(SO4)3] TiCl3, Ti2(SO4)3 | Перманганатометрия. Иодометрия. Бихроматометрия. Броматометрия. Ванадатометрия. Цериметрия. Титанометрия |
| Осаждение | Методы осаждения Осадительное титрование | AgNO3 NH4SCN Hg2(NO3)2 | Аргентометрия. Тиоцианометрия (Роданометрия). Меркурометрия |
| Комплексообразование | Методы комплексообразования Комплексометрическое титрование | NaF KCN ЭДТА | Фторометрия. Цианометрия. Комплексонометрия |
Объекты титриметрического анализа в экологии и определяемые компоненты –
ПНД Ф 14.1:2.206-04 Методика выполнения измерений массовой концентрации общего азотав природных и сточных водах титриметрическим методом
ПНД Ф 14.1:2:4.163-2000 (издание 2009 г.) Методика выполнения измерения массовых концентраций сульфит- и тиосульфат-ионов в пробах питьевых, природных и сточных вод титриметрическим методом.
РД 52.24.406-2006 Массовая концентрация сульфатов в водах. Методика выполнения измерений титриметрическим методом с хлоридом бария
РД 52.24.401-2006 Массовая концентрация сульфатов в водах. Методика выполнения измерений титриметрическим методом с нитратом свинца
ПНД Ф 14.1:2.108-97 (издание 2004 г.) Методика выполнения измерений содержаний сульфатов в пробах природных и очищенных сточных вод титрованием солью свинца в присутствии дитизона.
ПНД Ф 14.1:2.107-97 (издание 2004 г.) Методика выполнения измерений содержаний сульфатов в пробах природных и очищенных сточных вод титрованием солью бария в присутствии ортанилового К.
РД 52.24.407-2006 Массовая концентрация хлоридов в водах. Методика выполнения измерений титриметрическим методом с солью серебра
РД 52.24.402-2011 Массовая концентрация хлоридов в водах. Методика выполнения измерений меркуриметрическим методом
ПНД Ф 14.1:2:4.111-97 (издание 2011 г.) Методика измерений массовой концентрации хлорид-ионов в питьевых, поверхностных и сточных водах меркуриметрическим методом.
ПНД Ф 14.1:2.96-97 (издание 2004 г.) Методика выполнения измерений содержаний хлоридов в пробах при родных и очищенных сточных вод аргентометрическим методом.
ПНД Ф 16.2.2:2.3:3.28-02 (издание 2005 г.) Методика выполнения измерений содержания хлоридов в твердых и жидких отходах производства и потребления, осадках, шламах, активном иле, донных отложениях меркуриметрическим методом.
РД 52.24.524-2009 Массовая концентрация карбонатов в водах. Методика выполнения измерений титриметрическим методом
РД 52.24.515-2005 Массовая концентрация диоксида углерода в поверхностных водах суши. Методика выполнения измерений титриметрическим и расчетным методами
РД 52.24.493-2006 Массовая концентрация гидрокарбонатов и величина щелочности поверхностных вод суши и очищенных сточных вод. Методика выполнения измерений титриметрическим методом
ПНД Ф 14.2.99-97 (издание 2004 г.) Методика выполнения измерений содержаний гидрокарбонатов в пробах природных вод титриметрическим методом.
РД 52.24.403-2007 Методика выполнения измерений массовой концентрации кальция в водах титриметрическим методом с трилоном Б
ПНД Ф 14.1:2.95-97 (издание 2004 г.) Методика выполнения измерений содержаний кальция в пробах природных и очищенных сточных вод титриметрическим методом.
ПНД Ф 14.1:2:4.153-99 (издание 2012 г.) Методика измерения массовой концентрации трилона Б в питьевых, природных и сточных водах титриметрическим методом.
РД 52.24.419-2005 Массовая концентрация растворенного кислорода в водах Методика выполнения измерений иодометрическим методом
ПНД Ф 14.1:2.101-97 (издание 2004 г.) Методика выполнения измерений содержаний растворенного кислорода в пробах природных и очищенных сточных вод йодометрическим методом.
ПНД Ф 13.1.58-07 Методика выполнения измерений массовых концентраций хлора в промышленных выбросах в атмосферу титриметрическим методом.
ПНДФ 13.1.34-2002 (издание 2012 г.). Методика измерений массовых концентраций сероводорода и метилмеркаптана в промышленных выбросах предприятий методом потенциометрического аргентометрического титрования.
ПНД Ф 14.1:2:4.113-97 (издание 2011 г.) Методика измерений массовой концентрации “активного хлора” в питьевых, поверхностных и сточных водах титриметрическим методом.
РД 52.24.395-2007 Жесткость воды. Методика выполнения измерений титриметрическим методом с трилоном Б
ПНД Ф 14.1:2.98-97 (издание 2004 г.) Методика выполнения измерений жесткости в пробах природных и очищенных сточных вод титриметрическим методом.
ПНДФ 16.2.2:2.3:3.34-02 (издание 2005 г.) Методика выполнения измерений содержания кальция, магния, общей жесткости в твердых и жидких отходах производства и потребления, осадках, шламах, активном иле, донных отложениях комплексонометрическим методом.
ПНДФ 16.2.2:2.3:3.33-02 (издание 2005 г.) Методика выполнения измерений водородного показателя рН твердых и жидких отходов производства и потребления, осадков, шламов, активного ила, донных отложений потенциометрическим методом.
ПНД Ф 14.1:2:3:4.121-97 (издание 2004 г.) Методика выполнения измерений рН в водах потенциометрическим методом.
ПНД Ф 14.1:2:3:4.245-2007 (издание 2012 г.) Методика измерений свободной и общей щелочности в питьевых, поверхностных, подземных пресных и сточных водах титриметрическим методом.
ПНД Ф 14.1:2:3:4.242-2007 (издание 2011 г.). Методика измерений свободной и общей щелочности в питьевых, поверхностных, подземных пресных и сточных водах методом потенциометрического титрования.
ПНД Ф 16.2.2:2.3:3.31-02 (издание 2005 г.) Методика выполнения измерений щелочности в твердых и жидких отходах производства и потребления, осадках, шламах, активном иле, донных отложениях методом потенциометрического титрования.
ПНД Ф 13.1.52-06 (издание 2011 г.) Методика измерений массовой концентрации аэрозоля едких щелочей и карбонатов (суммарно) в газовых выбросах титриметрическим методом.
ПНД Ф 14.1:2:4.154-99 (издание 2012 г.) Методика измерений перманганатной окисляемости в пробах питьевых, природных и сточных вод титриметрическим методом.
Виды анализа – количественный элементный, функциональный (ионы разной степени окисления), молекулярный и структурно-групповой анализы; определение главных, сопутствующих и следовых компонентов; однокомпонентный анализ; макроанализ;
Метрологические характеристики титриметрических методов анализа:точный анализ, предел определения до 1 %; диапазон определяемого содержанияот n*10-5 до n*10 %; анализ жидкой фазы – поэтому используют подготовку проб: твердые пробы растворяют; не экспрессный анализ – несколько проб за смену.
Дата добавления: 2016-06-15; просмотров: 2274;










