Скорости прямой и обратной реакций. Равновесие. Константа равновесия. Термодинамический подход к рассмотрению равновесия.
Теоретически все химические реакции в большей или меньшей степени обратимы, то есть могут в одних и тех же условиях протекать в противоположных направлениях. Обратимость реакций была доказана на следующем опыте: сначала смесь газов H2 и O2 пропускали через раскалённую железную трубку; при этом образовывалось некоторое количество водяных паров по реакции 2H2+O2→t 2H2O (пар). При пропускании же водяных паров через ту же трубку наблюдалось частичное разложение воды на кислород и водород: 2H2O (пар) →t 2H2+O2. То есть реакция между водородом и кислородом обратима: 2H2+O2↔t 2H2O (пар).
Обратимые реакции широко распространены и используются в химической технологии.
Обратимые реакции никогда не доходят до конца, то есть до полного исчезновения исходных реагентов и превращения их в продукты реакции. Пределом протекания обратимых реакций при заданных условиях является достижение состояние химического равновесия.
Истинное химическое равновесие характеризуется следующими признаками: 1) в момент равновесия скорости прямой и обратной реакций одинаковы (равны), то есть: Uпрям=Uобр (1), или k1cAcB=k2cCcD (2) 2) химическое равновесие подвижно 3) к одному и тому же состоянию химического равновесия можно подойти с двух сторон: A+B K1↔K2 C+D (3) 4) в момент достижения равновесия запас свободной энергии системы является минимальным, а энтропия – максимальной.
Учитывая (1), (2) и (3) для равновесного состояния отношение двух постоянных k1 и k2 будет: k1/k2=cCcD/cAcB=k – величина, называемая константой химического равновесия. То есть для химического равновесия отношение произведения равновесных (мольных) концентраций продуктов к произведению равновесных (мольных) концентраций исходных веществ есть величина постоянная при постоянной температуре. Она показывает во сколько раз k1>k2 и зависит от природы реагирующих веществ (так как в формуле отношение концентраций). Для веществ в газообразном состоянии удобно использовать парциальные давления: kp=pCpD/pApB.
Под термином химическое сродство понимают способность веществ вступать в химическое взаимодействие друг с другом. Сродство веществ друг с другом могут характеризовать изменение термодинамических потенциалов ∆F и ∆G.
Для термодинамически обратимой реакции общего вида n1A+n2B↔n3C+n4D изменение термодинамических потенциалов и химическое сродство при T=const подсчитывают, используя соотношения, выведенные Вант-Гоффом и названные уравнениями изотермы химической реакции:
∆FT=RT(ln 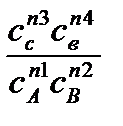 -lnkC) (4); ∆GT=RT(ln
-lnkC) (4); ∆GT=RT(ln 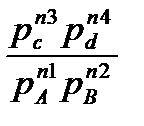 -lnkP) (5), где k – константы равновесия при температуре Т, с – концентрации, реагирующих веществ, n – их число молей, p – парциальные давления взаимодействующих газов. По этим уравнениям можно определить, в каком направлении, и до какого состояния равновесия может протекать реакция в нужном направлении. Если ∆FT и ∆GT имеют знак “-”, то реакция может протекать только в прямом направлении, и наоборот, если ∆FT=0 и ∆GT=0, то система достигла равновесного состояния. При концентрациях и давлениях равных единице, получим ∆F0T=-RTlnkC; или
-lnkP) (5), где k – константы равновесия при температуре Т, с – концентрации, реагирующих веществ, n – их число молей, p – парциальные давления взаимодействующих газов. По этим уравнениям можно определить, в каком направлении, и до какого состояния равновесия может протекать реакция в нужном направлении. Если ∆FT и ∆GT имеют знак “-”, то реакция может протекать только в прямом направлении, и наоборот, если ∆FT=0 и ∆GT=0, то система достигла равновесного состояния. При концентрациях и давлениях равных единице, получим ∆F0T=-RTlnkC; или
-∆F0T=2,303RTlgkC. Убыль величины изобарного потенциала рассчитывают по формуле: ∆G0T=2,303∆nRT lg1,0133*105-2,303RTlgkP (6), где ∆n – изменение числа молей газообразных веществ в реакции, равное алгебраической сумме: ∆n =n3+n4-n1-n2. По уравнениям (5 и 6), определив предварительно ∆GT (по таблице) можно определить константы равновесия kP и kC.
Лекция 11.
Смещение равновесия. Принцип Ле Шателье. Влияние температуры и давления на положение равновесия (экзо- и эндо- термические реакции, реакции с изменением объёма и неизменным объёмом). Влияние температуры на скорость обратимой реакции. Влияние температуры на степень превращения.
Используя свойство равновесных систем “подвижность” воздействием различных внешних факторов можно добиться смещения равновесия в нужном направлении и в достаточной степени для обеспечения хорошего выхода продуктов. Смещение (сдвиг) химического равновесия можно осуществлять изменением концентрации (давления) реагирующих веществ и температуры. Катализаторы не смещают химическое равновесие.
Принцип Ле Шателье: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя температуру, давление или концентрацию реагирующих веществ, то равновесие смещается в том направлении, при котором эффект произведённого воздействия уменьшается.
Влияние концентрации или парциального давления определяется в соответствии с формулой константы скорости (равновесия): kC=cCO2cH2/cCOcH2O,например, для реакции CO+H2O↔CO2+H2 (1).
Если увеличить концентрации исходных реагентов, то увеличится и выход продуктов реакции. Если из смеси продуктов увести некоторое количество CO2 (связывая газ щелочью), то понижение концентрации CO2 приведёт к усилению прямой реакции. То есть для смещения равновесия слева направо необходимо увеличить концентрации исходных веществ (парциальные давления) или же уменьшить концентрацию (парциальное давление) одного из продуктов.
Рассмотрим влияние температуры и давления на примере обратимой реакции синтеза аммиака: N2+3H2↔2NH3+92 кДж (2). В соответствии с принципом Ле Шателье повышение температуры должно усиливать процесс, связанный с поглощением тепла, то есть обратную реакцию (распад аммиака), которая идёт с поглощением Q=92кДж. Прямую реакцию надо проводить с непрерывным отводом тепла, то есть с понижением температуры.
Давление смещает равновесие только в реакциях между газами, сопровождающихся изменением числа молей. Давление не оказывает никакого влияния на реакцию по уравнению (1). И, наоборот, на реакцию (2) давление оказывает влияние. Повышение давления должно сместить равновесие в сторону уменьшения числа молей в реакции, то есть в направлении увеличения выхода продукта. N2+3H2 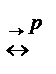 2NH3
2NH3
Влияние объёма обратно пропорционально давлению (pV=const). Если объём и давление постоянны, то положение равновесия остаётся неизменным.
Ранее (тема 2) мы рассматривали использование термодинамических методов для анализа реакций. Рассмотрим влияние температуры на константу равновесия.
Для малого изменения температуры ∆Т можно получить: ∆A/Q=∆T/T (из формул КПД). Подставим в первый закон термодинамики: ∆U+A=T*dA/dT (1), это уравнение называется уравнением Гиббса-Гельмгольца. Для изохорно-изотермического химического процесса: AV=RTlnkC (2), тогда (2) преобразуется после дифференцирования: dAV/dT=RlnkC+RT*dlnkC/dT. Подставляя в (1), получим: ∆U+ RTlnkC= RTlnkC+RT2*dlnkC/dT или ∆U= RT2*dlnkC/dT, учитывая ∆U=-QV, получим уравнение Вант-Гоффа (1884г): dlnkC/dT=-QV/ RT2 (3). Это уравнение называется уравнением изохоры химической реакции и применяется для процессов, протекающих при постоянном объёме. Для процессов при постоянном давлении можно получить аналогичное уравнение зависимости kP от температуры: dlnkP/dT=-QP/ RT2 (4) – уравнение изобары реакции. Применим уравнение (4) для реакции синтеза аммиака N2+3H2↔2NH3+92кДж. Так как тепловой эффект положителен (для прямой реакции), тогда dlnkP/dT<0, то есть константа kP данной реакции уменьшается с ростом температуры: kP=pCn3 /pAn1 *pBn2=p2NH3 /pN2 *p3H2. Уменьшение kP с ростом температуры связано с понижением парциального давления NH3 в реакционной смеси. Следовательно, с увеличением температуры усиливается обратная реакция (распад NH3) и равновесие смещается влево.
Для определения влияния температуры на смещение равновесия в ту или иную сторону, то есть на степень превращения исходных веществ в продукт реакции используют уравнения (3) и (4). Если эти уравнения продифференцировать, то при небольшом интервале температур можно получить формулы для подсчёта констант равновесия (kC2, kC1) при заданной температуре T2, если известны их значения при T1, тепловые эффекты QV и QP:
2,303lg*kC2/kC1= QV/R * (1/T2-1/T1); 2,303lg*kP2/kP1=QP/R * (1/T2- 1/T1).
Лекция 12.
Дата добавления: 2022-05-27; просмотров: 207;











