Основное уравнение молекулярно – кинетической теории идеальных газов и его следствия.
Рассмотрим одноатомный идеальный газ, занимающий некоторый объем V. Пусть число столкновений между молекулами пренебрежимо мало по сравнению с числом столкновений со стенками сосуда. Тогда давление газа, оказываемое им на стенку сосуда, будет равно:
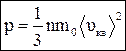 ,
,
где n – концентрация молекул, m0 – масса одной молекулы, 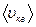 - среднеквадратичная скорость молекул.
- среднеквадратичная скорость молекул.
Приведенное выше уравнение и есть основное уравнение молекулярно-кинетической теории идеальных газов. Поскольку m0‹υкв›2/2 – это средняя энергия поступательного движения молекулы ‹ εпост›, уравнение можно переписать в виде :
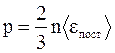
Следствия:
1. Учитывая, что концентрация n = N/V, получаем
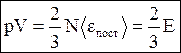
где E – суммарная кинетическая энергия поступательного движения всех молекул газа.
2. Энергия молекул Е в веществе пропорциональна количеству вещества в системе и температуре.
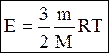
Средняя кинетическая энергия хаотического поступательного движения молекул идеального газа пропорциональна его абсолютной температуре и зависит только от нее, т.е. температура есть количественная мера энергии теплового движения молекул.
Дата добавления: 2022-05-27; просмотров: 87;










