ПРИМЕРЫ РЕШЕНИЯ ТИПОВЫХ ЗАДАЧ
Пример 1. Определить тепловой эффект процесса термического разложения хлорида аммония и составить термохимическое уравнение реакции.
Решение. Реакция выражается уравнением NH4Cl(к) → NH3(г) + + HCl(г). Согласно следствию из закона Гесса
∆H0298 (реакции) = ∑(n'∆fH0298)прод− ∑(n''∆fH0298)исх =
= ∆H0298(NH3)(г) + ∆H0298(HCl)(г) - ∆H0298(NH4Cl)(к).
Используя справочные данные значений ∆H0298веществ, получаем
∆H0298(реакции) = (-46,2 – 92,2) – (-314,2) = + 175 кДж.
Таким образом, термическое разложение NH4Cl является эндотермической реакцией. Термохимическое уравнение имеет вид
NH4Cl(к) → NH3(г) + HCl(г) - 175 кДж.
Пример 2. Тепловой эффект реакции С(т) + ½О2(г) = СО(г) при постоянном объеме и температуре 20º С равен 108,9 кДж. Определить тепловой эффект реакции при постоянном давлении.
Решение. Соотношение между тепловым эффектом при
V = const (QV =∆U) и тепловым эффектом при р = const (Qр =∆H) выражается уравнением ∆H = ∆U + р∆V. Определяем изменение числа молей газов в ходе реакции:
∆n = 1 - ½ = ½ (моль).
Учитывая значение Т = 293 К, R = 8,314 Дж/моль·К, а также единицы измерения величин, получаем для теплового эффекта реакции при р = const
∆H = ∆U + ∆n R T = - 108,9+1/2·8,314 /103·293 = - 107,68 кДж.
Пример 3. Возможен ли процесс получения металлического железа из оксида Fe2O3 действием водорода при стандартных условиях Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(ж)? Как скажется повышение температуры на вероятности протекания этой реакции?
Решение. Для ответа на первый вопрос задачи необходимо
рассчитать изменение свободной энергии Гиббса ∆G0298 для
рассматриваемой реакции, используя уравнение ∆GT(реакции) =
= ∆HT (реакции) − T∆SТ(реакции). Значения ∆H0298 и ∆S0298 для всех веществ, участвующих в реакции, приводятся в задании или берутся из таблиц термодинамических величин.
По следствию из закона Гесса ∆H0298(реакции) =
= ∑(n'∆fH0298)прод − ∑(n''∆fH0298)исх,найдем
∆H0298(реакции) = 3∆H0298 (H2O)(ж) – ∆H0298(Fe2O3)(к) = 3 (-285,8) – (-822,0)=
= - 857,4 + 822,0 = - 35,4 кДж.
Значение ∆H0298 (H2)(г) = 0 и ∆H0298 (Fe)(к) = 0.
Согласно
∆S0298(реакции)= ∑(n'S0298)прод − ∑(n''S0298)исх,
найдем
∆S0298(реакц) =[3S0298(H2O)(ж) + 2S0298(Fe)(к)] - [S0298 (Fe2O3)(к) +
+ 3S0298(H2)(г)] = (3·70,1 + 2·2,27) - (87,0 + 3·130,5) = - 213,8 Дж/К.
По найденным данным вычисляем
∆G0298 = ∆H0298 − T∆S0298 = - 35,4 + 213,8·10-3·298 = 28,34 кДж.
Положительное значение ∆G указывает на невозможность восстановления Fe2O3 водородом при стандартных условиях.
Ответ на второй вопрос задачи определяется знаком ∆S. Рас-
чет показал, что ∆S0298реакции < 0, следовательно, в уравнении ∆G = ∆H − T∆S величина −T∆S > 0. Повышение температуры приводит к увеличению значения ∆G, а значит, не будет способствовать протеканию реакции в прямом направлении.
Пример 4. Определить стандартный тепловой эффект реакции, если известны теплоты образования веществ.
1. Реакция образования сульфата алюминия из оксида алюминия и триоксида серы:
Al2O3 (кр) + 3SO3 (газ) = Al2(SO4)3 (кр).
| Вещество | Al2O3 (кр) | SO3 (газ) | Al2(SO4)3 (кр) |
| DfН0298, кДж/моль | –1676,1 | –395,9 | –3442,8 |
Решение. Тепловой эффект реакции определяем по первому следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298=(1×DfН0Al2(SO4)3)–(1×DfН0Al2O3 + 3×DfН0SO3 ) =
=1 (–3442,8) – [1 (–1676,1) + 3(–395,9)] = –579 [кДж].
2. Реакция взаимодействия метана и диоксида углерода с образованием оксида углерода и водорода:
CH4 (газ) + CO2 (газ) = 2 CO (газ) + 2H2 (газ).
| Вещество | CH4 (газ) | CO2 (газ) | CO (газ) | H2 (газ) |
| DfН0298, кДж/моль | –74,85 | –393,51 | –110,5 |
Решение. Тепловой эффект реакции определяем по следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298=(2×DfН0CO + 2×DfН0H2)–(1 DfН0CH4 + 1 DfН0CO2) =
=[2 (–110,5) + 2×0] – [1 (–74,85) + 1 (–393,51)] = 247,36 [кДж].
Пример 5. Определить стандартный тепловой эффект реакции, если известны стандартные теплоты сгорания веществ. Реакция взаимодействия уксусной кислоты и этилового спирта с образованием сложного эфира – этилацетата:
CH3COOH(ж) + C2H5OH(ж) = CH3COOC2H5(ж) + H2О(ж).
| Вещество | CH3COOH(ж) | C2H5OH(ж) | CH3COOC2H5(ж) | H2О(ж) |
| DcН0298, кДж/моль | –873,79 | –1366,91 | –2254,21 |
Решение. Тепловой эффект реакции определяем по следствию из закона Гесса. В соответствии с уравнением реакции
DrН0298 =(1 DcН0ук + 1 DcН0эс)–(1 DcН0эа + 1 DcН0H2O) =
= [1 (–873,79) +1 (–1366,91)] – [1 (–2254,21)+ 1×0] = 13,51[кДж].
Пример 6. Определить изменение энтропии в стандартных условиях при протекании реакции:
CH4 (газ) + CO2 (газ) = 2CO (газ) + 2H2 (газ).
| Вещество | CH4 (газ) | CO2 (газ) | CO (газ) | 2H2 (газ) |
| S0298, Дж/моль×К | 186,27 | 213,66 | 197,55 | 130,52 |
Решение. Dr S0298=(åni S0298i)продукты–(åni iS0298i)исх. вещества,
Dr S0298 = (2×197,55 + 2×130,52) – (1×186,27 + 1×213,66) = 256,21 [Дж/K].
Пример 7.Определить направление самопроизвольного протекания реакции взаимодействия оксида кальция и воды с образованием дигидроксида кальция в стандартных условиях:
CaO(кр) + H2O(ж) = Ca(OH)2(кр).
| Вещество | CaO(кр) | H2O(ж) | Ca(OH)2(кр) |
| DfG0298, кДж/моль | –603,46 | –237,23 | –897,52 |
| DfH0298, кДж/моль | –635,09 | –285,83 | –985,12 |
| S0298, Дж/моль×К | 38,07 | 69,95 | 83,39 |
Решение. Направление самопроизвольного протекания реакции определяется по изменению энергии Гиббса (DrG0 < 0).
1. Зная величины DfG0 для реагентов, можно непосредственно вычислить изменение энергии Гиббса в ходе реакции:
Dr G0298 = (å ni DfG0i)прод – (å ni DfG0i)исх. вещества,
Dr G0298 = (1(–897,52)) – [1(–603,46) + 1(–237,23)] = –56,83 (кДж).
Следовательно, данная реакция в стандартных условиях может самопроизвольно протекать в прямом направлении.
2. Изменение энергии Гиббса можно также вычислить по тепловому эффекту и энтропии реакции:
Dr G0298 = Dr Н0298 –298 Dr S 0298,
Dr Н0298 = (å ni DfН0298i)прод – (å ni DfН0298i)исх. вещества,
Dr S0298 = (åni S0298i)прод – (åni S0298i) исх. вещества,
Dr Н0298 = (1(–985,12)) – (1(–635,09) + 1(–285,83)) = –64,2 (кДж),
Dr S0298 = (1×83,39) – (1×38,07 + 1×69,95) = –24,63 (Дж/K),
Dr G0298 = –64,2 – 298(–24,63×10-3) = –56,86 (кДж).
Результаты первого и второго расчетов, естественно, совпадают (с учетом погрешности).
Пример 8. Определить возможность самопроизвольного окисления ртути кислородом в стандартных условиях (прямая реакция) и температуру, при которой возможен самопроизвольный распад окиси ртути на ртуть и кислород (обратная реакция):
Hg(ж) + ½ O2(газ) = HgO(кр).
| Вещество | Hg(ж) | O2(газ) | HgO(кр) |
| DfH0298, кДж/моль | –90,88 | ||
| S0298, Дж/моль×К | 75,90 | 205,04 | 70,29 |
Решение. Изменение энергии Гиббса в ходе реакции вычисляют по тепловому эффекту и энтропии реакции при Т=298 К:
Dr G0(Т) » Dr Н0298 – Т Dr S0298,
Dr Н0298 = (å ni DfН0298i)прод – (å ni DfН0298i)исх. вещества,
Dr S0298 = (åni S0298i)прод – (åni S0298i) исх. вещества,
Dr Н0298 = 1(–90,88) – (1×0 +½×0) = –90,88 кДж/моль,
Dr S0298 = 1×70,29 – (1×75,90 +½×205,04) = –108,13 Дж/моль×K,
Dr G0298 = –90,88 – 298(–108,13×10-3) = –58,65 кДж/моль.
Поскольку DrG0298 < 0, то окисление ртути в стандартных условиях возможно.
Самопроизвольное разложение окиси ртути на кислород и ртуть возможно, если для обратной реакции  . Поскольку
. Поскольку 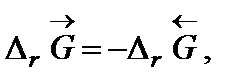 то обратная реакция по отношению к окислению возможна, если DrG0(Т) » Dr Н0 – Т Dr S 0 > 0, что выполняется при температуре выше
то обратная реакция по отношению к окислению возможна, если DrG0(Т) » Dr Н0 – Т Dr S 0 > 0, что выполняется при температуре выше 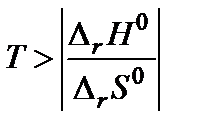 = 840,47 К.
= 840,47 К.
Дата добавления: 2019-09-30; просмотров: 251;










