Факторы обнаружения
ХИМИЧЕСКИЕ ПРИМЕСИ
Примесь определяется как любой тип материала (твердого, жидкого или газообразного), оказывающего отрицательное воздействие на физические или химические характеристики бурового раствора. Общей примесью для всех буровых растворов является твердая фаза с низким удельным весом. Твердые частицы могут попадать в систему во время бурения или могут являться результатом чрезмерной обработки промышленными глинами, что чаще всего происходит при попытке довести до максимума содержание бентонита (природный глинистый минерал, гидроалюмосиликат калия или натрия KAl2[(Si3Al)O10(OH)2] в растворе в условиях несоответствующей технологии контроля за содержанием твердых частиц или состоянием ствола.
Общие химические примеси:
1. Сульфатные: ангидрит (CaSO4) или гипс (CaSO4·H2O)
2. Цементные: сложные системы, в состав которых входят следующие четыре оксида: СаО, SiO2, Al2O3, Fe2O3
3. Карбонатные: кальцит Ca(CO3), доломит СaMg(CO3)2, арагонит Ca(CO3), анкерит Ca(Fe,Mg)(CO3)2
4. Солевые: каменная соль (NaCl с достаточно частой примесью KCl, CaCl2 и MgCl2.), добавляемая вода, морская вода, связанная вода, KCl, CaCl2 и MgCl2.
5. Кислые газы: CO2, HCl, Н2S
За исключением кислых газов эти примеси непосредственно связаны с реакциями ионного обмена с глинами. Реакция ионного обмена происходит при реакции натриевого бентонита со средой с высоким содержанием ионов других металлов. В результате происходит химическое превращение бентонита в менее текучую глину. А это в свою очередь влияет на адсорбированную воду, форму и размер частиц, и в конечном счете на реологию и контроль за водоотдачей. Серьезность такого положения послужила причиной разработки циркуляционной системы, допускающей использование этих примесей.
Гипсовые примеси
Ангидрит CaSO4 или гипс CaSO4·H2O по химическому составу почти идентичны. Гипс более растворим, ангидрит. Роль этой примеси в основном зависит от объема разбуренной породы. Загрязнение можно снизить при осаждении ионов кальция или преобразованием в систему с кальциевым основанием. Известковая и кальциевая с гипсовым основанием системы могут выдерживать загрязнение ангидритом или гипсом.
Начальное влияние этого типа примеси на циркуляционную систему бентонитового типа выражается в высокой вязкости, в высоком статистическом напряжении сдвига и повышенной водоотдачи. Предел этих свойств является функцией концентрации химических стабилизаторов в буровом растворе:
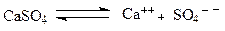
Растворимость CaSO4 регулируется рН, минерализацией и температурой. Повышение рН и температуры снижает растворимость гипса, а увеличение хлорида в глинистом растворе увеличивает растворимость гипса. Приведенная реакция обратима и может достичь некоторого уровня равновесия с другими свойствами бурового раствора.
Факторы обнаружения
Первым признаком загрязнения гипсом является увеличение вязкости и прогрессирующая прочность геля. Но поскольку это и первый признак других типов загрязнения, то необходимы испытания. Наиболее надежный индикатор – снижение рН. Качественный анализ должен показать увеличение ионов сульфата. Качественное определение сульфат-ионов основано на реакции осаждения сульфат-ионов раствором хлорида бария:
SO42 - + Ba2 + = BaSO4
Методика определения. К 10 мл пробы раствора добавляют 2-3 капли 0,1 н раствора соляной кислоты и 0,5 мл 10%-ного раствора BaCl2. При большом содержании сульфатов выпадает белый осадок.
–рН раствора нужно поддерживать между 9,5 и 10,5 с помощью каустической соды (NaOH) или КОН. Этим подавляется растворимость CaSO4.
–Обработка безводной кальцинированной содой Na2CO3 наиболее эффективна, и повышает также и рН. Поэтому требования к каустической соде снижаются растворением безводной кальцинированной соды в воде:
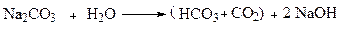 (рН < 11,3)
(рН < 11,3)
Если присутствуют ионы кальция, они осаждаются в виде нерастворимого СаСО3:
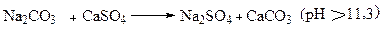
Подобная реакция происходит, когда бикарбонат натрия используется как осадитель. В результате реакции образуется СаНСО3, хорошо растворимый (зависящий от рН). С добавлением каустической соды (для поддержания рН >9,7) ион бикарбоната превращается в карбонат. Затем он реагирует с сульфатом кальция для осаждения в карбонат кальция. Однако, в промежуточный период в течение которого присутствует ион бикарбоната, может создать проблемы, включая и загрязнение. Поэтому обезвоженная кальцинированная сода предпочтительней.
Осадить или изолировать катион кальция можно с помощью фосфатов:


 3CaSO4 + 2Na3PO4 Ca3(PO4)2 + 3Na2SO4
3CaSO4 + 2Na3PO4 Ca3(PO4)2 + 3Na2SO4
Цементная примесь
Вероятность разбуривания цемента существует во всех скважинах. Цемент не является примесью при использовании чистой воды, соленой воды, растворов на кальциевой или нефтяной основе или в случае хорошей обработки цемента. Наиболее широко используется бентонитовая система с низким рН. В этом случае цемент очень вреден для раствора. Серьезность загрязнения зависит от предварительной химической обработки, типа щлама, объема разбуриваемого цемента и степени его выдержки в скважине.
Начальное воздействие цементной примеси – высокая вязкость, очнь прочный гель и невозможность регулирования водоотдачи. Это результат адсорбции иона кальция глинистыми частицами, вызывающее образование хлопьев и увеличение рН. Цемент – это сложный силикат извести или просто Са(ОН)2. При растворении в воде или водной фазе бурового раствора образуются ионы гидроксила:
 Са(ОН)2 Са++ + 2ОН- (рН <11,7)
Са(ОН)2 Са++ + 2ОН- (рН <11,7)
Растворимость извести уменьшается по мере увеличения рН раствора. При рН выше 11,7 известь выпадает в осадок. Если объем разбуриваемого цемента относительно невелик, проблем нет.
При разбуривании большого объема цемента следует учитывать следующие моменты:
1. Если бурение находится на промежуточной или конечной стадии, для разбуривания цемента лучше использовать воду, а не буровой раствор.
2. На стадии заканчивания требуется время на правильную обработку цементных примесей для недопущения желирования.
Влияние рН на растворимость цемента затрудняет обработку осадителями, если нет времени на разбавление и снижение рН.
Дата добавления: 2016-11-26; просмотров: 1033;










