ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ К ГРЕМУЧЕЙ РТУТИ
1. Гремучая ртуть должна иметь вид мелкокристаллического порошка белого цвета. Допускается слегка сероваре окрашивание, но ни в коем случае не допускается зеленое или желтое.

Гремучая ртуть должна быть промыта до нейтральной реакции и не содержать видимых на-глаз примесей. 2. Допускаются следующие примеси:
3. Содержание фульмината должно быть не менее:
для I сорта ........ 99%
» II » ........ 98%
4. Температура вспышки обоих сортов должна быть не ниже 150°.
По Касту и Метцу, допускается содержание в гремучей ртути не более 2% примесей, нерастворимого в пиридине или в водном растворе цианистого калия остатка не должно быть более 2%, металлической ртути — не свыше 1%, а щавелевокислых солей и хлоридов не должно содержаться вовсе. Цвет технической гремучей ртути допускается от желтоватого до темнобурого.
Для качественного определения гремучей ртути может служить ряд реакций.
По Лангхансу, при прибавлении к раствору гремучей ртути в пиридине раствора 1 мл брома в 100 мл хлороформа появляется красно-желтое окрашивание.
При смешивании 2%-ного раствора нитрита натрия с раствором гремучей ртути в цианиде калия после подкисления разбавленной соляной кислотой появляется постоянное окрашивание от сине-зеленого до изумрудного цвета.
Если встряхивать гремучую ртуть с несколькими миллилитрами раствора 5—6 мл брома и 10 г едкого кали в 100 мл воды, то получается небесно-голубое или васильковое окрашивание от образующет гося при этом бромнитрозометана.
При обливании фенилгидразином гремучая ртуть окрашивается сначала в оливково-зеленый, затем в серый и, наконец, в красно-бурый цвет с выделением ртути. Если после нескольких часов разбавить фенилгидразин спиртом и смешать с разбавленной серной кислотой, то получается красно-фиолетовая окраска. Реакция идет быстрее при нагревании, причем последнее можно безопасно производить и на голом огне, так как при обливании гремучей ртути фенилгидразином и встряхивании вся гремучая ртуть растворяется уже на холоду.
Для определения гремучей ртути в составе берут 0,3 г последнего, обливают 0,5 мл фенилгидразина, встряхивают и нагревают. Когда начинается бурная реакция с изменением цвета раствора и выделением азота, пробирку отставляют от пламени. По окончании реакции содержимое пробирки разбавляют спиртом, фильтруют и подкисляют серной кислотой, в результате чего появляется резкое красно-фиолетовое окрашивание. Эта реакция настолько чувствительна, что даже отдельный кристалл гремучей ртути, будучи смочен двумя-тремя каплями фенилгидразина, дает соответствующую окраску. Она обнаруживает гремучую ртуть и в растворах, но не во всех. Так, реакцию можно наблюдать при действии фенилгидразином на раствор гремучей ртути в пиридине, на свежеприготовленные растворы ее в тиосульфате и соляной кислоте, однако, аммиачный раствор этой реакции не дает.
Окраска раствора, невидимому, обусловливается появлением парарозанилина: .
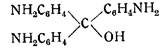
Качественный и количественный анализ гремучей ртути сводится к определению в ней фульмината ртути и тех вредных и ненужных примесей, которые обычно ее сопровождают.
1. Определение кислотности производится перед пуском гремучей ртути на сушку. Синюю лакмусовую бумажку прижимают к влажному продукту или вносят ее в промывные воды. В том и другом случае не должно происходить изменения цвета бумажки.
2. Определение влажност и, В тарированный стаканчик помещают точную навеску гремучей ртути около 1 г. Стаканчик с навеской вместе с другим стаканчиком с металлической ртутью сушат в эксикаторе при температуре 40° и вакууме не менее 15 мм в течение 5—6 час.; вследствие испарения металлической ртути атмосфера в эксикаторе становится насыщенной парами ртути, что предохраняет от улетучивания металлической ртути из взятой навески.
Эксикатор снабжен электрической плиткой с закрытой нагревательной обмоткой. Степень нагревания регулируют реостатом. Для выкачивания воздуха эксикатор снабжен тубусом. Перед эвакуацией воздуха эксикатор предварительно нагревают до 40°. Первый раз взвешивают через 4 часа. По истечении еще одного часа взвешивают второй раз. Если второе взвешивание не покажет уменьшения веса, то можно считать сушку законченной; в противном случае сушку продолжают до постоянного веса. Разница в весе стаканчика с гремучей ртутью до и после сушки дает количество влаги, содержащейся в исследуемом продукте.
Проще и достаточно точно можно определить влажность высушиванием гремучей ртути в термостате при 45° до постоянного веса в присутствии металлической ртути.
3. Определение нерастворимого остатка. Сперва подготовляют фильтр, промывая его последовательно насыщенным раствором аммиака в воде (и = 0,885), дистиллированной водой, 96%-ным спиртом и безводным эфиром. Для высушивания фильтр помещают на сутки в эксикатор, в котором находится стаканчик с крепкой серной кислотой для поглощения паров эфира. После этого фильтр взвешивают и сохраняют в банке с притертой пробкой.
Для определения берут такое количество влажной гремучей ртути, чтобы после сушки получилось 0,7—1 г сухой, и сушат одни сутки в эксикаторе над хлористым кальцием вместе со стаканчиком с металлической ртутью. Высушенную гремучую ртуть растворяют в 30 мл насыщенного раствора аммиака в воде (d = 0,885) и быстро фильтруют. Остаток на фильтре промывают 30 мл того же аммиака, затем 30 мл аммиака, наполовину разбавленного водой, затем дистиллированной водой до удаления аммиачного запаха, затем 96%-ным спиртом и, наконец, безводным эфиром. Фильтр сушат в присутствии металлической ртути и крепкой серной кислоты в эксикаторе в продолжение суток и взвешивают. Вместо бумажного фильтра можно пользоваться фильтром Шотта; при этом устраняется необходимость длительной подготовки фильтра. Разница в весе фильтра показывает количество нерастворимого остатка.
4. Определение общего содержания металлической ртутии ее закисных соединений можно производить, пользуясь нерастворимым остатком, полученным при предыдущем анализе, или, пользуясь навеской гремучей ртути, оставшейся после определения влажности. В первом случае нерастворимый остаток в тигле Шотта помещают в термостат, выдерживают при температуре 150—160° в течение часа и взвешивают. Во втором случае стаканчик с навеской гремучей ртути после сушки вновь помещают в тот же эксикатор, предварительно удалив из него стаканчик с металлической ртутью, поднимают температуру до 60° и осторожно выкачивают воздух. Эвакуацию воздуха повторяют через каждый час. По истечении 4 час. пробу взвешивают и спустя 2 часа взвешивают повторно. Если в этом случае вес не изменяется, то по разности вычисляют процентное содержание металлической ртути и ее закисных соединений; если будет обнаружена убыль веса, то высушивание продолжают еще 2 часа.
5. Определение щавелевойкислоты можно производить, пользуясь новой навеской или фильтратом, оставшимся при производстве анализа на нерастворимый остаток.
В первом случае навеску 0,7—1 г гремучей ртути в стакане емкостью 250 мл заливают 150 мл дистиллированной воды и обрабатывают в течение 30—40 мин. сероводородом. Затем, не прерывая пропускания сероводорода, к раствору прибавляют 10—15 мл соляной кислоты (уд. веса 1,12), стакан помещают на кипящую водяную баню и нагревают до тех пор, пока осадок не станет хорошо отстоявшимся, а раствор прозрачным. Полученную таким образом хорошо фильтрующуюся сернистую ртуть отфильтровывают и промывают сероводородной водой, слабо подкисленной соляной кислотой. Из фильтрата кипячением удаляют сероводород. После удаления сероводорода к раствору прибавляют несколько капель перекиси водорода и аммиака до нейтральной реакции. Нейтральный раствор подкисляют несколькими каплями уксусной кислоты, нагревают до кипения и осаждают щавелевую кислоту 10 мл раствора хлористого кальция (10%). Выпавший щавелевокислый кальций отстаивают в течение 12 час., после чего отфильтровывают через беззольный фильтр, промывают горячей водой, сушат, сжигают фильтр над фарфоровым тиглем, прокаливают последний и взвешивают в виде окиси кальция. Формула расчета:
%С2Н2О4 = (160,71*а)/р
где р — навеска гремучей ртути;
а — вес окиси кальция.
Во втором случае к аммиачному раствору, получившемуся при определении нерастворимого остатка, приливают 10—15 мл сернистого аммония и выпавшую сернистую ртуть отфильтровывают. Фильтр нагревают на водяной бане до удаления свободного аммиака (от 30 мин. до 1 часа). После этого прибавляют 3—5 мл крепкой соляной кислоты и выпаривают на водяной бане до удаления запаха сероводорода, прибавляют аммиак до остающегося запаха и затем вновь удаляют кипячением на бане. Выпавшую при этом серу отфильтровывают и промывают горячей водой. В горячий фильтрат с промывными водами приливают 10 мл 10%-ного фильтрованного раствора хлористого кальция; выпавший при этом щавелевокислый кальций отстаивают в течение 12—18 час. в теплом месте (около 25°), после чего переносят на фильтр, промывают водой до полного удаления иона хлора (проверка нитратом серебра), осадок на фильтре растворяют в 100/0-ной серной кислоте, кипятят и титруют 0.1 N раствором марганцовокислого калия.
6. Определение кремнезема и стекла. 2 г гремучей ртути растворяют в водном растворе аммиака. Раствор сливают, а остаток смывают на фильтр и промывают 10—15% NH4OH и водой. Фильтр подсушивают и остаток рассматривают под микроскопом. При обнаружении стекловидных веществ остаток обрабатывают царской водкой и вновь рассматривают под микроскопом.
7. Определение содержания фульмината ртути основано на разложении гремучей ртути водными растворами некоторых солей и образовании при этом определенного количества щелочи. Так, водные растворы тиосульфата натрия и йодистого калия при растворении в них гремучей ртути дают щелочные растворы с содержанием четырех ионов ОН на 1 моль гремучей ртути. При пользовании в качестве растворителя тиосульфатом натрия анализ можно сделать алкалиметрическим методом, оттитровывая образующуюся щелочь кислотой, или иодометрическим методом, оттитровывая не вступивший в реакцию с гремучей ртутью тиосульфат натрия раствором иода в йодистом калии.
Алкалиметрическийметод был предложен Броунс-доном в 1904 г. и несколько уточнен в 1912 г. Р. Филиппом. При пользовании этим методом требуется соблюдение строгого количественного соотношения применяемых при анализе реактивов и точного времени производства анализа. Объясняется это тем, что в результате реакции гремучей ртути с тиосульфатом натрия получается нестойкий раствор, в котором щелочность изменяется в зависимости от количества тиосульфата натрия и времени растворения и титрования. При растворении гремучей ртути в водном растворе тиосульфата натрия образуется растворимое комплексное соединение ртути по уравнению:
Hg (ONC)2 + 2Na2S203 -> [Hg(S2O3)2] Na2 + 2NaONC
Фульминат натрия, как соль слабой кислоты и сильного основания, гидролитически распадается:
2NaONC + 2Н2О -> 2NaOH + 2HONC
Таким образом в результате реакции тиосульфата натрия с гремучей ртутью образуются только 2 иона НО' на 1 моль гремучей ртути. Щелочной же раствор при титровании обнаруживает большее количество ионов ОН' на 1 мол, потому что в процессе реакции в растворе возникают еще 2 дополнительных иона ОН' вследствие распада избыточного тиосульфата натрия (образование других сильных оснований и аммиака в растворе исключено). Уравнение реакции возникновения двух дополнительных ионов ОН' еще не изучено и стехиометрически точно не может быть написано. Однако целый ряд побочных показателей позволяет предположительно установить ход их возникновения.
В самом деле в процессе титрования гремучей ртути, растворенной в водном растворе тиосульфата натрия, зачастую совершенно ясно ощущается запах цианистого водорода, в то время как при растворении ее никакого запаха не чувствуется- Поэтому вполне вероятно, что вначале, как и указывает Филипп, образуется комплексное соединение тиосульфата натрия и гремучей кислоты, углерод которой имеет ненасыщенные связи:
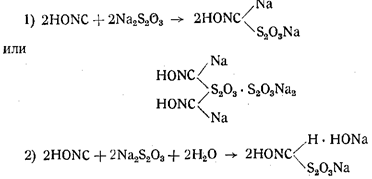
При титровании раствора происходит распад образовавшегося комплексного соединения, конечными продуктами которого являются цианистая, циановая и изоциановая кислоты:
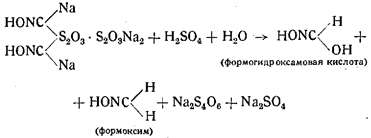
Формогидроксамовая кислота и формоксим распадаются на воду, синильную и циановые кислоты.
Таким образом 1 моль гремучей ртути соответствует 4 ионам ОН'.
Опыт показывает, что щелочность раствора убывает с увеличением времени работы с ним. Установлено, что при объемной цене капли децинормального раствора серной кислоты, равной 0,04 мл, понижение щелочности раствора 0,3 г гремучей ртути в 30 мл 20%-ного водного раствора тиосульфата натрия соответствует 0,12 мл децинормального раствора серной кислоты в 1 мин. в первые 2 мин. после начала растворения. Результаты титрования, следовательно, нуждаются в положительной поправке.
Раствор титруют в присутствии метилоранжа. Вследствие того, что переход цвета гремуче ртутного раствора при титровании заметить очень трудно, приходится сознательно перетитровывать раствор до достижения эталонного цвета. Эталоном является цвет 150 мл дистиллированной воды с 5 каплями метилоранжа (1 : 5000) и с 2 каплями децинормальной серной кислоты. Действительная точка нейтрализации, стало быть, на 2 капли ниже той, которую мы наблюдаем при титровании, и полученный результат нуждается в поправке, равной удвоенному объему капли, т.е. 0,04*2 = 0,08 мл.
Раствор тиосульфата натрия в воде обладает щелочной реакцией, что также должно быть учтено при вычислении результатов титрования. Чтобы при нейтрализации 30 мл 20%-ного раствора тиосульфата натрия, разбавленного 120 мл воды, получить эталонный цвет, приходится добавить 8 капель децинормальной серной, кислоты. Следовательно, отрицательная-поправка на эталонный цвет и щелочность тиосульфата натрия будет равна: (8 —2)*0,04 = 0,24 мл.
Как было указано выше, щелочность гремучертутного раствора убывает со скоростью, соответствующей 0,12 мл 0,1 N серной кислоты в минуту. Поэтому наиболее рациональным временем для производства работы является:
0.24/0.12 = 2 мин
Следовательно, работа по растворению гремучей ртути в водном растворе тиосульфата натрия и титрованию раствора должна быть выполнена в течение 2 мин. При этом условии никаких поправок вводить не нужно. Исходя из этих соображений, алкалиметрический метод анализа осуществляют следующим образом.
Навеску гремучей ртути около 0,3 г (не менее 0,284 г и не более 0,355 г) помещают в совершенно сухую колбочку емкостью 300 мл. В случае применения влажной колбы или, еще хуже, колбы с каплями воды происходит комкование кристаллов гремучей ртути и связанное с этим замедление процесса растворения. Навеску гремучей ртути заливают 30 мл 20%-ного раствора- тиосульфата натрия (раствор тиосульфата натрия должен быть приготовлен за 40—48 час. до анализа и отфильтрован от выпавшей серы). Отмечают время приливания раствора тиосульфата натрия и навеску гремучей ртути растворяют при встряхивании. Растворение в этих условиях практически занимает 0,5—1 мин. Количество жидкости в колбе доводят до 100 мл, приливая 70 мл воды. Прибавляют 5 капель метилоранжа (раствор ,1 : 5000) и титруют 0,1 Nсерной кислотой до получения эталонного цвета.
Титрование следует всегда начинать в одно и то же время — через 1 мин. после начала растворения. Для того чтобы закончить титрование в 1 мин., необходимо предварительно определить расход серной кислоты на отдельно взятую навеску гремучей ртути. Для титрования раствора 0,3 г,чистой гремучей ртути требуется 42,25 мл 0,1N серной кислоты. Рассчитывают по формуле:
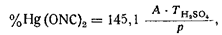
где 145,1 — отношение молекулярного веса гремучей ртути к удвоенному молекулярному весу серной кислоты, умноженному на 100;
А — число миллилитров серной кислоты, пошедшей на титрование;
T h2so4 — титр серной кислоты;
р — навеска гремучей ртути.
Титрование требует некоторой привычки, так как работу необходимо производить быстро и перемена цвета вначале недостаточно резка. Для получения надежных результатов следует производить несколько опытов титрования (обычно достаточно трех-четырех). Алкалиметрический метод дает несколько повышенные результаты.
Иодометрический метод. Лучшим методом, свободным от недочетов алкалиметрического, является иодометрический метод.
Гремучая ртуть, растворяясь в водном растворе тиосульфата натрия, разлагается, вступая в реакцию с последним:
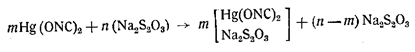
Избыток тиосульфата натрия (n—т) определяют иодометрическим путем. Однако титрование раствора гремучей ртути в растворе тиосульфата натрия без соблюдения особых условий сохранило бы все погрешности алкалиметрического способа анализа, ибо, как мы видели, при последнем играет значительную роль время анализа. Кроме того, влияние изменения щелочности, а стало быть, и количества израсходованного тиосульфата натрия, не дало бы возможности сделать результат более достоверным, чем при алкалиметрическом методе. Поэтому применяют в качестве растворителя более сильный реагент по отношению к гремучей ртути — йодистый калий.
Для работы берут 0,1N раствор тиосульфата натрия и 0,1N раствор иода. Раствор тиосульфата натрия приготовляют за 10—14 дней до установления титра. Необходимость заблаговременной подготовки раствора вытекает из того, что тиосульфат натрия вступает во взаимо-действие с угольной кислотой, обычно находящейся в дистиллированной воде:
Na2S2O3 + 2H2CO3 -> 2NaHCO3 + H2S2O3
H3S2O3 -> H2S03 + S
Сернистая же кислота, вступая в реакцию с иодом
H2SO3 + 2J + Н2O -> 2HJ + H2SO4
повышает титр тиосульфата натрия. Иными словами, титр меняется до тех пор, пока вся угольная кислота не войдет в обменное разложение с тиосульфатом натрия. После удаления из раствора всей углекислоты, что происходит через 10—14 дней, титр остается неизменным ряд месяцев.
В колбе емкостью около 300 мл с 50 мл 0,1N водного раствора тиосульфата натрия растворяют 3 г йодистого калия и быстро всыпают навеску гремучей ртути около 0,3 г. Содержимое колбы взбалтывают до растворения гремучей ртути.
В колбе протекают следующие реакции;
1) гремучая ртуть реагирует с йодистым калием, давая растворимую комплексную соль и фульминат калия*
Hg(ONC)2 + 4KJ -> [HgJ4]K2 + 2KONC .
2) фульминат калия, как соль слабой кислоты и сильного основания, гидролизует:
2KONC+2H2O -> 2HONC + 2KOH
3) гремучая кислота по приведенной выше схеме вступает во взаимодействие с тиосульфатом натрия, конечными продуктами которого являются тетратионат натрия, едкий натр, синильная и изоциановая кислоты:
2HONC + 2Na2S2O3 + Н2O -> Na2S4O6 + 2NaOH + HCN + HNCO
После растворения гремучей ртути к раствору прибавляют 50 мл воды и 4—5 капель метилоранжа (1 : 5000) и титруют 0,1N серной кислотой до остающегося розового окрашивания. Нейтральный раствор титруют 0,1N раствором иода в присутствии крахмального раствора в качестве индикатора до неисчезающего синего окрашивания;
2Na2S203 + J2 = 2NaJ + Na2S4O6
и производят расчет, исходя из количества тиосульфата натрия, вступившего в реакцию с гремучей кислотой.
8. Определение содержания ртути производится осаждением ртути сероводородом из раствора гремучей ртути в слабо разбавленной соляной кислоте в виде сульфата ртути.
Можно сделать анализ и электролитическим путем: 0,4—0,5 г высушенной при 75° гремучей ртути вначале осторожно нагревают с 2,5— 3,5 мл азотной кислоты (d = 1,4), затем доводят раствор до кипения и кипятят до исчезновения окислов азота. Разбавляют раствор водой и ведут электролиз на холоду, вначале при 0,4 А и 1,9—2,0 V, затем при 0,25 А и 2,6 V. Ртуть выделяется полностью через 6 час. Ускорения работы можно добиться, применяя вращающиеся электроды и повышая силы тока до 0,8—1,2 А при напряжении 2V.
9. Определение азота производят методом гидрирования при температуре около 250° в струе водорода в присутствии катализатора.
Сущность этого метода заключается в следующем: навеску гремучей ртути от 0,015 до 0,03 г осторожно измельчают при помощи резиновой пробки, зажатой деревянной ручкой. После измельчения гремучую ртуть тщательно перемешивают со свежевосcтановленным никелем, служащим катализатором. Недостаточно измельченная гремучая ртуть может при последующем нагревании привести к вспышке.
Смешанную с никелем навеску помещают в фарфоровую лодочку, которую вставляют в тугоплавкую стеклянную или лучше кварцевую трубку длиной 50 см, наполненную в средней своей части асбестированным никелем. Стеклянную трубку помещают в электрическую печь, причем тот конец трубки, в который вставлена лодочка, печью не обогревается, а нагревается отдельной горелкой; другой же конец трубки, выступающий на 4—5 см из печи, соединяют изогнутой трубкой с небольшим стаканчиком (с водой), где поглощается образующийся аммиак. Над стаканчиком устанавливают закрепленную на штативе бюретку, наполненную 1/40N раствором H2SО4. Трубку со стороны лодочки соединяют с прибором Киппа, служащим для получения водорода. Последний пропускают для очищения от могущего
образоваться сероводорода через раствор сулемы и для высушивания—через крепкую серную кислоту. Вначале для вытеснения воздуха пропускают водород, затем включают печь в электрическую сеть и поддерживают температуру трубки около 250° при помощи реостата. По достижении этой температуры, на что с начала пропускания водорода требуется 1 – 1.5 часа времени, приступают к нагреванию лодочки. Перед этим прибавляют в стаканчик с водой 2 капли метилоранжа и 2—3 капли 1/40N раствора H2SO4. При этом появляется оранжевая окраска, свидетельствующая о том, что воздух до нагрева печи был полностью вытеснен водородом. Нагревание лодочки следует вести очень осторожно, для чего горелкой обводят в течение короткого времени часть трубки, где помещена лодочка, и отставляют горелку в сторону, многократно повторяя эту операцию, постепенно увеличивая время обогрева. Пожелтение раствора в стаканчике свидетельствует о наступлении момента гидрирования. Затем прибавляют из бюретки несколько капель Н2SO4 до кислой реакции, продолжая обогревать лодочку. Через некоторое время раствор опять желтеет, вновь прибавляют H2SO4 и нагревают лодочку до тех пор» пока избыточная капля серной кислоты не будет окрашивать раствор в оранжевый цвет, несмотря на длительное и сильное нагревание лодочки. Такой способ титрования дает возможность следить за скоростью разложения гремучей ртути и регулировать ее. Лодочку нагревают от полутора до 2 часов.
Асбестированный никель следует после нескольких определений прокалить на воздухе, чтобы сжечь накопившиеся в нем углеродистые вещества и вновь восстановить в струе водорода.
Дата добавления: 2021-02-19; просмотров: 233;










