ХАРАКТЕРИСТИКИ ПРИРОДНЫХ ГАЗОВ
1.1. Исходные понятия и определения
Современный уровень решения целого ряда технологических задач по эксплуатации и обслуживанию энергопривода компрессорных станций магистральных газопроводов связан с использованием законов как идеальных, так и реальных газов. В связи с этим специалистам газотранспортных предприятий, использующих те или иные методы тепловых расчетов, связанных с определением характеристик оборудования компрессорных станций (КС), прежде всего необходимо четко усвоить основные понятия и определения природных газов, знать границы применяемости законов идеальных газов, уметь определять теплофизические свойства природных газов.
В зависимости от способа получения и физико-химических свойств все газы условно можно разделить на природные и искусственные. Природный газ в настоящее время является основным видом топлива в системе городов и поселков, ценным сырьем для химической промышленности. Различают три основных группы природных газов:
газы, получаемые из чисто газовых месторождений (сухие газы); состоят в основном из метана СН 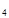 до 98%;
до 98%;
газы, получаемые из газоконденсатных месторождений; состоят из сухого газа и примеси конденсата (бензина, лигроина, керосина);
попутные газы, получаемые из скважин нефтяных месторождений вместе с нефтью, состоят из смеси газов с газовым бензином и пропан-бутановой фракции.
Искусственный газ получают в результате термической обработки твердых и жидких топлив, а также подземной газификации углей. Основной состав этих газов - окись углерода, водород и азот.
Состояние любого газа принято характеризовать величинами, которые называются параметрами состояния. Наиболее распространенными параметрами состояния являются: плотность, давление, температура. Кроме того, широко используются такие понятия, как масса, теплоемкость, работа, теплота, энтальпия, энтропия и т.д.
Масса газа ( 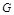 ) характеризует свойство его инертности, т.е. свойство сохранять приобретенное движение или состояние покоя. Масса газа измеряется в килограммах.
) характеризует свойство его инертности, т.е. свойство сохранять приобретенное движение или состояние покоя. Масса газа измеряется в килограммах.
Плотность газа принято определять как отношение массы газа 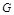 к его объему
к его объему 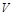 или массу газа, содержащуюся в единице его объема:
или массу газа, содержащуюся в единице его объема:
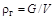 . (1.1)
. (1.1)
Плотность газа измеряется в кг/м 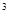 или в г/см
или в г/см 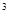 . При решении целого ряда задач трубопроводного транспорта природных газов пользуются понятием относительной плотности газа, т.е. отношением плотности газа к плотности сухого воздуха
. При решении целого ряда задач трубопроводного транспорта природных газов пользуются понятием относительной плотности газа, т.е. отношением плотности газа к плотности сухого воздуха 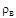 при одних и тех же условиях:
при одних и тех же условиях:
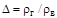 . (1.2)
. (1.2)
Плотность газа при 0°С и атмосферном давлении может быть определена по его мольной массе 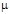 :
:
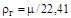 , (1.3)
, (1.3)
где 22,41 - объем одного киломоля любого газа при 0°С и атмосферном давлении, м  .
.
Киломоль это количество вещества в килограммах, численно равное его мольной массе. Так, например, киломоль кислорода О  равен 32 кг, киломоль углекислого газа СО
равен 32 кг, киломоль углекислого газа СО  - 44 кг и т.д. (1 киломоль = 1000 моль).
- 44 кг и т.д. (1 киломоль = 1000 моль).
При решении задач трубопроводного транспорта газов часто приходится иметь дело с изменением плотности газа в результате его сжатия, нагревания, охлаждения и т.д. При этом масса газа 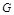 , естественно, остается постоянной, а плотность изменяется только в связи с изменением объема газа
, естественно, остается постоянной, а плотность изменяется только в связи с изменением объема газа 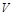 . В этом случае удобнее бывает оперировать с понятием удельного объема газа
. В этом случае удобнее бывает оперировать с понятием удельного объема газа 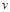 - величины, обратной плотности газа:
- величины, обратной плотности газа:
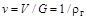 . (1.4)
. (1.4)
Давление принято определять как отношение силы, действующей перпендикулярно к поверхности тела, на единицу этой поверхности:
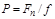 , (1.5)
, (1.5)
где 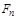 - сила, действующая по нормали к поверхности тела;
- сила, действующая по нормали к поверхности тела; 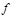 - площадь поверхности тела, перпендикулярная к действующей силе.
- площадь поверхности тела, перпендикулярная к действующей силе.
Если силу 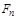 , приложенную к поверхности тела, измерять в ньютонах (Н), а площадь поверхности
, приложенную к поверхности тела, измерять в ньютонах (Н), а площадь поверхности 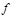 - в квадратных метрах (м
- в квадратных метрах (м 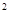 ), то единицей давления будет ньютон на квадратный метр (Н/м
), то единицей давления будет ньютон на квадратный метр (Н/м 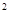 ). Эта единица давления называется паскалем (Па). Наряду
). Эта единица давления называется паскалем (Па). Наряду
с паскалем, в практике проведения расчетов употребляются и более крупные единицы - килопаскаль (кПа), равный 1000 Па, и мегапаскаль (МПа), равный 10 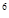 Па.
Па.
Давление жидкостей и газов измеряют приборами барометрического типа для определения абсолютного давления 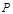 или приборами манометрического типа
или приборами манометрического типа 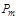 для определения избыточного давления. Абсолютное давление, например, в резервуарах, трубопроводах и т.п. будет определяться как сумма манометрического давления
для определения избыточного давления. Абсолютное давление, например, в резервуарах, трубопроводах и т.п. будет определяться как сумма манометрического давления 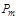 и абсолютного давления окружающей среды
и абсолютного давления окружающей среды 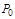 , измеренного, например, барометром:
, измеренного, например, барометром:
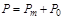 . (1.6)
. (1.6)
Если приборы манометрического типа используются для измерения разрежения в сосудах, то их называют вакуумметрами. Абсолютное давление газа в этом случае определяется соотношением:
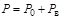 , (1.7)
, (1.7)
где 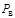 - разность давления окружающей среды и давления в сосуде, называемая разрежением и измеряемая вакуумметром.
- разность давления окружающей среды и давления в сосуде, называемая разрежением и измеряемая вакуумметром.
Следует хорошо помнить, что во все расчетные соотношения входят только значения абсолютных давлений газа и жидкости 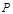 .
.
Температура является важнейшим термодинамическим параметром, определяющим состояние газа, степень его нагретости. В инженерной практике при измерении температуры газа используются две температурные шкалы: шкала Цельсия и шкала Кельвина. Показания температуры в градусах Кельвина больше температуры, измеренной в градусах Цельсия, на 273,16 градуса. Так, например, если газ имеет температуру 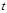 = 20 °С, то его абсолютная температура будет
= 20 °С, то его абсолютная температура будет 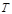 = 273,16 + 20 = 293,16 К и т.д.
= 273,16 + 20 = 293,16 К и т.д.
Работа в обычном определении механики - это произведение силы 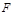 , действующей в направлении движения, на путь перемещения тела (газа). В условиях перемещения газа в газопроводах, работа газоперекачивающих агрегатов (ГПА) идет на изменение его кинетической энергии, изменение положения центра тяжести потока и преодоление сил трения газа о стенки трубопровода:
, действующей в направлении движения, на путь перемещения тела (газа). В условиях перемещения газа в газопроводах, работа газоперекачивающих агрегатов (ГПА) идет на изменение его кинетической энергии, изменение положения центра тяжести потока и преодоление сил трения газа о стенки трубопровода:
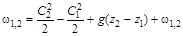 **, (1.8)
**, (1.8)
где 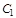 и
и 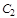 - линейные скорости газа в соответствующих сечениях 1 и 2;
- линейные скорости газа в соответствующих сечениях 1 и 2; 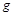 - ускорение свободного падения;
- ускорение свободного падения; 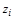 - расположение рассматриваемой точки газопровода по высоте;
- расположение рассматриваемой точки газопровода по высоте; 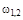 ** - удельная работа трения.
** - удельная работа трения.
В технических расчетах транспорта газа и определении показателей газоперекачивающих агрегатов важное значение имеет понятие термодинамического процесса. Под термодинамическим процессом принято понимать любое изменение состояния тела. При этом процесс может определяться условием о постоянном значении какого-либо параметра газа (например, 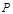 = const,
= const, 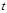 = const и т.п.) или условием о равенстве нулю какого-либо эффекта в процессе (например, равенство нулю теплообмена в процессе работы и т.п.). Часто пользуются обобщенным понятием процесса, называя его в этом случае политропным процессом. Политропный процесс - где одновременно могут изменяться все параметры тела (давление, объем, температура), осуществляться подвод или отвод теплоты и т.п.
= const и т.п.) или условием о равенстве нулю какого-либо эффекта в процессе (например, равенство нулю теплообмена в процессе работы и т.п.). Часто пользуются обобщенным понятием процесса, называя его в этом случае политропным процессом. Политропный процесс - где одновременно могут изменяться все параметры тела (давление, объем, температура), осуществляться подвод или отвод теплоты и т.п.
Массовым расходом газа называется масса газа, проходящая через поперечное сечение трубы в единицу времени (кг/с):
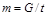 , (1.9)
, (1.9)
где 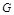 - масса газа (за время
- масса газа (за время 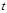 );
); 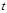 - время, в течение которого через данное сечение проходит газ. Отсюда возникает понятие массовой скорости потока, определяемой как количество газа, проходящего через единицу поперечного сечения газопровода в единицу времени (кг/м
- время, в течение которого через данное сечение проходит газ. Отсюда возникает понятие массовой скорости потока, определяемой как количество газа, проходящего через единицу поперечного сечения газопровода в единицу времени (кг/м  с):
с):
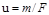 , (1.10)
, (1.10)
где 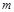 - массовый расход газа;
- массовый расход газа; 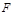 - площадь поперечного сечения газопровода.
- площадь поперечного сечения газопровода.
Объемным расходом газа называется количество газа в единицах объема, проходящего через сечение газопровода в единицу времени (м 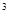 /с):
/с):
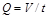 , (1.11)
, (1.11)
где 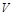 - объем газа, м
- объем газа, м 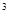 ;
; 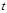 - время, в течение которого через рассматриваемое сечение проходит объем газа.
- время, в течение которого через рассматриваемое сечение проходит объем газа.
Объем и объемный расход обычно относят к определенной температуре и определенному давлению. В расчетах систем газоснабжения объемный расход определяют при температуре 0 °С и давлении 760 мм рт.ст. (1,03 ата или 0,101 МПа) или при температуре 20 °С и давлении 0,101 МПа.
Соответственно линейная скорость определяется как объемный расход газа в условиях потока через единицу поперечного сечения газопровода (м/с):
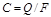 , (1.12)
, (1.12)
где 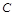 - линейная скорость газа в газопроводе;
- линейная скорость газа в газопроводе; 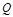 - объемный расход газа в условиях потока при данном давлении и температуре.
- объемный расход газа в условиях потока при данном давлении и температуре.
Между массовой 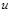 и линейной
и линейной 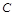 скоростью существует простая взаимосвязь:
скоростью существует простая взаимосвязь: 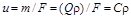 . Использование в расчетах понятия массовой скорости удобно тем, что в отличие от линейной скорости она для газопровода постоянного сечения остается неизменной.
. Использование в расчетах понятия массовой скорости удобно тем, что в отличие от линейной скорости она для газопровода постоянного сечения остается неизменной.
Влажность газов характеризует количество водяных паров, содержащихся в единице количества газа. Транспортируемый по газопроводам газ, к сожалению, всегда содержит какое-то количество влаги, что приводит к образованию конденсата, снижает количество перекачиваемого газа, вызывает коррозию трубопровода. Различают понятия абсолютной и относительной влажности газа. Абсолютную влажность можно рассматривать как массовую абсолютную влажность и как объемную абсолютную влажность. В первом случае влажность определяется как отношение количества водяного пара к количеству газа: 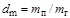 ; во втором - как отношение количества водяного пара к объему газа:
; во втором - как отношение количества водяного пара к объему газа: 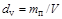 . Относительную влажность газов определяют как отношение фактически содержащегося количества водяных паров
. Относительную влажность газов определяют как отношение фактически содержащегося количества водяных паров 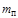 к максимально возможному
к максимально возможному 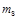 при определенных условиях:
при определенных условиях:
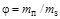 . (1.13)
. (1.13)
Относительную влажность определяют по соотношению плотностей пара и насыщенного пара, а также по соотношению парциального давления водяного пара и давления насыщенного пара при той же температуре. Влажный пар называется насыщенным, когда он содержит максимально возможное количество пара при данной температуре и давлении:
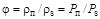 , (1.14)
, (1.14)
где 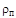 - плотность пара;
- плотность пара; 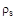 - плотность насыщенного пара;
- плотность насыщенного пара; 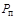 - парциальное давление водяного пара;
- парциальное давление водяного пара; 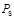 - давление насыщенного пара.
- давление насыщенного пара.
Теплоемкость газов
При тепловых расчетах газопроводов часто приходится пользоваться понятием удельной теплоемкости газа. Удельной теплоемкостью газа называется количество теплоты, необходимой для нагрева единицы массы вещества (или объема) на один градус в определенном процессе:
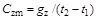 , (1.15)
, (1.15)
где 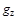 - количество теплоты, подведенной к единице массы (или объема) газа в процессе его нагрева от температуры
- количество теплоты, подведенной к единице массы (или объема) газа в процессе его нагрева от температуры 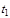 до температуры
до температуры 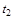 ;
; 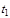 и
и 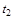 - соответственно начальная и конечная температура газа.
- соответственно начальная и конечная температура газа.
На практике наиболее часто используются теплоемкости изобарного и изохорного процессов. Эти теплоемкости называются изобарной и изохорной и обозначаются соответственно 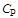 и
и 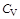 . Теплоемкость
. Теплоемкость 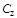 - величина переменная, зависящая от температуры и давления, а для идеальных газов - только от температуры. Теплоемкость, определяемую уравнением (1.15), называют средней теплоемкостью и обозначают
- величина переменная, зависящая от температуры и давления, а для идеальных газов - только от температуры. Теплоемкость, определяемую уравнением (1.15), называют средней теплоемкостью и обозначают 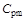 и
и 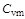 в отличие от истинных теплоемкостей
в отличие от истинных теплоемкостей 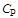 и
и 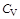 , определяемых для конкретно заданной температуры.
, определяемых для конкретно заданной температуры.
Средняя теплоемкость газа в интервале заданных температур процесса определяется по значению среднеарифметической температуры процесса 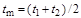 , т.е. для того чтобы найти среднюю теплоемкость
, т.е. для того чтобы найти среднюю теплоемкость 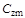 , необходимо знать среднюю температуру процесса
, необходимо знать среднюю температуру процесса 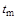 . По найденному значению средней температуры
. По найденному значению средней температуры 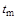 определяется с использованием специальных таблиц (табл. 1.1) теплоемкость газов.
определяется с использованием специальных таблиц (табл. 1.1) теплоемкость газов.
В практических расчетах среднюю теплоемкость наиболее просто определять по соотношению:
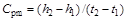 , (1.16)
, (1.16)
где 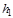 и
и 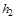 - энтальпии природного газа в начале и в конце процесса. Значения энтальпий определяются по соответствующим таблицам или диаграммам для данного газа или вещества.
- энтальпии природного газа в начале и в конце процесса. Значения энтальпий определяются по соответствующим таблицам или диаграммам для данного газа или вещества.
Таблица 1.1
Массовая теплоемкость некоторых газов
при постоянном (атмосферном) давлении в кДж/ (кг · °С)
#G0Температура 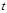 °С °С
| Кислород О 
| Азот
N 
| Водород Н 
| Углекисл. газ СО 
| Вода Н  О О
| Метан СН 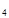
| Воздух |
| 0,917 | 1,010 | 14,21 | 0,820 | 1,855 | 2,190 | 1,005 | |
| 0,925 | 1,038 | 14,35 | 0,871 | 1,867 | 2,471 | 1,005 | |
| 0,938 | 1,047 | 14,43 | 0,913 | 1,888 | 2,800 | 1,013 | |
| 0,950 | 1,051 | 14,46 | 0,950 | 1,913 | 3,206 | 1,017 | |
| 0,967 | 1,056 | 14,49 | 0,984 | 1,938 | 3,650 | 1,030 | |
| 0,980 | 1,060 | 14,52 | 1,013 | 1,968 | 4,104 | 1,038 | |
| 0,992 | 1,073 | 14,56 | 1,042 | 2,001 | 4,545 | 1,051 | |
| 1,005 | 1,089 | 14,60 | 1,066 | 2,030 | 4,991 | 1,063 | |
| 1,017 | 1,101 | 14,66 | 1,088 | 2,064 | - | 1,072 | |
| 1,026 | 1,109 | 14,72 | 1,109 | 2,097 | - | 1,084 | |
| 1,034 | 1,118 | 14,79 | 1,126 | 2,131 | - | 1,093 | |
| 1,042 | 1,130 | 14,87 | 1,143 | 2,164 | - | 1,101 | |
| 1,051 | 1,139 | 14,95 | 1,160 | 2,194 | - | 1,109 | |
| 1,059 | 1,147 | 15,04 | 1,172 | 2,227 | - | 1,118 | |
| 1,063 | 1,155 | 15,13 | 1,185 | 2,257 | - | 1,126 | |
| 1,072 | 1,164 | 15,22 | 1,197 | 2,286 | - | 1,130 |
Смеси газов
Природные газы представляют собой смесь, состоящую из нескольких чистых веществ, химически не взаимодействующих между собой: метана СН 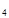 , этана С
, этана С  Н
Н 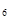 , пропана С
, пропана С 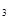 Н
Н 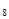 , бутана С
, бутана С 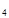 Н
Н 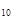 и других углеводородов. Поэтому одной из важнейших характеристик смеси является ее состав. Состав смеси обычно определяется посредством нахождения массовой или мольной концентрации компонентов, входящих в смесь. Понятие "моль", как отмечалось выше, означает количество вещества в граммах, численно равное его мольной массе, а киломоль - количество вещества в килограммах, тоже численно равное его мольной массе. Так, например, киломоль кислорода О
и других углеводородов. Поэтому одной из важнейших характеристик смеси является ее состав. Состав смеси обычно определяется посредством нахождения массовой или мольной концентрации компонентов, входящих в смесь. Понятие "моль", как отмечалось выше, означает количество вещества в граммах, численно равное его мольной массе, а киломоль - количество вещества в килограммах, тоже численно равное его мольной массе. Так, например, киломоль кислорода О  равен 32 кг, киломоль метана СН
равен 32 кг, киломоль метана СН 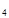 - 16,04 кг и т.д. Физические характеристики компонентов природного газа приведены в табл. 1.2.
- 16,04 кг и т.д. Физические характеристики компонентов природного газа приведены в табл. 1.2.
Массовой концентрацией 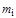 -го компонента называется отношение массы данного компонента
-го компонента называется отношение массы данного компонента 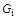 к массе всей смеси
к массе всей смеси 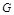 :
:
Таблица 1.2
Физические характеристики компонентов природного газа
| #G0Компонент состава газа | Формула | Мольная масса | Плотность, кг/м 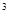
| Плотность по отношению к воздуху | Температура сжижения, °С |
| Метан | СН 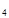
| 16,04 | 0,72 | 0,55 | -161,5 |
| Этан | С  Н Н 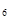
| 30,07 | 1,36 | 1,05 | -89 |
| Пропан | С 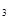 Н Н 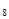
| 44,09 | 2,02 | 1,55 | -42 |
| Бутан | С 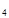 Н Н 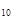
| 58,12 | 2,70 | 2,08 | -1 |
| Пентан | С 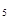 Н Н 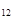
| 72,15 | 3,22 | 2,50 | +36 |
| Гексан | С 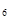 Н Н 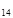
| 86,18 | - | 3,00 | +68 |
| Этилен | С  Н Н 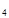
| 28,05 | 1,26 | 0,98 | -104 |
| Пропен | С 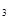 Н Н 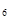
| 42,08 | 1,92 | 1,48 | -48 |
| Бутен | С 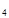 Н Н 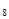
| 56,10 | 2,60 | 2,00 | -6 |
| Пентен | С 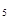 Н Н 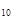
| 70,13 | 3,13 | - | - |
| Ацетилен | С  Н Н 
| 26,04 | 1,17 | 0,31 | -84 |
| Бензол | С 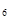 Н Н 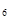
| 78,11 | 3,48 | - | - |
| Оксид углер. | СО | 28,01 | 1,25 | 0,97 | -192 |
| Углекис.газ | СО 
| 44,01 | 1,98 | 1,53 | -78 |
| Сероводород | H  S S
| 34,08 | 1,54 | 1,19 | +46 |
| Азот | N 
| 28,02 | 1,25 | 0,97 | -196 |
| Кислород | O 
| 32,0 | 1,43 | 1,10 | -186 |
| Водород | Н 
| 2,02 | 0,09 | 0,07 | -253 |
| Водяной пар | Н  O O
| 18,02 | 0,77 | 0,59 | +100 |
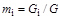 , (1.17)
, (1.17)
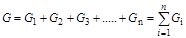 . (1.18)
. (1.18)
Сумма всех массовых концентраций компонентов, составляющих смесь, равна единице:
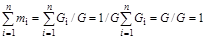 . (1.19)
. (1.19)
Соответственно определяется изобарная теплоемкость смеси газов:
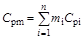 , (1.20)
, (1.20)
где 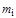 - массовая доля i-го компонента смеси;
- массовая доля i-го компонента смеси; 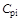 - изобарная теплоемкость i-го компонента;
- изобарная теплоемкость i-го компонента; 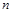 - число компонентов в смеси.
- число компонентов в смеси.
Мольной концентрацией 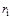 -го компонента называется отношение числа киломолей данного компонента
-го компонента называется отношение числа киломолей данного компонента 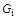 к общему числу киломолей
к общему числу киломолей 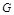 :
:
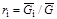 , (1.21)
, (1.21)
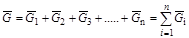 . (1.22)
. (1.22)
Сумма всех мольных концентраций компонентов, составляющих смесь, равна единице:
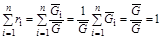 . (1.23)
. (1.23)
Отношение массы данного компонента 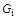 к количеству молей этого компонента
к количеству молей этого компонента 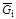 характеризует его мольную массу
характеризует его мольную массу 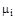 , а отношение массы всей смеси
, а отношение массы всей смеси 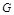 к количеству молей смеси характеризует мольную массу смеси
к количеству молей смеси характеризует мольную массу смеси 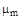 :
:
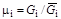 ;
; 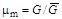 . (1.24)
. (1.24)
С учетом вышеприведенных соотношений средняя мольная масса смеси определяется соотношением:
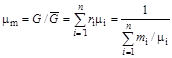 . (1.25)
. (1.25)
Мольные концентрации компонентов смеси идеального газа численно равны его объемным концентрациям, которые определяются как отношение объема данного компонента 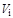 при давлении и температуре смеси к объему всей смеси
при давлении и температуре смеси к объему всей смеси 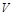 . В силу этого объемные концентрации компонентов смеси газов в ряде случаев определяют и через соотношение давлений:
. В силу этого объемные концентрации компонентов смеси газов в ряде случаев определяют и через соотношение давлений:
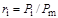 , (1.26)
, (1.26)
где 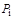 - парциальное давление компонента газа;
- парциальное давление компонента газа; 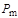 -давление смеси в целом.
-давление смеси в целом.
Состав природного газа обычно регулярно определяется на газопроводах соответствующими лабораториями с использованием хроматографического анализа.
Пример 1.1. Определить мольные концентрации компонентов природного газа и его среднюю мольную массу при следующем объемном составе компонентов газа: метана СН 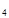 = 94%, этана С
= 94%, этана С  Н
Н 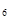 = 3%, пропана С
= 3%, пропана С 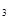 Н
Н 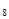 = 1,5%, бутана С
= 1,5%, бутана С 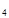 Н
Н 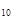 = 0,5%, углекислого газа СО
= 0,5%, углекислого газа СО  = 1,0%.
= 1,0%.
Решение. Мольные концентрации компонентов по уравнению (1.21):
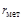 = 0,94;
= 0,94; 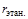 = 0,03;
= 0,03; 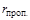 = 0,015;
= 0,015; 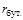 = 0,005;
= 0,005; 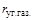 = 0,01. По уравнению (1.25) с учетом численных значений мольных масс компонентов получим:
= 0,01. По уравнению (1.25) с учетом численных значений мольных масс компонентов получим:
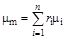 = 0,94·16,04+0,03·30,07+0,015·44,09+0,01·58,12 = 17,37 кг/кмоль.
= 0,94·16,04+0,03·30,07+0,015·44,09+0,01·58,12 = 17,37 кг/кмоль.
Теплота сгорания газов
Теплота сгорания, или теплотворная способность газа как топлива, - это количество теплоты, выделяемой при полном сгорании единицы количества вещества (кг или м  ), измеренного при нормальных стандартных условиях (давление, температура).
), измеренного при нормальных стандартных условиях (давление, температура).
Различают высшую  и низшую
и низшую 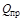 теплоту сгорания. Высшей теплотой сгорания называется количество теплоты (кДж), выделяющееся при полном сгорании единицы количества вещества (кг или м
теплоту сгорания. Высшей теплотой сгорания называется количество теплоты (кДж), выделяющееся при полном сгорании единицы количества вещества (кг или м 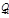 ), с учетом конденсации водяных паров, образующихся при окислении водорода. Низшей теплотой сгорания называется количество теплоты (кДж), выделяющееся при полном сгорании единицы количества вещества при нормальных или стандартных условиях без учета теплоты, выделяющейся при конденсации водяных паров. На основе численного значения теплоты сгорания топлива определяют потребность в газообразном топливе, а также КПД газоперекачивающих агрегатов и других газоиспользующих установок.
), с учетом конденсации водяных паров, образующихся при окислении водорода. Низшей теплотой сгорания называется количество теплоты (кДж), выделяющееся при полном сгорании единицы количества вещества при нормальных или стандартных условиях без учета теплоты, выделяющейся при конденсации водяных паров. На основе численного значения теплоты сгорания топлива определяют потребность в газообразном топливе, а также КПД газоперекачивающих агрегатов и других газоиспользующих установок.
В расчетах обычно используют понятие низшей теплоты сгорания топлива в силу того, что отходящие из газоиспользующих установок продукты сгорания имеют относительно высокую температуру, значительно выше, чем температура точки росы, при которой и происходит конденсация водяных паров, содержащихся в продуктах сгорания.
Численные значения низшей теплоты сгорания ряда компонентов газообразного топлива приведены в табл. 1.3.
Следует заметить, что приводимые в литературе данные о теплоте сгорания отдельных компонентов газообразного топлива часто разнятся между собой. Это в определенной степени обусловлено различием в подсчете основных характеристик самого топлива.
Таблица 1.3
Низшая теплота сгорания некоторых компонентов природного газа
| #G0Компонент смеси | Метан СН 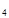
| Этан
С  Н Н 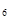
| Пропан
С 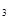 Н Н 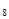
| Бутан
С 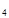 Н Н 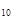
| Пентан
С 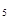 Н Н 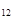
| Гексан
С 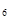 Н Н 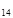
|
Низшая теплота сгорания, кДж/м 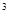
|
Пример 1.2. Определить низшую теплоту сгорания природного газа, имеющего следующее процентное содержание компонентов: метана СН 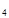 = 94%; этана С
= 94%; этана С  Н
Н 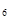 = 3%; пропана С
= 3%; пропана С 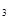 Н
Н 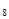 = 1,5%; бутана С
= 1,5%; бутана С 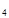 Н
Н 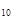 = 1%; пентана С
= 1%; пентана С 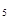 Н
Н 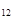 = 0,5%.
= 0,5%.
Решение. Расчет низшей теплоты сгорания топлива проводится по формуле:
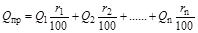 ,
,
где 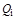 - теплота сгорания компонентов смеси;
- теплота сгорания компонентов смеси; 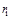 - процентное содержание компонентов смеси.
- процентное содержание компонентов смеси.
Применительно к данному случаю получим:
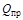 = 35880·0,94 + 64450·0,03 + 92949·0,015 + 118680·0,01 +146130·0,005 = 38672 кДж/м
= 35880·0,94 + 64450·0,03 + 92949·0,015 + 118680·0,01 +146130·0,005 = 38672 кДж/м 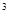 .
.
Переход к определению массовой теплоты сгорания топлива (кДж/кг) осуществляется с использованием плотности газа в данных условиях [ 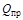 ,кДж/кг = (
,кДж/кг = ( 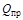 кДж/м
кДж/м 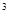 ) /
) / 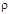 , кг/м
, кг/м 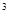 ].
].
Пересчет теплоты сгорания газа от нормальных условий к стандартным проводится по формуле:
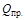 (20°С) =
(20°С) = 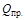 (0°С)
(0°С) 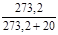 .
.
Согласно существующим требованиям, номинальная низшая теплота сгорания топлива при проведении теплотехнических расчетов в системе газовой промышленности принимается равной 34541 кДж/м 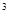 .
.
Пределы взрываемости газовоздушных смесей
Исключение образования взрывоопасных газовоздушных концентраций, а также появление источников воспламенения этой смеси (пламени, искр) всегда является основной задачей обслуживающего персонала компрессорных станций. При взрыве газовоздушной смеси резко повышается давление в зоне взрыва, приводящее к разрушению строительных конструкций, а скорость распространения пламени достигает сотни метров в секунду. Например, температура самовоспламенения метановоздушной смеси находится на уровне 700 °С, а метан является основным компонентом природного газа. Его содержание в газовых месторождениях колеблется в диапазоне 92-98%.
При взрыве газовоздушной смеси, находящейся под давлением 0,1 МПа, развивается давление около 0,80 МПа. Газовоздушная смесь взрывается, если в ней содержится 5-15 % метана; 2-10 % пропана; 2-9 % бутана и т.д. При повышении давления газовоздушной смеси пределы взрываемости сужаются. Следует отметить, что примесь кислорода в газе увеличивает опасность взрыва.
Пределы и интервал взрываемости газов в смеси с воздухом при температуре 20 °С и давлении 0,1 МПа приведены в табл. 1.4.
Таблица 1.4
Пределы и интервал взрываемости газов в смеси
с воздухом при температуре 20 °С и давлении 0,1 МПа
| #G0Газ | Пределы взрываемости, % по объему | Интервал взрываемости, % по объему | |
| нижний | верхний | ||
| Ацетилен | 2,3 | 82,0 | 79,7 |
| Бутан | 1,5 | 8,5 | 7,0 |
| Бутилен | 1,7 | 9,0 | 7,3 |
| Водород | 4,0 | 75,0 | 71,0 |
| Метан | 5,0 | 15,0 | 10,0 |
| Нефтепромысл. газ | 4,0 | 14,0 | 10,0 |
| Оксид углерода | 12,5 | 75,0 | 62,5 |
| Природный газ | 5,0 | 15,0 | 10,0 |
| Пропан | 2,0 | 9,5 | 7,5 |
| Пропилен | 2,2 | 9,7 | 7,5 |
| Этан | 3,0 | 14,0 | 11,0 |
| Этилен | 3,0 | 33,3 | 30,3 |
1.2. Законы идеальных газов. Области их применения
Идеальными газами принято считать газы, подчиняющиеся уравнению Клапейрона ( 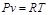 ). Одновременно под идеальными подразумеваются газы, в которых отсутствуют силы межмолекулярного взаимодействия, а объем самих молекул равен нулю. В настоящее время можно утверждать, что ни один из реальных газов не подчиняется этим газовым законам. Тем не менее эти специфические газовые законы достаточно широко используются в технических расчетах. Эти законы просты и достаточно хорошо характеризуют поведение реальных газов при невысоких давлениях и не очень низких температурах, вдали от областей насыщения и критических точек вещества. Наибольшее практическое распространение получили законы Бойля-Мариотта, Гей-Люссака, Авогадро и на их основе полученное уравнение Клапейрона-Менделеева.
). Одновременно под идеальными подразумеваются газы, в которых отсутствуют силы межмолекулярного взаимодействия, а объем самих молекул равен нулю. В настоящее время можно утверждать, что ни один из реальных газов не подчиняется этим газовым законам. Тем не менее эти специфические газовые законы достаточно широко используются в технических расчетах. Эти законы просты и достаточно хорошо характеризуют поведение реальных газов при невысоких давлениях и не очень низких температурах, вдали от областей насыщения и критических точек вещества. Наибольшее практическое распространение получили законы Бойля-Мариотта, Гей-Люссака, Авогадро и на их основе полученное уравнение Клапейрона-Менделеева.
Закон Бойля-Мариотга утверждает, что при постоянной температуре ( 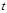 = const) произведение абсолютного давления и удельного объема идеального газа сохраняет постоянную величину (
= const) произведение абсолютного давления и удельного объема идеального газа сохраняет постоянную величину ( 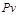 = const), т.е. произведение абсолютного давления и удельного объема зависит только от температуры. Откуда при
= const), т.е. произведение абсолютного давления и удельного объема зависит только от температуры. Откуда при 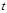 = const имеем:
= const имеем:
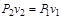 . (1.27)
. (1.27)
Закон Гей-Люссака утверждает, что при постоянном давлении ( 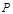 = const) объем идеального газа изменяется прямо пропорционально повышению температуры:
= const) объем идеального газа изменяется прямо пропорционально повышению температуры:
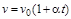 , (1.28)
, (1.28)
где 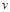 - удельный объем газа при температуре
- удельный объем газа при температуре 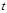 °С и давлении
°С и давлении 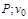 - удельный объем газа при температуре
- удельный объем газа при температуре 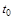 = 0 °С и том же давлении
= 0 °С и том же давлении 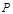 ;
; 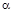 - температурный коэффициент объемного расширения идеальных газов при 0 °С, сохраняющий одно и то же значение при всех давлениях и одинаковый для всех идеальных газов:
- температурный коэффициент объемного расширения идеальных газов при 0 °С, сохраняющий одно и то же значение при всех давлениях и одинаковый для всех идеальных газов:
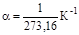 . (1.29)
. (1.29)
Таким образом, содержание закона Гей-Люссака сводится к следующему утверждению: объемное расширение идеальных газов при изменении температуры и при 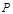 = const имеет линейный характер, а температурный коэффициент объемного расширения
= const имеет линейный характер, а температурный коэффициент объемного расширения 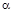 является универсальной постоянной идеальных газов.
является универсальной постоянной идеальных газов.
Сопоставление законов Бойля-Мариотта и Гей-Люссака приводит к уравнению состояния идеальных газов:
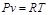 , (1.30)
, (1.30)
где 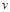 - удельный объем газа;
- удельный объем газа; 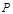 - абсолютное давление газа;
- абсолютное давление газа; 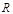 - удельная газовая постоянная идеал
- удельная газовая постоянная идеал
| <== предыдущая лекция | | | следующая лекция ==> |
| | | Динамика электромагнита |
Дата добавления: 2020-12-11; просмотров: 194;










