Классификации гетерогенных катализаторов с точки зрения электронного подхода.
Поскольку гетерогенно-каталитическая реакция протекает через образование химических связей с поверхностными атомами катализатора, а следовательно через перераспределение электронов между атомами катализатора и субстрата, то, очевидно, что на каталитические свойства твердого вещества должно сильно влиять его электронное строение.
В 60-х годах ХХ-го века возлагались большие надежды на создание всеобщей электронной теории гетерогенного катализа. Был очень быстро накоплен богатейший экспериментальный материал по электронным эффектам в гетерогенном катализе. Однако, оказалось, что одного электронного подхода не достаточно для объяснения каталитических свойств твердых материалов. Тем не менее, электронная теория полезна и применима для объяснения многих наблюдаемых закономерностей для отдельных классов катализаторов и реакций.
Электронное строение твердого вещества определяет его электропроводные свойства. Поэтому наиболее часто гетерогенные катализаторы делят на три группы по проводимости: металлы (проводники), полупроводники и изоляторы.
Металлы (проводники)
К этой группе относятся металлы - вещества хорошо проводящие электрический ток.
Полупроводники
К этой группе относятся твердые вещества, чья электропроводность растет с температурой (это металлоиды: Si, Ge и др.; и оксиды и сульфиды: ZnO, NiO, Cr2O3, ZnS и пр.)
Изоляторы
Это твердые вещества, чья электропроводность не играет никакой роли при тех температурах, при которых они используются в катализе.
Сильно различающиеся электронные свойства перечисленных типов катализаторов влияют на механизм образования связи между активными центрами и реагентами. По этому признаку катализаторы делят на редокс и кислотно-основные.
Редокс катализаторы.
К этой группе относятся катализаторы, обладающие при температурах реакции подвижными (проводящими) электронами - то есть металлы и полупроводники. Каталитические реакции на их поверхности протекают через стадии гомолитического разрыва связи в субстрате:
2Кат× + X:Y à Кат:Х + Кат:Y (5.30)
и стадии окислительно-восстановительных (редокс) процессов с участием активных центров катализатора.
Они катализируют реакции: гидрирования, дегидрирования, окисления, разложения, полимеризации, синтез аммиака, реакции на основе синтез-газа.
Кислотно-основные катализаторы.
У этих катализаторов нет подвижных носителей зарядов, поэтому они относятся к классу изоляторов. Электронное взаимодействие с субстратом происходит по ионному механизму, и связь в субстрате рвется гетеролитически. Общая схема электронного взаимодействия катализатора и субстрата выглядит так:
А + :Кат à А:Кат à А:- + Кат+
или (5.30)
В: + Кат à В:Кат à В+ + :Кат-
Возникающие электронные заряды на поверхности локализованы на активных центрах и не передаются по поверхности (так как отсутствует проводимость). К таким катализаторам относятся оксиды: Al2O3, SiO2, B2O3, смешанные оксиды, твердые кислоты. Они катализируют реакции, подверженные кислотно-основному катализу: гидролиз, гидратация-дегидратация, полимеризация, поликонденсация, крекинг, изомеризация.
В Таблице 5.12 кратко суммирована информация по классификации гетерогенных катализаторов с точки зрения их электронного строения.
Таблица 5.12.
Классификация гетерогенных катализаторов.
| Проводники (металлы) | Полупроводники | Изоляторы | |
| Проводимость, Ом-1м-1 | 108 - 106 | 105 - 10-8 сильно увеличивается с повышением температуры. | 10-8 - 10-18 |
| Перенос электронов | Обмен электронами металл-адсорбат. | Перенос электронов при высоких температурах. | Нет |
| Примеры | Множество металлов, в основном переходные металлы и их сплавы. | Металлоиды (Si, Ge и др.); Оксиды и сульфиды ( ZnO, NiO, Cr2O3, ZnS и пр.) | Оксиды (Al2O3, SiO2, B2O3, MgO) и их смеси; Соли; Твердые кислоты. |
Далее будут рассмотрены каждая из подгрупп катализаторов с точки зрения влияния их электронного строения на каталитические свойства.
Металлы.
В практике гетерогенного катализа в качестве металлических катализаторов наибольшее значение имеют переходные металлы и их сплавы. s-Элементы главных подгрупп I и II групп периодической системы являются ярко выраженными электронодонорами и образуют прочные ионные соединения с электроноакцепторными реагентами (оксиды, сульфиды) и, следовательно не являются подходящими для катализа.
Зонная теория.
Наиболее простое и наглядное описание электронной структуры металлов дает зонная теория.
В зонной теории электронное строение в кристаллической решетке металлов представляет собой результат упрощенного решения уравнения Шреденгира для многоатомной системы.
Согласно зонной теории атомы металла занимают фиксированное положение в узлах кристаллической решетки. Перекрывающиеся атомные s-, d- и р-орбитали образуют соответствующие обобществленные энергетические зоны. Каждая из зон, образованная N атомами кристаллической решетки состоит из N уровней. Электроны всех атомов металла в кристалле делокализованы (обобществлены) и занимают уровни энергетических зон согласно принципу Паули, начиная с нижнего по энергии и в порядке возрастания их энергии. Низкоэнергетические зоны заполнены электронами внутренних электронных оболочек металла и не влияют на каталитические свойства металла. Для катализа важны верхние (по энергии) зоны, образованные ns-, (n-1)d- и nр-орбиталями. s-Орбитали образуют s-зону, d-орбитали образуют d-зону и р-орбитали образуют р-зону.
Уровень энергии, соответствующий ВЗМО, называют уровнем Ферми (Ef; Рис. 5.34). Различие в энергиях соседних уровней в металлах мало, поэтому электроны достаточно свободно перемещаются с уровня на уровень, в том числе с заполненного уровня, лежащего ниже уровня Ферми на незаполненный уровень выше уровня Ферми, благодаря чему металлы обладают высокой проводимостью. Энергия, необходимая для перехода электрона с уровня Ферми за пределы металла (в вакуум) называется работой выхода (j; Рис. 5.34).
Взаимное относительное расположение зон по энергии различно для разных металлов и изменяется в периодах слева направо так, как показано на Рисунке 5.33.

| Крайнее левое положение (один s-электрон на атом) | Среднее положение (6 электронов на атом) | Крайнее правое положение (11 электронов на атом) |
Рис. 5.33. Относительное расположение s-, p- и d-зон по энергии в металлах в зависимости от расположения в периодах периодической таблицы.
При этом s-зона имеет широкую полосу по энергии (около 20 эВ) и низкую плотность электронов (так как ей соответствует мало электронов). d-Зона гораздо уже по энергии (около 4 эВ), но имеет высокую плотность электронов, т.е. различие в энергиях уровней в d-зоне гораздо меньше, чем в s-зоне. Таким образом, s-зона перекрывает d-зону по энергии. р-Зона имеет высокий уровень энергии и остается не заполненной в переходных металлах.
На Рисунке 5.34 приведены диаграммы плотности энергетических уровней (плотность состояний dN/dE) s- и d-зон и их заселенность электронами для Ni и Cu. d-Зона более узкая, перекрывается s-зоной и имеет более высокую плотность состояний. У Ni остается незаполненной часть уровней d-зоны, которые называют дырками в d-зоне( т.е. уровень Ферми (Еf) лежит ниже края d-зоны). У Cu вся d-зона полностью заполнена электронами.


Рис. 5.34. Зонная схема переходных металлов на примере Ni и Cu. j - работа выхода. Ef - уровень Ферми.
Работа выхода определяет энергию ионизации металла. В периодической системе энергия ионизации, в общем, увеличивается в рядах слева направо (Табл. 5.13), значит в этом же направлении понижается уровень Ферми.
Таблица 5.13.
Работа выхода (j), первый потенциал ионизации (J) и процент d-характера связи (%d) для некоторых металлов.
| Металл | j, эВ | J, эВ | %d, % |
| Sc Ti V Cr Mn Fe Co Ni Cu | - 4.05 4.28 4.56 4.00 4.60 4.97 5.06 4.55 | 6.7 6.81 6.73 6.77 7.41 7.85 7.85 7.63 7.72 | 39.7 39.5 - |
| Y Zr Nb Mo Tc Ru Rh Pd Ag | - 4.10 4.37 4.21 - 4.66 4.76 4.98 4.49 | 6.5 6.93 6.77 7.29 - 7.59 7.68 8.32 7.59 | - |
| La Hf Ta W Re Os Ir Pt Au | 3.30 3.62 4.21 4.55 4.92 4.55 5.0 5.42 5.32 | 5.60 - - 8.10 7.68 8.72 - 8.89 9.19 | - |
Степень заполненности d-зоны, наличие дырок и уровень Ферми в переходном металле или сплаве определяет его способность к хемосорбции. Определенное количество свободных уровней и d-дырок способны к образованию связей с адсорбатом.

А б с
Рис. 5.35. Влияние адсорбции акцептора (б) и донора (с) на электронное строение металла согласно зонной модели.
На Рисунке 5.35 изображено влияние хемосорбции донорных и акцепторных молекул на электронные свойства металла с точки зрения зонной теории. На Рисунке 5.35а) изображена зонная схема для исходного состояния металла.
Если адсорбат - является акцептором электронов (например О2), то для образовании связи с металлом электронная плотность передается из валентной зоны металла к адсорбату, что приводит к понижению уровня Ферми и увеличению работы выхода (Рис. 5.35,б). Чем выше степень заполнения поверхности акцепторным адсорбатом, тем ниже уровень Ферми и выше энергетический барьер для образования новых связей с адсорбатом.
Следовательно, вещества с электроноакцепторными свойствами хемосорбируются легче и прочнее на металлах с высоким уровнем Ферми (т.е, расположенными в левой части периодов). При хемосорбции уровень Ферми понижается и способность к связыванию адсорбата падает с увеличением степени покрытия поверхности.
Если адсорбат - является донором электронов (например Н2, СО, олефины), то при образовании связи с металлом электронная плотность передается на свободные уровни энергетических зон металла, что приводит к повышению уровня Ферми и снижению работы выхода (Рис. 5.35, в).
Следовательно вещества с электронодонорными свойствами хемосорбируются легче и прочнее на металлах с высоким процентом дырок в d-зоне. При хемосорбции способность к связыванию адсорбата падает с увеличением степени покрытия поверхности, т.к. количество дырок уменьшается и растет уровень Ферми.
Приведенные схемы во многих случаях объясняют общую тенденцию в изменении скорости и силы хемосорбции на металлах:
- сила связывания атомарных частиц наиболее высока для металлов в левых частях рядов периодической системы;
- скорость диссоциативной адсорбции на благородных металлах увеличивается справа налево, как функция заполненности d-зоны.
Например (Рис. 5.36), скорость реакции гидрирования СО на металлах 4-го периода имеет четкую зависимость от степени заполненности d-зоны. На рисунке изображена типичная вулкано-образная зависимость. С точки зрения зонной теории можно дать такое объяснение: вправо от Co количество d-дырок у металлов резко уменьшается и скорость и равновесие хемосорбции донорных реагентов (Н2 и СО) также резко снижаются, а влево от Со образуются слишком устойчивые поверхностные соединения, что также приводит к снижению скорости реакции.

Рис. 5.36. Скорость гидрирования СО на до метана на металлических катализаторах.
Таким образом, заполненность d-зоны металлов сильно влияет на их каталитические свойства. Отсюда можно сделать вывод, что сплавление каталитически активного металла с другим металлом (даже не активным в данной реакции) может изменить электронное строение катализатора и значительно изменить его каталитические свойства. Это иллюстрируется на примерах металлов 8-10 групп периодической системы, которые особенно активны в реакциях гидрирования-дегидрирования.
Сплавление этих металлов с неактивными и низкоактивными металлами 11-й группы (Cu, Ag, Au) приводит к заполнению d-зоны активного металла и понижают активность в реакции гидрирования.
Например добавление Cu (имеющей полностью заполненную d-зону и неактивного в реакции гидрирования непредельных углеводородов) к активным металлам гидрирования - Pd и Pt, приводит к снижению количества дырок в d-зоне активного металла, повышению уровня Ферми и снижению скорости гидрирования. И наоборот, активность Ni в реакциях гидрирования увеличивается при добавлении к нему Fe.
В реакции разложения Н2О2 наблюдается противоположный эффект - сплавление с Cu приводит к повышению скорости реакции. Это объясняется тем, что в лимитирующей стадии происходит образование электроноакцепторных частиц на поверхности катализатора О- и ОН-. Сплавление с медью приводит к повышению уровня Ферми и ускорению лимитирующей стадии.
Но, поскольку, ни один из факторов не действует изолированно в катализе, а может лишь в отдельных случаях быть определяющим, то, как правило, для объяснения наблюдаемых эффектов необходимо рассматривать совокупность наиболее важных факторов.
Так например обстоит дело в реакциях гидрогенолиза этана и дегидрирования циклогексана катализируемых Ni, модифицированным Cu:
С2Н6 + Н2 à 2СН4
С6Н12 à С6Н6 + 3Н2
С точки зрения электронного строения, сплавление с медью должно приводить к плавному снижению скоростей этих реакций т.к. медь повышает уровень Ферми никеля и снижает процент дырок в d-зоне.
Исследование адсорбции водорода показало, что общее количество водорода, как и ожидается снижается относительно монотонно (Рис. 5.37, кривая 1). А количество прочно связанного (хемосорбированного) водорода резко падает уже при концентрации меди около 15% и далее медленно снижается до нуля (Рис. 5.37, кривая 2).
Эти исследования помогли сделать вывод о том, что сплав Ni/Cu не однороден и поверхность сильно обогащена медью уже при низких ее концентрациях, и концентрация меди на поверхности меняется мало в широком диапазоне соотношения металлов в сплаве (18-95%). Обогащение поверхности сплава Ni/Cu медью объясняется, в частности, более низкой поверхностной энергией меди по сравнению с никелем.

Рис. 5.37. Удельный адсорбционный объем водорода на сплавах Ni/Cu.
1 - суммарный объем; 2 - объем хемосорбированного водорода.
Учитывая этот факт становится возможным объяснить изменение скоростей гидрирования этилена и дегидрирования циклогексана при катализе сплавом Ni/Cu с изменением состава сплава (Рис. 5.38).
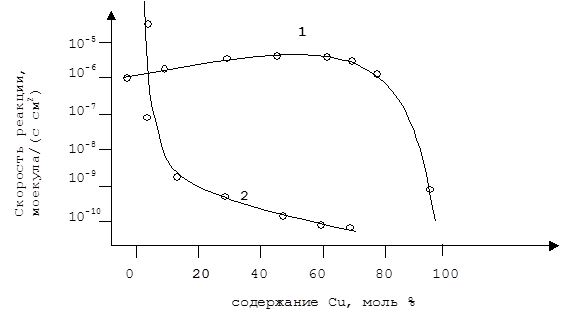
Рис. 5.38. Зависимость скорости дегидрирования циклогексана (1) и гидрирования этилена (2) от содержания меди в сплаве Ni/Cu.
Как видно из графиков, скорость гидрогенолиза падает на 3 порядка при добавлении всего 5% меди. Скорость же дегидрирования в этом диапазоне слегка увеличивается, а затем не меняется вплоть до чистой меди, на которой реакция вообще не идет.
Резкое падение скорости гидрогенолиза этана при малых добавках меди объясняется резким снижением концентрации Ni на поверхности, т.к. для протекания данной реакции необходимо наличие соседствующих атомов никеля на которых происходит диссоциативная хемосорбция этана с разрывом С-С связи. Т.е. в данном случае основную роль играет стерический фактор.
Дегидрирование циклогексана протекает через разрыв С-Н связи, которая гораздо слабее чем С-С связь, поэтому изменение электронного строения сплава не сказывается на скорости этой стации, а небольшое увеличение наблюдаемой скорости объясняют увеличением скорости десорбции бензола вследствии понижения прочности координации p-связи бензола с никелем. Т.е. в данной реакции играет роль еще и энергетический фактор. При концентрации меди в сплаве выше 80%, когда поверхностных атомов Ni становится совсем мало, скорость реакции резко падает.
Влияние изменения электронных свойств на каталитическую активность наблюдается и для других сплавов. Например сплавы палладия: Pd/Ni, Pd/Ru, Pd/Pt - более активны в реакции дегидрирования циклогексана, чем чистый Pd.
Этот эффект широко применяют для корректировки селективности промышленных катализаторов.
Так, например, добавление небольших количеств Cu к эффективному катализатору реформинга (Ru/Os) значительно снижает его активность в реакции гидрогенолиза углеводородов, что благоприятно сказывается на селективности процесса.
При гидроочистке этилена от следов ацетилена к Pd добавляют такие металлы, как Sn, Zn, Pb, Ag, Au. При этом резко снижается скорость гидрирования этилена, что значительно повышает селективность гидроочистки.
В Таблице 5.14 приведены примеры изменения каталитических свойств промышленных катализаторов, сплавлением благородных металлов с другими металлами.
Таблица 5.14.
Модификация каталитических свойств благородных металлов добавлением других металлов.
| Активный металл | Добавка | Реакция, процесс | Эффект |
| Pt | 5 - 20% Ru | Окисление аммиака | Увеличение выхода NO, уменьшение уноса Pt. |
| Ag | Au | Окисление этилена | Увеличение селективности образования этиленоксида. |
| Ag | 10% Au | Окисление кумола | Увеличение скорости образования гидроперекиси кумола. |
| Pt | Ge, Sn, In, Ga | Дегидрирование и гидрокрекинг алканов | Увеличение срока службы из-за уменьшения отложения углерода. |
| Pt | Sn + Re | Дегидроциклизация и ароматизация алканов | Увеличение активности и стабильности катализатора. |
| Pt | Pb, Cu | -- " -- | Увеличение выхода ароматических продуктов. |
| Pt, Pd, Ir | Au | Окислительное дегидрирование н-бутена до бутадиена и метанола до формальдегида. | Повышение селективности. |
| Pd | Sn, Zn, Pb | Селективное гидрирование алкинов до алкенов | Повышение селективности. |
Теория Полинга.
Еще один подход к корреляции каталитических свойств с электронным строением металлов основывается на теории металлической связи по Полингу.
Суть этого подхода состоит в следующем:
Полинг предположил, что связь между атомами в металле образуется перекрыванием dsp-гибридизованных орбиталей. Атомы в металле могут находиться в нескольких гибридизованных состояниях, в каждом из которых в образование металлической связи включается различное количество d-гибридизованных электронов. Каждое гибридизованное состояние атома металла существует с определенной вероятностью (расчет строится на экспериментальных данных о длинах связи, энергии связи, окружении атома металла в кристаллической решетке, магнитном моменте). Из резонанса этих состояний Полинг рассчитал вес (процент) d-характера металлической связи, как отношение числа d-электронов, участвующих в металлической связи к числу связующих орбиталей.
Чем выше процент d-характера металлической связи, тем меньше "дырок" - не спаренных d-электронов, остается у атома металла, а именно они участвуют в хемосорбции и определяют каталитическую активность металла.
Рассмотрим пример расчета веса d-характера связи в Ni по Полингу:
Из 10 валентных электронов в атоме никеля 6 участвуют в образовании металлической связи, а 4 остаются при атоме. Полинг вычислил, что атом никеля существует в кристаллическом состоянии в двух гибридизованных состояниях Ni-A и Ni-В, с вероятностью 30 и 70% соответственно. Их электронные конфигурации и тип гибридизации приведены ниже:
Ni-A:  d2sp3 - гибридные связывающие электроны
d2sp3 - гибридные связывающие электроны
Ni-В:  d3sp2 - гибридные связывающие электроны
d3sp2 - гибридные связывающие электроны
Вес d-характера (вычисляется как отношения числа связывающих d-электронов к числу связующих орбиталей) в Ni-A составляет: (2-связывающих d-электрона)/(6-связывающих орбиталей) = 0,33, а в Ni-В: 3/7 = 0,43.
Учитывая вероятность существования этих состояний, в среднем вес d-характера связи составляет в металлическом Ni:
%d = (30%)×0,33 + (70%)×0,43 = 40%
То есть, количество дырок в никеле составляет 0,6 на атом, что очень хорошо совпадает с экспериментально измеряемым магнитным моментом.
В Таблице 5.13 приведены значения процента d-характера для переходных металлов. С процентом d-характера связи хорошо коррелирует активность металлов в реакциях гидрирования олефинов, в частности, этилена (Рис. 5.39).

Рис. 5.39. Зависимость каталитической активности переходных металлов в реакции гидрирования этилена от процента d-характера металлической связи.
В тоже время корреляция каталитической активности с весом d-характера металлической связи не обнаруживается для многих других реакций, в частности, для реакции разложения муравьиной кислоты.
При сравнении зонной модели и модели Полинга становится очевидно, что dsp-гибридизованных орбитали по Полингу соответствуют заполненным уровням зонной модели. А не участвующие в металлической связи не спаренные d-электроны по Полингу соответствуют d-дыркам в зонной модели.
Еще один пример, иллюстрирующий влияние электронных свойств металлических сплавов на направление и скорость реакции - гидрирование насыщенных и ненасыщенных альдегидов, катализируемое биметаллическими сплавами палладия. В реакции гидрирования двойной связи в кротоновом альдегиде экспериментально установлен следующий ряд активности металлов-модификаторов:
Ir, Co < Rh < Ni < Pt < Pd
А в реакции гидрирования карбонильной группы в масляном альдегиде ряд активности - обратный. Это объясняется следующими различиями в механизмах этих реакций:
Обе реакции проходят через стадию образования одноцентровой полугидрированной промежуточной хемосорбированной частицы.
Гидрирование олефиновой связи проходит через нуклеофильную атаку гидридным лигандом на углерод при двойной связи с образованием алкильного лиганда (реакция внедрения). Затем водород гетеролитически взаимодействует с этим интермедиатом давая продукт реакции и исходную форму каталитического центра:
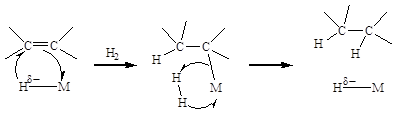 (5.31)
(5.31)
Чем сильнее электроно-донорные свойства металла-модификатора, тем выше будет нуклеофильность водорода и выше скорость реакции. В приведенном ряду металлов-модификаторов, кроме Pt, уровень Ферми повышается слева направо (величина J уменьшается, Табл. 5.13). Но у Pt процент d-характера металлической связи меньше, чем у Pd.
Гидрирование карбонильной группы проходит по механизму электрофильного присоединения протона к карбонильному кислороду:
 (5.32)
(5.32)
Следовательно, чем выше электронакцепторные свойства металлов-модификаторов, тем выше электрофильность водорода, и тем выше скорость реакции. Поэтому ряд активности металлов - обратный.
Выводы.
На сегодняшний день очевидно, что и зонная теория и теория металлической связи по Полингу имеют множество недостатков. Главный их недостаток в том, что они характеризуют электронное состояние атомов металлов в объеме бесконечной кристаллической решетки, а не на поверхности, где решетка обрывается и у атомов появляются свободные связи (координационные места).
Таким образом, зонная модель и теория металлической связи Полинга могут во многих частных случаях ОБЪЯСНИТЬ наблюдаемые эффекты в катализе, но не могут служить инструментом для ПРЕДСКАЗАНИЯ каталитических свойств.
Кроме того на электронное взаимодействие металла и адсорбата может накладываться стерический фактор, что делает интерпретацию каталитических свойств с позиции только одного из факторов невозможным.
По этим причинам в конце этого раздела приведен ряд эмпирических обобщений по каталитическим свойствам металлов:
1. Металлы, как катализаторы, наиболее эффективны в реакциях гидрирования, гидрогенолиза, изомеризации и окисления.
2. В реакциях с участием водорода чаще всего соблюдается следующий ряд относительной активности:
Ru, Rh, Pd, Os, Ir, Pt > Fe, Co, Ni > Ta, W, Cr, Cu
3. Pd - эффективный катализатор гидрирования кратных С-С связей. Проявляет высокую селективность в присутствии других функциональных групп.
4. Каталитическая активность в некоторых случаях коррелирует с весом d-характера связи в металле.
5. Каталитическая активность в некоторых случаях коррелирует с параметрами кристаллической решетки металлов.
6. Наиболее устойчивы к О2 и S2 следующие металлы:
Rh Pd Ag
Ir Pt Au
В литературе приведено множество рядов относительной активности металлов для тех или иных реакций. Часто они сильно различаются и даже разнонаправлены. В Таблице 5.15 приведены некоторые из них.
Таблица 5.15.
Относительная каталитическая активность металлов.
| Гидрирование олефинов Гидрирование этилена Гидрогенолиз Гидрирование ацетиленов Гидрирование ароматики Дегидрирование Изомеризация двойной связи в алкенах Гидратация | Rh > Ru > Pd > Pt > Ir » Ni > Co > Fe > Re ³ Cu Rh , Ru > Pd > Pt > Ni > Co, Ir > Fe > Cu Rh ³ Ni ³ Co ³ Fe > Pd > Pt Pd > Pt > Ni , Rh > Fe, Cu, Co, Ir, Ru > Os Pt > Rh > Ru > Ni > Pd > Co > Fe Rh > Pt > Pd > Ni > Co ³ Fe Fe » Ni » Rh > Pd > Ru > Os > Pt > Ir » Cu Pt > Rh > Pd >> Ni >> W >> Fe |
Дата добавления: 2020-07-18; просмотров: 279;










