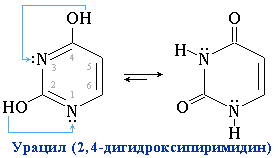
Созревание пре-иРНК
Этот процесс по-научному называют процессингом или посттранскрипционной модификацией. Дело в том, что образующаяся в результате иРНК оказывается первичной (несозревшей) и только после протекания процесса созревания она может служить матрицей для синтеза белка на рибосомах. Причем этот процесс может быть и у тРНК и рРНК и только у эукариот, так как из- за нахождения наследственного материала в цитоплазме , еще не успевшая полностью синтезироваться иРНК подвергается в тот же момент процессу трансляции. Процессинг включает в себя 3 стадий:
1) Кэпирование - этот процесс протекает ещё во время транскрипции и состоит в том, что к 5̕ концу соединения 7- метилгуанозина. Функциональное значение этого процесса- защита пре-иРНК с 5̕ конца от экзонуклеаз- ферменты, расщепители.
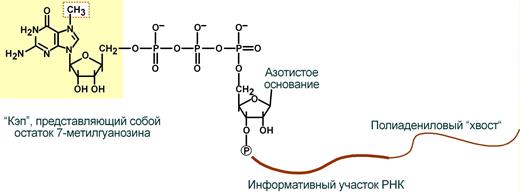
2) Полиаденилирование- процесс присоединения к 3̕ концу иРНК при помощи фермента поли(А)-полимеразы от 100 до 200 аденинов. Синтез подобного хвоста необходим для защиты иРНК от экзонуклеаз с 3̕ конца.
3) Сплайсинг. Если вспомните строение гена эукариот, то у них в кодирующей части были интроны, которые не содержат в себя никакой информации для синтеза будущего белка и поэтому они должны быть вырезаны. Процесс этот осуществляется при помощи малых ядерных РНК, при этом интроны вырезаются, а экзоны сшиваются.

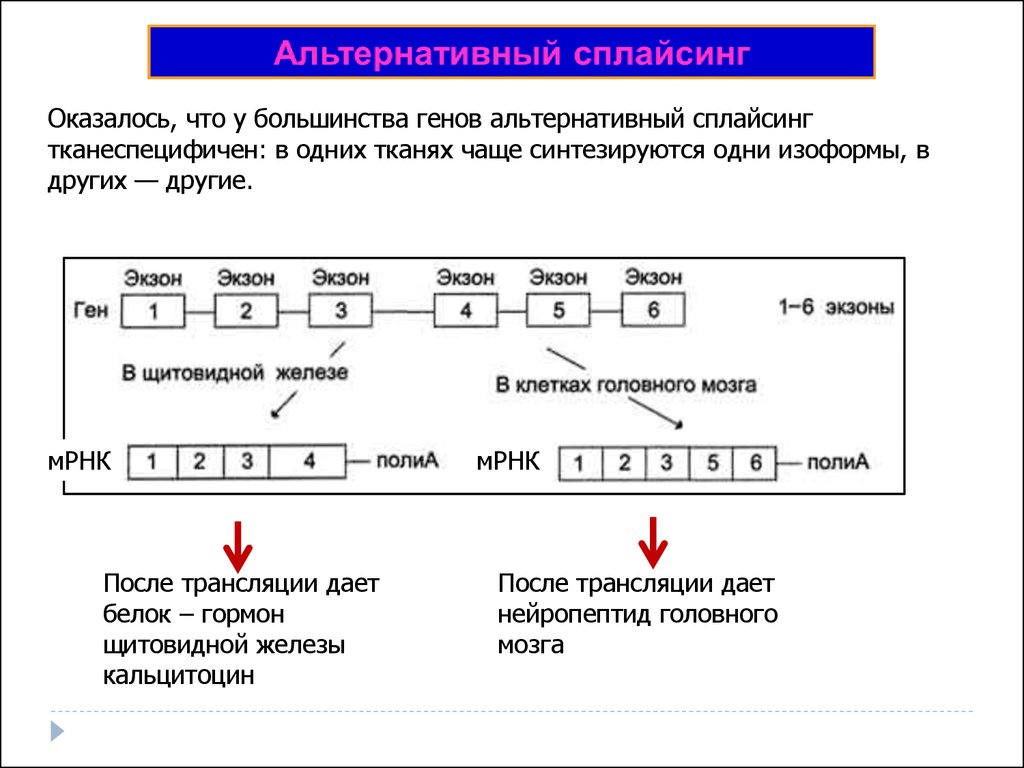
Также учеными был обнаружен альтернативный сплайсинг, когда экзоны могут расположится не в том порядке, в каком они были в гене, а по- другому. Смотри на рисунок для понимания.
Генетический код. Трансляция (биосинтез белка)
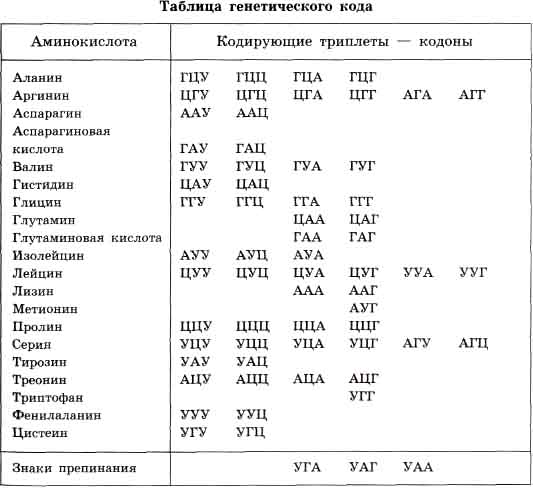
Прежде чем начать говорить трансляции я должен сказать о генетическом коде. Генетический код- это способ кодирования информации о порядке аминокислот в белке. Ключом к кодированию является триплет(кодон)- последовательность из 3 нуклеотидов. Каждому триплету соответствует определенная аминокислота. И так как в ДНК 4 азотистых основания, а аминокислоте соответствует 3, то 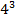 будет 64 кодона, из них 61 являются смысловыми, то есть они кодируют аминокислоту, а три являются бессмысленными(терминируюшими)- УАГ,УАА,УГА.
будет 64 кодона, из них 61 являются смысловыми, то есть они кодируют аминокислоту, а три являются бессмысленными(терминируюшими)- УАГ,УАА,УГА.
Свойства генетического кода:
1) Триплетность- единицей кода является триплет(кодон).
2) Непрерывность- триплеты при трансляции считываются непрерывно, триплет за триплетом без пропусков.
3) Вырожденность- 20 аминокислотам соответствует 61 кодон, значит одну аминокислоту может кодировать несколько кодонов. Вырожденность подразделяется на:
а) полную: первые 2 нуклеотида в триплете одинаковые, различается третий(например, аминокислоту пролин кодирует 4 триплета: ЦЦА, ЦЦУ, ЦЦЦ, ЦЦГ)
б) неполная: первые 2 нуклеотида разные (аминокислоту серин кодируют 4 триплета- УЦУ, УЦЦ, УЦА,УЦГ)
4) специфичность- каждому 1 триплету- 1 аминокислота. Если 1 аминокислоту могут кодировать несколько триплетов, то обратная связь не канает
5) неперекрываемость- это значит, что 1 нуклеотид в триплете входит в состав только этого триплета и не может принадлежать 2 триплетам одновременно
5) универсальность- генетический код одинаков от вирусов до человека, по сути это свойство свидетельство единства происхождения всех живых организмов на нашей планете.
Трансляция
Трансляция- сложнейший процесс синтеза белка из аминокислот на матрице иРНК. В этом процессе, в отличие от репликации и транскрипции принимают участие все 3 класса РНК. Процесс осуществляется на рибосомах – органеллах клетки, состоящих из малой и большой субъединиц, которые вместе образуют целостный комплекс только при синтезе белка. Как наверняка вам известно, аминокислоты переносятся тРНК к рибосоме, но в прежде они должны быть к ней присоединены. Этот процесс осуществляется благодаря ферменту аминоацил-т-РНК-синтетазе.
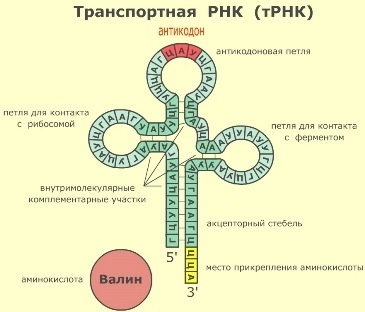
На картине очень хорошо куда именно прикрепляется аминокислота . Транспортных РНК всего 20 как и аминокислот и значит и 20 антикодонов, но как вы спросите ведь смысловых кодонов 61, оказалось, что такое возможно благодаря специальному нуклеотиду инозину, который при определенных условиях может превращаться в либо аденин, либо урацил или цитозин и гуанин.
Сам процесс трансляции состоит из 3 этапов:
1) Инициация
2) Элонгация
3) Терминация
Инициация. Для начала синтеза белка необходимо образование инициаторного комплекса. Так заведено, что первой аминокислотой во всех белках у эукариот является метионин, а у прокариот он подвергается метилированию(СН3) и называется метилметионином. И чтобы найти именно этот триплет, который является начальным, то есть кодирует метионин(или метилметионин), ведь в пептиде может быть несколько метионинов у прокариот перед ним на расстоянии в 10 нуклетидов стоит последовательность нуклеотидов АГГАГГУ , которую в науке назвали последовательностью Шайна- Дальгарно. У эукариот же этот процесс протекает в 5̕ кэпированном конце при участии определенных инициаторных белков(IF1, IF2,IF3). Далее после узнавания последовательности Шайна- Дальгарно малая рибосомная субъединица движется в сторону кодона, который кодирует метионин(начальный кодон также одинаков у всех- АУГ) . После узнавания этого кодона с малой рибосомной субъединицей соединяется большая рибосомная субъединица и образуется полноценная рибосома.
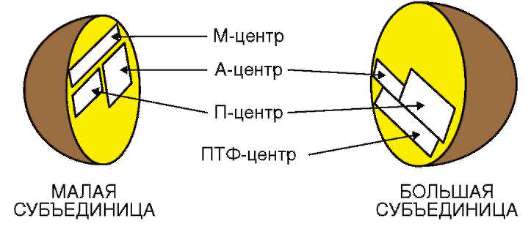
Как видите на рисунке у большой субъединицы различают П(пептидильный)- центр, А(аминокислотный)- центр и ПТФ(пептидилтрансферазный) центр. Я это говорю к тому, что после образования целостной рибосомы в П-центр заходит тРНК, переносящее аминокислоту метионин, метионин от нее отщепляется и остается в ПТФ- центре . после А- центр идет вторая т-РНК со второй аминокислотой, она также отщепляется и идет в ПТФ- центр. Между 1 и 2 аминокислотами образуется пептидная связь(СО-NH) при помощи гуанозин- нуклуотид связывающего белка(ГТФ).На этом процесс этап инициации заканчивается.4

Элонгация. Процесс элонгации- циклический процесс. Отличается от инициации еще и тем, что при его осуществлении происходит перемещение рибосомы, для того, чтобы освободился А- центр для следующего тРНК и следовательно аминокислоты, связывание её с предыдущей при помощи всё того же ГТФ, опять перемещение рибосомы и повторение того же процесса вновь и вновь.
Терминация.Конечный этап синтеза полипептидной цепочки и её отделение. Когда один из трех терминирующих кодонов(УАА,УАГ,УГА) попадает в А- центр, нет кодона комплементарного нему и А-центр заполняется специальным белком RF, который ставит точку в этом процессе.
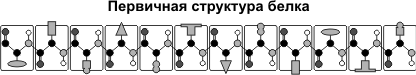
Так синтезируется первичная структура белка, который представляет из себя линейную цепочку аминокислот. Однако некоторым белкам для осуществления своих функций необходимо более сложная структура. Для этого они претерпевают посттрансляционные преоброзования- по- научнному фолдинг.
Синтезированный при трансляции белок- полипептидная цепь первичной структуры, аминокислоты в ней соединены только при помощи прочных ковалентных связей(CO-NH).
Вторичная структура- это укладывание первичной структуры в спираль благодаря образованию между соседними аминокислотами водородной связи(связь между водородом и сильно отрицательными элементами типо О,S N). В частности это структурные белки(актин, миозин мышц или фиброин шелка и.т.д.)
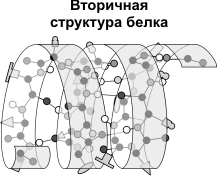
Третичная структура- дальнейшая укладка в глобулу, при этом образуется множество разнообразных видов связи- это и водородные(О…Н, S…H, N…H), дисульфидные(S-S), ионная( 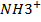 и
и 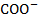 ) и гидрофобные взаимодействия между радикальными остатками аминокислот(СН3 и С2Н5). Примерами белков с третичной структурой выступают многие ферменты, антитела и гормоны.
) и гидрофобные взаимодействия между радикальными остатками аминокислот(СН3 и С2Н5). Примерами белков с третичной структурой выступают многие ферменты, антитела и гормоны.

И наконец, самая высшая структура- четвертичная. Она характерна для наиболее сложных белков(гемоглобин эритроцитов). Она характеризуется объединением нескольких глобул в единую структуру.
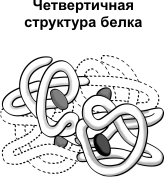
Все эти структуры могут подвергаться денатурации- процессу разрушения под действием неблагоприятных условий( дохождение температуры до 40 по цельсию в подмышечной области, или болезней, спровоцированных вирусами или бактериями ). Но при условии сохранения первичной структуры все прежние структуры могут вернуться в свой прежний вид при возвращении к нормальным условиям(36,6-36,7 градусов по цельсию в подмышечной области, вылечивании)- этот процесс называется ренатурацией и осуществляется под действием белков-шаперонов. Также рибосомы, если вы помните, бывают либо свободными, либо прикрепленными к мембране ЭПС. На свободных рибосомах осуществляются синтез белков для нужд самой клетки(белки плазматической мембраны, белки органелл, ферменты лизосом), а прикрепленные рибосомы- белки «организменного» значения, то есть гемоглобин, амилаза, липаза(клетки тонкой кишки), антитела, гормоны(инсулин, паратгомон, тироксин и др.). Превращение первичной структуры в структуры повыше и выход их из клетки осуществляется в аппаратах Гольджи, но не в ЭПС, в ЭПС они просто накапливаются. Без белков нет жизни, они –продукт экспрессии генов, ведь как выражался Ф.Энгельс: «Жизнь есть способ существования белковых тел…»
Наследственная изменчивость. Мутагенез и мутагенные факторы. Мутации. Генные мутации.
Всем нам знакомо понятие об изменчивости- свойство наследственного материала изменяться под действием различных факторов. Наряду с наследственностью эти 2 свойства относятся к главным и отличительным свойствам живого. Изменчивость подразделяется на:
1) ненаследственную(модификационная, комбинативная)- под действием факторов внешней среды, имеет приспособительное значение и по наследству не передаётся;
2) наследственная (мутационная)- обусловлена действием мутагенных факторов, возникает спонтанно, выявить сложно, так как большинство из них не затрагивает генов, передается стойко по наследству, лечению не поддаются, но можно лечить корректировкой.
Все мутации возникают под действием мутагенных факторов, которые для удобства подразделяют на:
1) физические мутагены- действие высокой температуры, различные виды радиации, действие ультрафиолетового излучения и.т.д
2) химические мутагены- химические вещества, действие никотина табака, алкоголь, запах краски, пестициды, которым травят вредителей, некоторые пищевые добавки, некоторые лекарства
3) биологические мутагены- вирусы.
Мутационная изменчивость внутри подразделяется на:
1) геномные- изменение числа хромосом;
2) генные- измиенение последовательности нуклеотидов в ДНК;
3) хромосомные- изменение строения хромосом.
Геномные мутации подразделяются на:
1) полиплоидия- кратное увеличение числа хромосом (2n+n, 2n+2n, 2n+3n и.т.д). У человека не встречается, чаще бывает у растении, способствуя увеличению их жизнедеятельности и скорости созревания плодов.
2) Анеуплоидия- изменение числа хромосом на одну или несколько(2n+1, 2n+2, 2n-1,2n-2)
Изменение числа хромосом даже на одну приводит к серьезным заболеваниям:
1) Синдром Дауна(47 ХХ(ХУ), 21+);
2) Синдром Патау(47ХХ(ХУ), 13+);
3) Синдром Шерешевского-Тёрнера(45(Х0));
4) Синдром Клаинфельтера (47, XXY; 47, XYY; 48, XXXY; 48, XYYY; 48 XXYY; 49 XXXXY; 49 XXXYY)
Также бывает, что отсутствует 2 хромосомы- нуллисомия(у растений). У человека приводит к мертворождению.
Хромосомные мутации подразделяются на:
1) Внутрихросомные- в пределах одной хромосомы:
а) инверсия- отрыв и поворот какого-то фрагмента хромосомы на 180 градусов. Она может быть либо парацентрической, если не задевает центромеру, либо перицентрической- если задевает.

б) делеция- отрыв участка хромосомы.
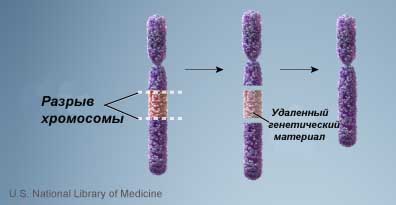
в) дупликация- удвоение участка хромосомы
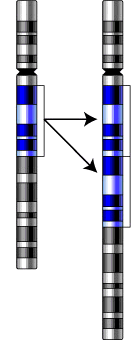
Генные мутации подразделяются на:
1) Ошибки репликации- замена нормальной пары основании на аномальную. Такое случается если при репликации фермент ДНК- полимераза не замечает ошибки при репликации или под действием различных химических веществ, когда аденин может превратиться в гуанин или цитозин и только при условии .что этого не исправят системы репарации(об этом в следующей теме)- система ферментов, исправляющих различного рода ошибки, возникающие в ДНК. Ошибки репликации в зависимости от того, какие нуклеотиды были заменены подразделяются на:
а) Транзиция. В ДНК 4 азотистых основания, из них А и Г- пуриновые(3 водородные связи), а Т иЦ- пиримидиновые. Транзиция- замена пуринового основания на пуриновое(А→Г), пиримидинового на пиримидиновое(Т→Ц).
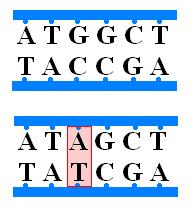
б) Трансверсия- замена пуринового на пиримидиновое(А,Г→Т, Ц)
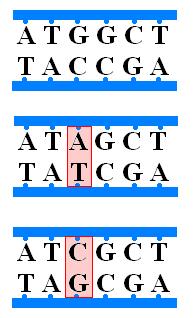
2) Сдвиг рамки считывания- это либо вставка, либо потеря нуклеотида. Также подобные мутации называют фреймшифт- мутациями. Они в человеческом организмы занимают примерно 80% мутации и являются наиболее опасными, так как приводят к изменению всей последовательности аминокислот в белке. Если происходит вставка(инсерция) нуклеотидной пары то это приводит к сдвигу рамки считывания влево, а при потере(делеция)- вправо.
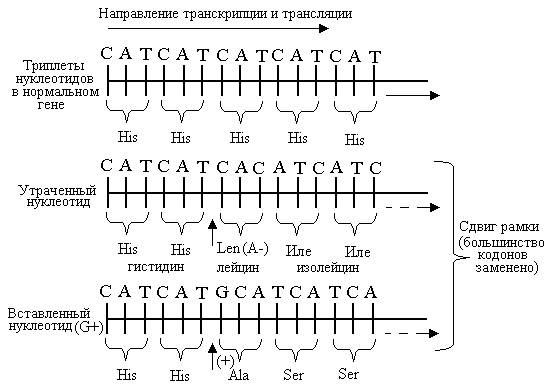
От того насколько мутация повлияет на синтезируемый белок мутации подразделяются на:
1) Миссенс- мутации- замена нуклеотида в триплете, при котором он кодировал одну аминокислоту, привело к появлению другого триплета, кодирующего другую аминокислоту. Например дан нам триплет ГЦУ(в иРНК, но помните, что изменение произошло в ДНК и отразилось в иРНК), кодирующий аланин, и произошла в ней замена 1 азотистого основания на Ц, в итоге образуется триплет ЦЦУ, кодирующий пролин. Данное изменение приводит к синтезу аномального белка, не способного в отличие от нормального выполнять свои функции и провоцированию развития болезни. Это основной класс генных мутации.
2) Нонсенс- мутации- мутации, при котором замена нуклеотида в ДНК приводит к тому, что смысловой триплет становится терминирующим.

3) Сеймсенс- мутации – мутации, при которых замена нуклеотида в триплете(именно 3 нуклеотида в триплете) не приводит к синтезу другой аминокислоты. Данная мутация обязана свойству вырожденности генетического кода. Например, дан кодон ЦЦЦ, кодирующий аминокислоту пролин и в результате мутации образовалась ЦЦА, кодирующего тот же пролин.
Сплайсинг- мутация- неправильное сшитие экзонов, когда при вырезании интронов может случайно захватиться часть экзона, вследствие чего либо будет синтезироваться аномальный белок, либо вообще отсутствовать. Как 1, так и 2 варианты неблагоприятны для организма и будут провоцировать болезни.
Динамические мутации- мутации, при котором увеличивается количество триплетных повторов((CGG)n, (CTG)n, (CAG)n) либо в промоторе, либо в кодирующих областях гена. Мутации подобного рода описаны только у человека и приводит к болезням «экспанссии»- поражение подкорковых структур головного мозга и чем больше триплетных повторов, тем сильнее выражено заболевание.
Регуляторные мутации- когда мутация затрагивает регуляторную часть гена, а именно промотор, энхансер или сайленсер. Это приводит либо к полной остановке синтеза белка(промотор), либо к выработке уменьшенного количества продукта(сайленсер), либо к чрезмерному синтезу белкового продукта(энхансер).
В результате мутации гена на молекулярном уровне возможны следующие варианты: синтез аномального белка; выработка избыточного количества генного продукта; отсутствие выработки первичного продукта; выработка уменьшенного количества нормального первичного продукта.
Генные болезни - это большая группа заболеваний, возникающих в результате генных мутаций. Большинство генных патологий обусловлено мутациями в структурных генах, осуществляющих свою функцию через синтез полипептидов - белков.
Репарация ДНК.
Как мы уже говорили, большинство мутации вредны для организма, поэтому в организме существует специальные антимутационные барьеры, без которых мы бы прожили гораздо меньше:
1) Парность генов в гомологичных хромосомах, которые препятствует фенотипическому проявлению рецессивных мутаций(но эта защита будет бесполезной, если вы выйдете замуж(женитесь) за какого- то близкого родственника, ведь у вас с вашим родственником будут в основном одинаковые гены и вероятность аа будет увеличиваться, следовательно и число болезней);
2) Две цепи в ДНК(одна выступает в качестве запасной и на него будет можно ориентироваться, если повредится какая- то одна из цепей, но если будут повреждены оба цепи, то о восстановлении прежней структуры можно и забыть)
3) Свойство вырожденности генетического кода- одна аминокислота- несколько триплетов(если один триплет будет поврежден можно не переживать за синтез аминокислоты(но, к сожалению аминокислоты пролин и триптофан кодируются всего одним триплетом));
4) Триплетность кода- если повредится 3 нуклеотид, то нестрашно, гораздо страшнее если повредятся 1 и 2(вероятность, того, что генная мутация будет в 3 нуклеотида мала(33,3%), но все же лучше, чем ничего )
5) Наличие в ДНК нескольких повторов одного гена(рРНК, тРНК, иРНК и др.)
6) и-РНК активно разрушаются особыми малыми интерферирующими РНК, если в молекуле есть “неправильно” расположенные кодоны-терминаторы или с ошибками прошло полиаденилирование
7) убиквитин метит полипептиды с ошибками в аминокислотных последовательностей в белке и далее те узнаются белками- шаперонами, которые переносят их в лизосомы и те разрушаются
8) репарация ДНК- целый комплекс сложных реакций, благодаря которым, клетка справляется с мутациями.
Наше ДНК всегда подвержено воздействию самых разнообразных факторов окружающей среды(парниковый эффект- повышение температуры окружающей среды, экология, ГМО и др.). В зависимости от характера повреждения они подразделяются на:
1) спонтанные поврежения:
а) ошибки репликации- некомплементарные пары нуклеотидов.(А-Г, Т-Ц)(о механизме подробнее узнается на кафедре Химии и Биохимии);
б) апуринизация (отщепление азотистых оснований от сахаро-фосфатного остова - образование АР-сайтов). Не зацикливайтесь, поимёте со временем
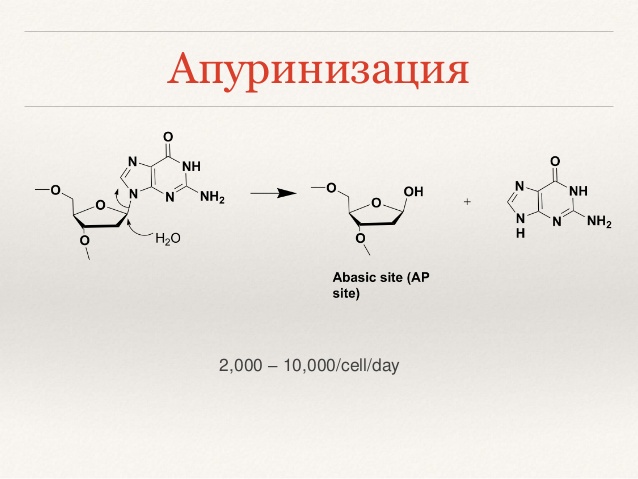 На картинках уловите то, что написано(основную суть) поимёте полностью потом.
На картинках уловите то, что написано(основную суть) поимёте полностью потом.
в) метилирование (алкилирование азотистых оснований )- присоединение СН3, С2Н5 и др.
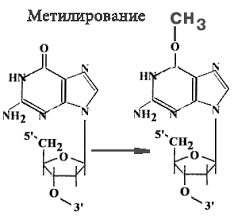 На рисунках, что видите это строение нуклеотида(не зацикливайтесь)
На рисунках, что видите это строение нуклеотида(не зацикливайтесь)
г) дезаминирование (отщепление аминогруппы от азотистого основания)
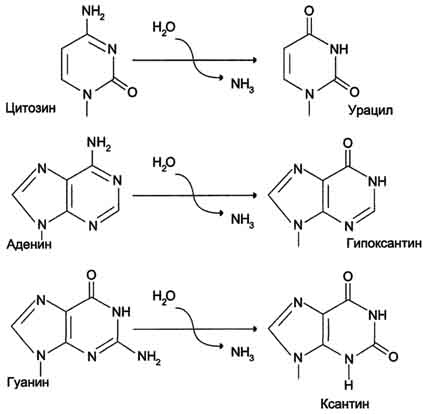
д) окисление(- Н2)
2) к индуцируемым:
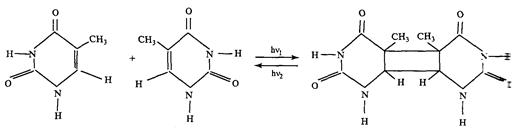
а) димеризация- сшивка соседних пиримидиновых оснований(Т, Ц, У).
б) размыкание пуринового кольца(к пуринам относятся А и Г):

в) однонитевые и двунитевые разрывы ДНК:

г) сшивки между цепями ДНК
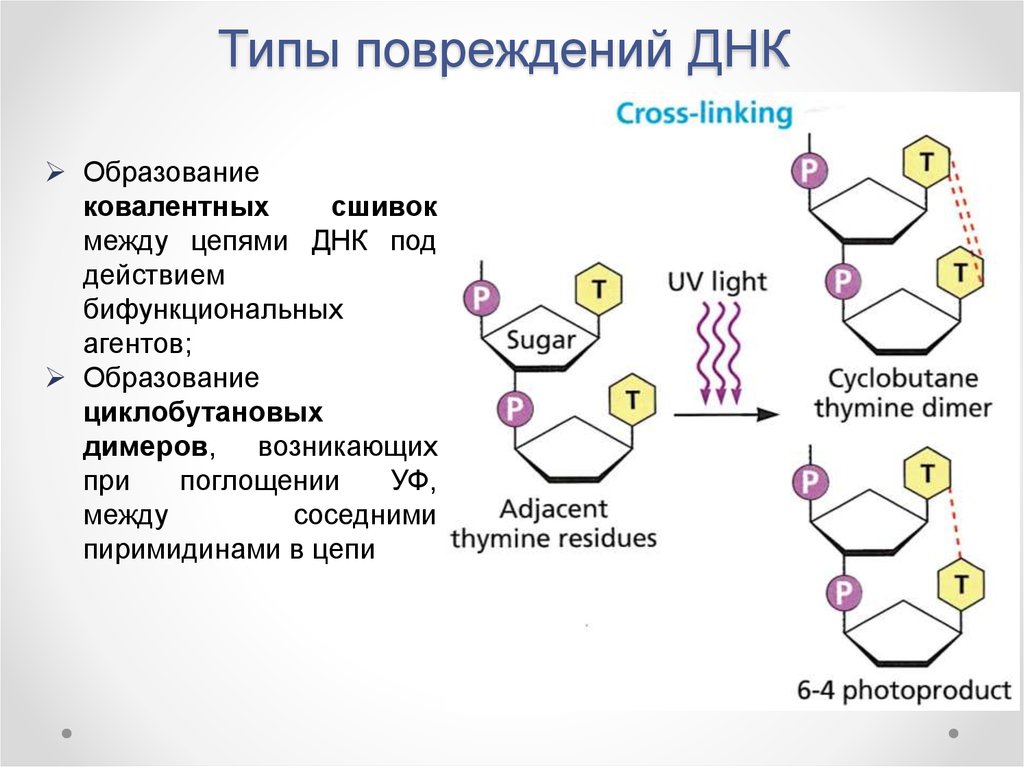
Как видите наше хрупкое ДНК подвержено стольки различным изменениям и всему этому противостоит репарация, и от того насколько хорошо она выполняет свои функции зависит наша жизнь. В этом процессе принимают участие более 150 генов.
Виды репарации:
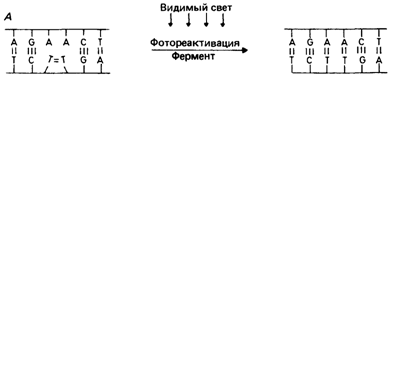
1) Фотореактивация(световая репарация). При длительном нахождении на солнце(ультрафиолетовое излучение) в нашей ДНК могут образовываться сшивки между соседними пиримидиновыми основаниями(Т=Т, Т=Ц), связь эта очень прочная и для её разрыва необходим фермент фотолиаза,которая активируется все тем же светом(как же все- таки парадоксально свет спровоцировал, накосячил, он и исправляет ошибку). Без света данный вид репарации невозможен!
2) Репарация О6- алкилированного гуанина.Мутация бывает из- за присоединения к азотистому основанию (в данном случае гуанину) метильной группы(СН3). Присоединяться может не только метил, но и этил(С2Н5), пропил(С3Н7), но и другие алкильные группы. Их подобная активность объясняется как вы знаете, я надеюсь, наличием активного на наружном слое 1 электрона, который активно ищет себе ещё 1 электрон для образования полноценной пары. Так вот метильная группа присоединяется к гуанину. Репарация в данном случае сводится к отщеплению этой ненужной группы. Осуществляется это благодаря ферменту метилтрансферазе. Причем их нужно 2, так как одна, захватив метильную группу не может от неё освободиться, в помощники ей выступает 2 метилтрансфераза. И если скорость повреждений больше скорости синтеза метилтрансфераз, то метилтрансферазы не успевают исправлять(отрывать СН3) все повреждения, вследствие чего те начинают накапливаться. Попробуйте представить , что дом- это вы, мутации- пули, они не смогут уничтожить дом сразу, постепенно пулевые отверстия будут становиться непомерно большими и дому наступит конец. Также с нашим организмом.
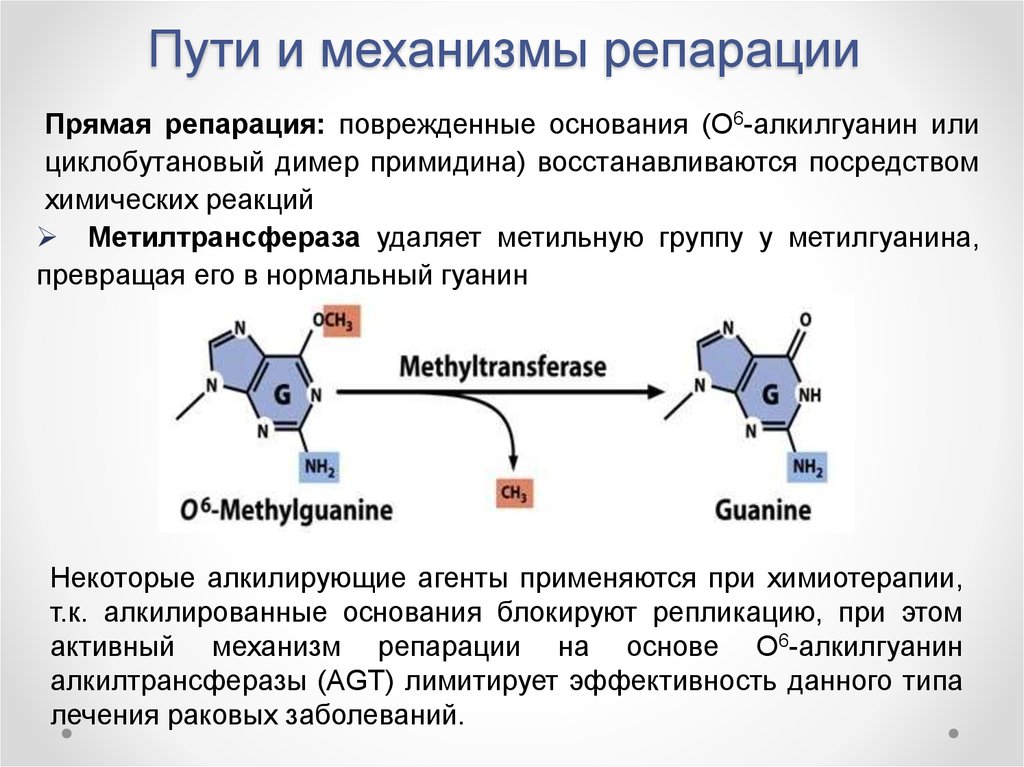
3) Репарация АП(апуриновых)- сайтов за счет прямой вставки пуринов.Вспомним строения нуклеотида. Как вы знаете, он состоит из азотистого основания, сахара дезоксирибозы и фосфатной группы(Н3РО4). При мутациях связь между(гликозидная) между азотистым основанием и сахаро- фосфорной группой может рваться и образуется АП- сайт. Репарация осуществляется благодаря ферменту инсертазе, которые могут вставлять в брешь такое же основание, что и было до повреждения. Вот и все.
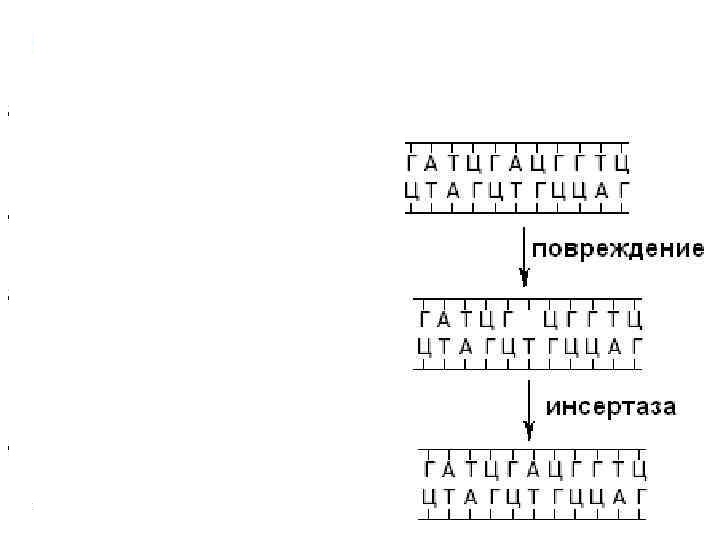
4) Эксцизионная репарация(темновая репарация)-более сложный вид репараций, требующий участия комплекса ферментов, а не одного. Она подразделяется на:
а) Эксцизионная репарация азотистых оснований- в отличие от прямой вставки пуринов здесь поврежденное основание необходимо вырезать. Осуществляется этот процесс благодаря ферменту гликозилазе, который рвет связь между модифицированным основание и сахаро- фосфатной группой и образуется АП- сайт. После удаляется и сахаро- фосфатная группа(сахар дезоксирибоза и фосфорная кислота) ферментом фосфодиэстеразойи в ДНК образуется брешь размером в 1 нуклеотид. Далее используя 2 неповрежденную цепь(точнее нуклеотид) в качестве матрицы(антимутационный барьер) и ДНК- полимераза(основной фермент репликации) вставляет в брешь комплементарный нуклеотиду 2 цепи нуклеотид, а лигаза соединяет этот нуклеотид с рядом расположенными в 1 цепи.
б) Эксцизионная репарация нуклеотидов.Отличается тем, что вырезается не 1 поврежденый нуклеотид, но и рядом расположенные неповрежденные. Вначале ДНК раскручивается в месте повреждения, после чего вырезается целый фрагмент(множество неповрежденных и 1 поврежденный ) одной цепи ДНК благодаря действию эндонуклеаз.Далее на основе неповрежденной цепи(матрица) достраивается 2 цепь благодаря ДНК-полимеразе, а лигазасшивает концы вновь синтезированных фрагментов с теми, что не вырезались и сохранились.
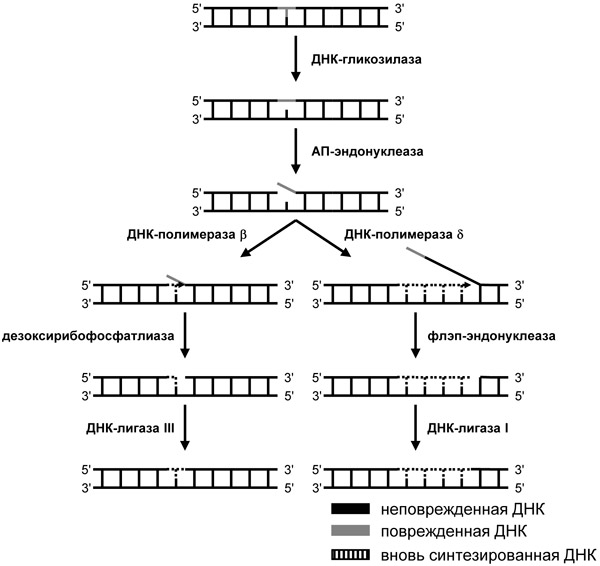
Справа- эксцизионная репарация нуклеотидов, слева- азотистых оснований.
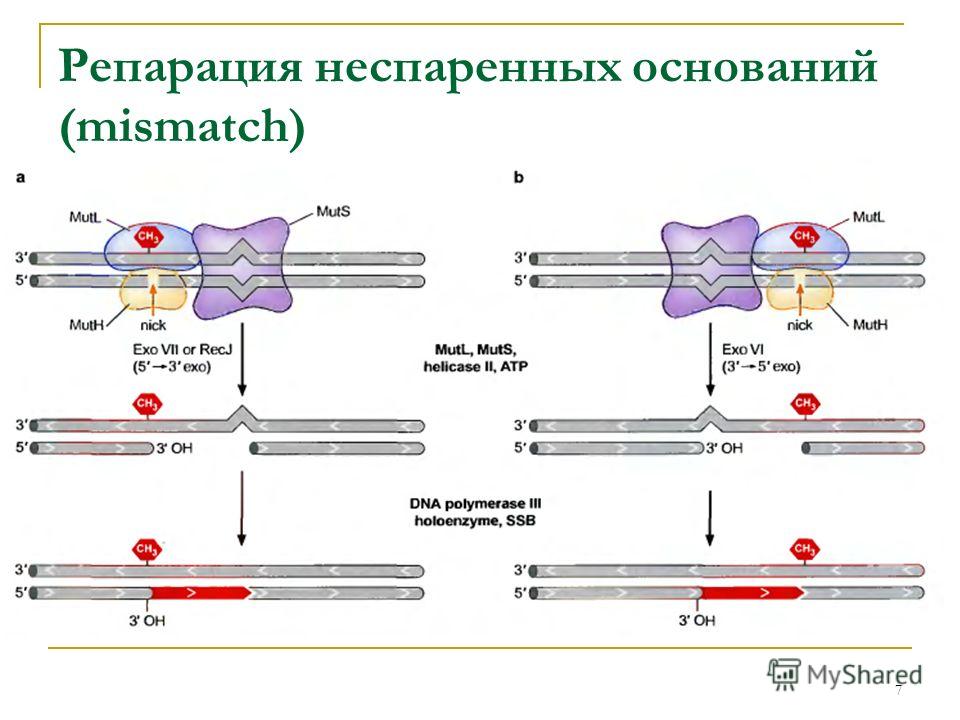
5) Репарация неспаренных оснований(мисмэтч- репарация).В данном случае дефект связан с ошибкой репликации- неправильный характер спаривания между собой нуклеотидов(А-Г, А-Ц, Ц-Т). Ошибки такого рода случаются в наших клетках очень часто и только в дочерних цепях(потому что они синтезируются), матричная же остается неизменной, вследствие чего ферменты репарации оперируют только на дочерней цепи. Но как отличить дочернюю цепь от материнской? Оказалось, что после окончания репликации к полностью синтезировавшейся цепи к А в последовательностях ГАТЦ присоединяются метильные группы и пока дочерняя цепь не успела метилироваться ферментам репарации необходимо успеть отрепарировать мисмэтчи. Осущестляется этот процесс благодаря белкам МUTH. MUTS, MUTL, MUTU.Вначале к некомплементарной паре нуклеотидов присоединяется MUTS, далее MUTL и 2 MUTH, образуя комплекс. Каждый из белков mutH распознает участок ГАТЦ и разрывает дочернюю нить около неметилированных аденинов в дочерней цепи. После к белку MUTH присоединяется экзонуклеаза и вместе они разрывают нить ДНК до места повреждения, пройдя даже несколько дальше. После чего ДНК- полимераза застраивает дочернюю цепь на матрице неповрежденной, лигаза сшивает концы вновь синтезированного правильного полностью фрагмента с неповрежденной.
6) Пострепликативная (рекомбинационная) репарация.Данный вид репарации осуществляется , если не срабатывает ни одна из вышеперечисленных систем репарации, вследствие чего в ДНК накапливается количество тиминовых димеров(матричная), а в цепи напротив из-за них(тиминовых димеров) остаются бреши(дочерняя). И эти бреши необходимо застроить. Осуществляется этот процесс благодаря белкам Rec- A.С их помощью с неповрежденной цепи ДНК (матричной) вырезается фрагмент, комплементарный матричной цепи и вставляется в брешь. Затем лигазы соединяют концы вставленного фрагмента с концами нормально синтезированного участка дочерней нити. Одновременно брешь, оставшаяся после вырезания участка из материнской нити, застраивается ДНК-полимеразой и концы соединяются лигазой.
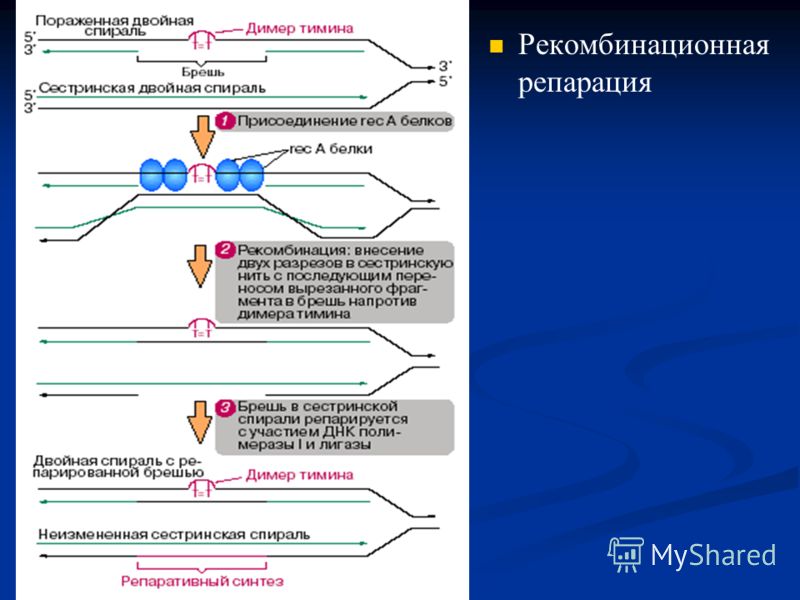
7) SOS-репарация.Данный вид репарации- как последняя надежда для клетки, к которой она цепляется, не понимая, что лучше смерть, чем SOS- репарация. Она срабатывает, если не работают все вышеперечисленные репарации(включая пострепликативную). При SOS- репарации индуцируется (провоцируется) синтез белков, которые «загрубляют» работу ДНК- полимеразного комплекса и репликация(синтез дочерней цепи) протекает с множеством разного рода ошибок. В результате SOS-репарации клетка спасается от гибели на этом этапе: ее ДНК оказывается удвоенной, хотя и с ошибками, и теперь может произойти клеточное деление, но если жизненно важные функции все-таки безнадежно испорчены, такая клетка все равно погибнет позже из-за неспособности правильно функционировать, что естественно будет намного лучше, но если возникшие мутации не окажут летального действия, клетка худо-бедно, но проживет и ее потомки будут нести уже теперь всегда наследственную память о пережитых некогда последствиях мутационной катастрофы. Несрабатывание систем репарации приводит к ряду заболеваний, носители которых долго не проживут.
Клеточный цикл. Митоз. Регуляция клеточного цикла.
Клеточный цикл- период существования клетки от момента её зарождения путем деления материнской клетки до смерти. Состоит клеточный цикл из 3 этапов:
1) Период покоя
2) Период деятельности
3) Митотический цикл- комплекс мер, направленных на осуществление деления.
Митотический цикл состоит из 2 этапов:
1) Подготовка к делению- интерфаза, которая также подразделяется на 3 этапа:
а) G1(пресинтетический, постмитотический)период- характеризуется высокой синтетической активностью (происходит активная транскрипция и трансляция), благодаря которой клетка вырастает до объема материнской клетки и выполняет свои функции. В конце G1-периода клетка проходит специальный этап (точка рестрикции, R-пункт), после которого она в течение нескольких часов вступает в S-период и изменить этого уже никак нельзя. Период времени между R-точкой и началом S-периода можно рассматривать в качестве подготовительного для перехода в S-период. Длительность- от 2–4 ч до нескольких недель или даже месяцев.
б) S(синтетический)-период- происходит репликация(удвоение молекулы ДНК). Генетический материал с этого момента 2n4c. Длительность- 6-8 часов.
в) G2(постсинтетический, премитотический) период- окончательный перед вступлением клетки в митоз. Характеризуется синтезом белков микротрубочек веретена деления и АТФ, необходимых для процесса митоза.
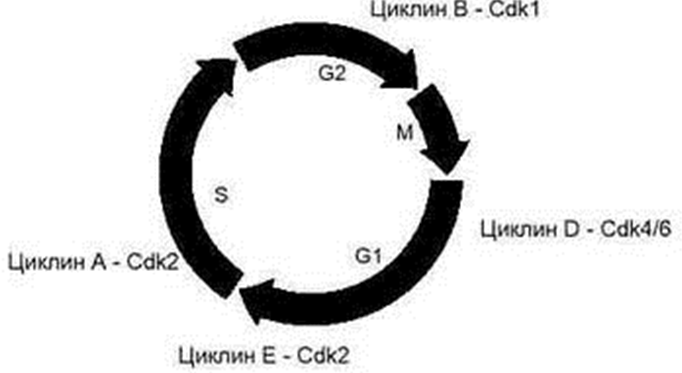
Что лежит в основе перехода одного периода в другой? Я никогда об этом не задумыывался в школьные годы. Оказалось действие специальных белков, называемых циклин- зависимыми протеинкиназами(ЦЗК). Их присутствие в клетках постоянно , но они не активны. Их активация осуществляется другим белком – циклином(активатор ЦЗК), присутствие которых в клетке непостоянно. Их синтез и разновидность синтеза зависит от периода клеточного цикла. Вместе комплекс циклин- ЦЗК на опреденных стадиях клеточного цикла индуцирует синтез регуляторных белков, контролирующие его протекание. За каждую фазу ответственен определенный циклин-ЦЗК.
Контроль уровня циклинов:
1) Фосфолирование/дефосфолирование определенных участок циклин- ЦЗК , при котором они могут быть либо активироованы, либо деактивированы.
2) Ингибирование супрессорными белками комплекса циклин-ЦЗК. Известно два семейства супрессорных белков:
а) семейство INK(p15,p16)- они препятствуют образованию комплекса циклин-ЦЗК, препятствуя раннему вступлению клетки в определенный период клеточного цикла.
б) семейство KIP(p21, p27,p57)- они разрушают уже образовавшийся комплекс циклин-ЦЗК.
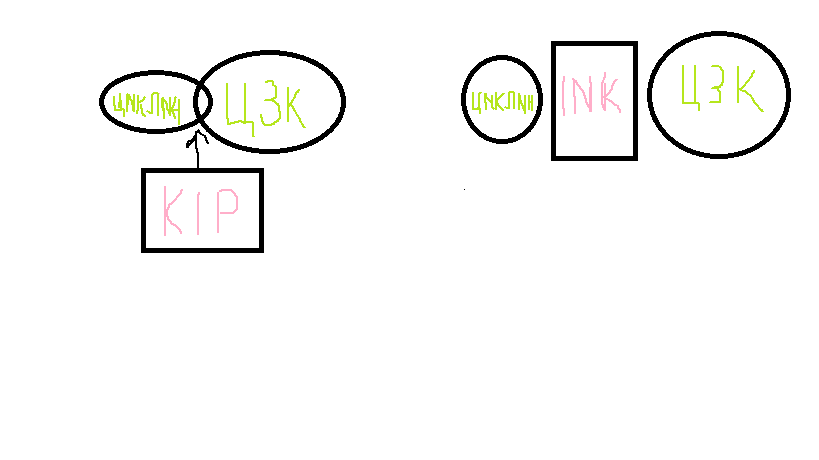
3) Путем регуляции транскрипции(когда один комплекс тормозит транскрипцию второго )
Для перехода клетки в G1- период необходима активация комплекса циклин D- ЦЗК 4(ЦЗК 6). Далее этот(вместе с циклин Е- ЦЗК2) активированный комплекс влечет за собой активацию гена путем фосфолирования рRb и снятию его ингибирующего(подавляющего) влияния на комплекс Е2F-DP. Этот комплекс- транскрипционный фактор для целого ряда генов, продукты(белки) которых необходимы для репликации ДНК в S- периоде. Одним из продуктов активации является циклин Е. Это имеет важное значение, так как во 2-ой половине G1-периода регулирующая роль переходит комплексу циклинЕ- ЦЗК2. Предыдущий комплекс циклин D- ЦЗК4(6) подавляется ингибиторными белками семейства KIP(p21, p27, p57). После начинается S- период. Регулятором выступает циклин А- ЦЗК2(предыдущий подавляется KIP). На этой стадии происходит репликация, ингибироваие комплекса циклин А- ЦЗК 2 и активация циклина В- ЦЗК1(его также называют митоз стимулирующим фактором(МСФ)) и переход в G2 и митоз непосредственно. Далее идет профаза, а за ней метафаза. Для перехода в анафазу необходимо необходимо разрушить комплекс циклин В-ЦЗК1. Осуществляется это ферментом убиквитин- лигазой(АРС- anaphase promoting complex). Разрушение МСФ создает возможность отхождения хроматид друг от друга и превращения каждой в хромосому.
Хотелось бы обратить ваше внимание на так называемые чекпойнты- точки, на которых контролируется нормальное осуществление всех периодов. Контроль осуществляется на 4 точках:
1) G1- контроль наличия одно или двунитевых разрывов, непраильное расхождение(сегрегация) хромосом в результате предыдущего деления и образования микроядер, нарушение числа хромосом.
2) S- контроль количества нуклеотидов на недостаток
3) G2- контроль на повреждение ДНК при репликации, осуществления её полностью и отсутствие недореплицировавшихся частей.
4) Метафаза митоза- контроль прикрепления веретен деления ко всем хромосомам

В результате проверки у клетки есть 3 дальнейших варианта развития событий:
1) Остановка митотического цикла для исправления обнаруженных повреждений, если такое возможно;
2) Безостановочный переход в следующую стадию клеточного цикла(опухолевые клетки)
3) Запуск механизмов апоптоза (запрогромированная гибель клеток(подробнее в следующей теме)), если повреждения неизлечимы(защита от опухолевых клеток).
Апоптоз – запрограммированная гибель клетки. Механизмы апоптоза
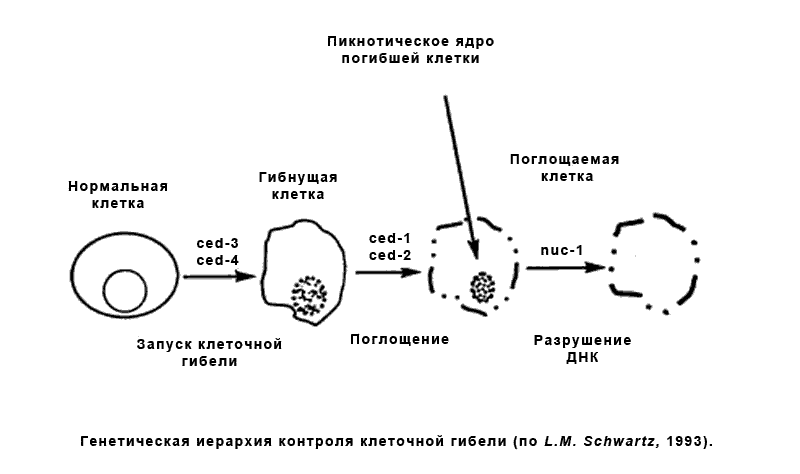
Всего клетки нашего организма могут самоуничтожаться 2 путями:
1) Некроз- незапрограмированная, индуцированная влиянием неблагоприятных условий среды гибель клетки
2) Апоптоз- запрограмированная гибель клетки.
Каждая клетка нашего организма имеет срок жизнедеятельности(при условии отсутствия опухолевых клеток(вспомните теломеразу)) и способна самоуничтожаться при условии наличия сильных повреждений генетического материала и провоцирования впоследствии активации внутренних генетических программ самоубийства(если это не срабатывает, то человек может заболеть раком). Ежедневно в организме человека погибает несколько десятков миллиардов клеток. Выделяют два вида программированной клеточной гибели:
1) Апоптоз «изнутри»- спровоцировать этот процесс может чрезмерное повреждения генетического материала(чрезмерное накопление неисправимых мутаций), повреждения других внутриклеточных органелл.
2) Апоптоз «по команде» - запускается при подаче сигнала «снаружи» через внутриклеточные рецепторы. Клетка в данном случае вполне даже жизнеспособна, но это все равно необходимо для общего блага организма(порой приходится чем- то жертвовать). Благодаря данному виду апоптоза у большинства людей на этой планете не сращены пальцы и пищеварительная система имеет вид полой трубки. Но , к сожалению, не у всех срабатывают механизм апоптоза, такие люди рождаются с такими болезнями, как атрезия(непроходимость) пищевода, кишечника, синдактилия(сращение пальцев).
Говоря об апоптозе в целом можно выделить 3 стадии:
1) Конденсация хроматина и некоторое сжатие клетки из- за сжатия цитоплазмы.
2) Фрагментация(разделения на несколько) ядра и цитоплазмы с образованием апоптозных телец
3) Фагоцитоз апоптозных телец соседними клетками в специальных органеллах, называемых фаголизосомами. Освободившееся в результате место заполняется путем митоза новой клеткой.
Теперь давайте разберем механизм поподробнее. Дело в том, что в наших клетках существует семейство цитоплазматических протеаз называемых каспазами(всего их 10).Их активация- признак апоптоза. В клетке они существуют в виде предшественников, называемых прокаспазами. Первой в ответ на сигнал, либо повреждение активируется каспаза 8. Далее из- за повреждения мембран митохондрий из неё высвобождаются AIF(Apopthose inducting factor), цитохром С и Apaf-1, которые в комплексе приводят к превращение неактивной прокаспазы 9 в активную каспазу 9. Каспаза 8 и 9 приводят к активации самой главной каспазы 3(узловая каспаза). Функцией этих каспаз является ограниченный протеолиз(разрушение) белковых мишеней, которые подразделяются на:
1) Цитоплазматические мишени:
а) фодрин- с его протеолизом связывают образование на поверхности клеточной мембраны впячиваний
б) актин- обеспечивающий внутриклеточный транспорт наряду с микротрубочками
в) регуляторные ферменты: фосфолипаза , протеинкиназа
2) Ядерные мишени:
а) ферменты репликации: топоизомераза, липаза, ДНК- полимераза и др.
б) белок ламин и гистон Н – их протеолиз приводит к конденсации(уплотнение) хроматина
в) ингибиторы эндонукеаз, следовательно их активация и протеолиз хромосом.
г) протеолиз белка рRb, снятие его ингибирующего(подавляющего) влияния на Е2F-DP, как вследствие вступление клетки в митоз при таки
Дата добавления: 2022-07-20; просмотров: 117;










