Расчёт работы т/д системы в газовых процессах
Необходимым условием совершения работы  силой
силой  является перемещение тела (вместе с точкой приложения силы) на расстояние
является перемещение тела (вместе с точкой приложения силы) на расстояние 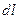 под действием этой силы:
под действием этой силы:  =
= 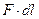 . Для расчёта работы газовых систем умножим и разделим правую часть последнего равенства на площадь S:
. Для расчёта работы газовых систем умножим и разделим правую часть последнего равенства на площадь S:  =
=  =
=  . Тогда работу, совершаемую газовой системой при переходе из состояния 1 (с объёмом
. Тогда работу, совершаемую газовой системой при переходе из состояния 1 (с объёмом 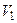 ) в состояние 2 (с
) в состояние 2 (с  ), можно рассчитать по формуле:
), можно рассчитать по формуле:  .
.
Таким образом, для различных изопроцессов, имеем:
1) При изохорическом ( 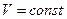 ) Þ
) Þ 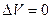 Þ
Þ 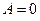 .
.
2) При изобарическом( 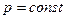 ) Þ
) Þ 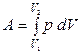 =
= 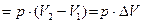 .
.
|
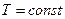 ). Пусть n= 1 моль. Тогда, элементарная работа системы
). Пусть n= 1 моль. Тогда, элементарная работа системы 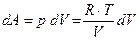 . Откуда получим:
. Откуда получим:
|

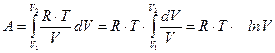 =
= 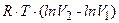 Þ
Þ 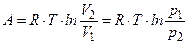 .
.
Причём, так как при изотермическом процессе 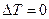 , то
, то 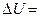
 =0, откуда
=0, откуда 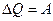 . Значит, что всё количество теплоты
. Значит, что всё количество теплоты 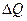 , сообщаемое газу, расходуется на совершение им работы. Поэтому, с точки зрения эффективности преобразования тепловой энергии в механическую работу, изотермический процесс является оптимальным.
, сообщаемое газу, расходуется на совершение им работы. Поэтому, с точки зрения эффективности преобразования тепловой энергии в механическую работу, изотермический процесс является оптимальным.
4) При адиабатическом ( 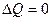 ) Þ
) Þ 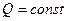 . Тогда из 1-го начала следует:
. Тогда из 1-го начала следует: 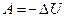 , т.е. система совершает работу за счёт своей внутренней энергии (принцип работы холодильника). При n = 1 моль, получим:
, т.е. система совершает работу за счёт своей внутренней энергии (принцип работы холодильника). При n = 1 моль, получим:
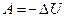
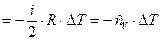 .
.
Работа, совершаемая газом при адиабатическом расширении из состояния 1 в состояние 2, меньше, чем при изотермическом переходе 1®2. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа (  >
> 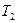 ), в то время как при изотермическом - температура поддерживается постоянной (
), в то время как при изотермическом - температура поддерживается постоянной (  =
= 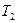 ) за счёт притока извне эквивалентного количества теплоты, которое и увеличивает совершённую газом работу.
) за счёт притока извне эквивалентного количества теплоты, которое и увеличивает совершённую газом работу.
6.4. Второе начало термодинамики. Тепловой двигатель
Т/д процесс называют круговым, если т/д система, пройдя через ряд состояний, возвращается в исходное. Следовательно, в результате кругового процесса полное изменение внутренней энергии 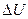 равно нулю. Поэтому для обратимого кругового процесса 1-е начало термодинамики имеет вид:
равно нулю. Поэтому для обратимого кругового процесса 1-е начало термодинамики имеет вид: 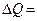 А, т.е. работа, совершаемая газом за цикл, равна количеству полученной извне теплоты. Реальные же круговые процессы (циклы) сопровождаются энергетическими потерями, поэтому для них справедливо неравенство A <
А, т.е. работа, совершаемая газом за цикл, равна количеству полученной извне теплоты. Реальные же круговые процессы (циклы) сопровождаются энергетическими потерями, поэтому для них справедливо неравенство A < 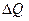 .
.
На плоскости 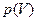 цикл изображают замкнутой кривой. Цикл можно разбить на процессы расширения (1®2) и сжатия (
цикл изображают замкнутой кривой. Цикл можно разбить на процессы расширения (1®2) и сжатия ( 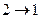 ). Работа газа при расширении (определяемая площадью фигуры под кривой
). Работа газа при расширении (определяемая площадью фигуры под кривой 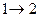 ) положительна, так как
) положительна, так как 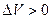 , работа газа при сжатии (определяемая площадью фигуры под кривой
, работа газа при сжатии (определяемая площадью фигуры под кривой 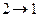 отрицательна, так как
отрицательна, так как 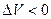 .
.
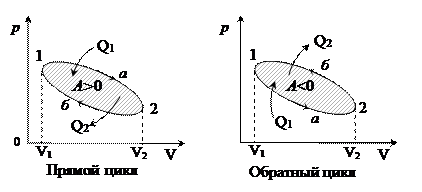
Следовательно, работа, совершаемая газом за цикл, определяется площадью, охватываемой замкнутой кривой 1а2б. Если за цикл совершается положительная работа A = 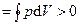 (цикл протекает на графике
(цикл протекает на графике 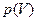 по часовой стрелке), то его называют прямым; если же за цикл совершается отрицательная работа
по часовой стрелке), то его называют прямым; если же за цикл совершается отрицательная работа 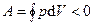 (цикл протекает на графике
(цикл протекает на графике 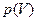 против часовой стрелки), то - обратным.
против часовой стрелки), то - обратным.
Прямой цикл используют в периодически действующих тепловых двигателях, совершающих работу за счёт полученной извне теплоты. Обратный цикл используется в периодически действующих холодильных машинах, в которых за счёт работы внешних сил теплота переносится от менее нагретых тел к телам с более высокой температурой.
В 1824 году французский инженер Сади Карно предложил наиболее эффективный круговой процесс (цикл Карно) для газа в тепловой машине. В цикле Карно рабочее тело (газ), совершив работу, возвращается в исходное состояние, используя только часть полученной извне в ходе цикла энергии. Поэтому для цикла Карно: 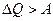 . Анализируя предложенный Карно цикл, английский физик У. Томсон в 1851 г. сформулировал второй закон (начало)термодинамики: "В природе невозможен круговой процесс, единственным результатом которого была бы механическая работа, полученная за счёт охлаждения горячего тела". Эта формулировка 2-го начала фактически утверждает, что взаимное превращение тепла и работы неравноценно: работу можно полностью превратить в тепло (путём трения, нагрева электрическим током и т.д.), а вот тепло полностью превратить в работу нельзя: часть тепла должна быть отдана в окружающую среду.
. Анализируя предложенный Карно цикл, английский физик У. Томсон в 1851 г. сформулировал второй закон (начало)термодинамики: "В природе невозможен круговой процесс, единственным результатом которого была бы механическая работа, полученная за счёт охлаждения горячего тела". Эта формулировка 2-го начала фактически утверждает, что взаимное превращение тепла и работы неравноценно: работу можно полностью превратить в тепло (путём трения, нагрева электрическим током и т.д.), а вот тепло полностью превратить в работу нельзя: часть тепла должна быть отдана в окружающую среду.
Машину, многократно и полностью превращающую тепло в работу, называют вечным двигателем второго рода. Второе начало термодинамики отвергает возможность создания такого двигателя.
Таким образом, невозможно создание не только циклически действующего устройства, совершающего работу больше сообщённой ему теплоты (вечного двигателя первого рода), но невозможно даже создать устройство, которое бы полностью превращало сообщённую ему теплоту в работу (вечный двигатель второго рода). То есть, второе начало утверждает, что КПД даже идеального теплового двигателя (в котором Fтр=0) меньше 100%.
Независимо от Томсона иную формулировку второго начала термодинамики дал в 1850 году немецкий физик Клаузиус: "Теплота не переходит самопроизвольно от менее к более нагретому телу ". Эта формулировка подчёркивает односторонность реальных процессов. Действительно, первое начало термодинамики не запрещает такой переход тепла (лишь бы выполнялся закон сохранения энергии), однако этого никогда не происходит. Известны иные примеры односторонности процессов: 1) тело, упавшее с некоторой высоты и нагревшееся в результате неупругого удара, не подпрыгивает до прежней высоты за счёт 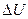 ; 2) газы перемешиваются в сосуде, но сами не разделяются; 3) сахар растворяется в воде, но не выделяется в виде куска; 4) можно нагреть проволоку от аккумулятора, но нельзя зарядить аккумулятор от нагретой проволоки.
; 2) газы перемешиваются в сосуде, но сами не разделяются; 3) сахар растворяется в воде, но не выделяется в виде куска; 4) можно нагреть проволоку от аккумулятора, но нельзя зарядить аккумулятор от нагретой проволоки.
Вывод: второе начало термодинамики не запрещает т/д процессов, удовлетворяющих закону сохранения энергии, оно только указывает направление протекания т/д процессов.
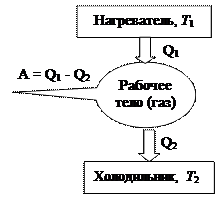 Таким образом, для создания циклического теплового двигателя нужны (как минимум) три компонента: нагреватель (с температурой
Таким образом, для создания циклического теплового двигателя нужны (как минимум) три компонента: нагреватель (с температурой 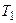 ), рабочее тело (превращающее теплоту в механическую работу) и холодильник (с температурой
), рабочее тело (превращающее теплоту в механическую работу) и холодильник (с температурой 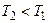 ), роль которого часто выполняет окружающая среда.
), роль которого часто выполняет окружающая среда.
Поскольку, согласно 2-му началу термодинамики, в результате протекания кругового процесса рабочее тело не только получает 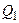 , но и отдаёт
, но и отдаёт 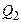 , то КПД (коэффициент полезного действия) циклического теплового двигателя равен:
, то КПД (коэффициент полезного действия) циклического теплового двигателя равен:
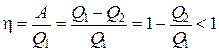 .
.
Цикл Карно
Анализируя работу тепловых двигателей, Карно в 1824 г. пришёл к выводу о том, что максимальный КПД может быть достигнут, если теплообмен между рабочим телом (газом) и внешними телами будет происходить при 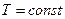 , а температура газа будет изменяться в процессе совершения работы (газом или над ним). Поскольку организовать круговой процесс, используя только изотермические процессы, невозможно, то Карно предложил цикл идеальной (не имеющей тепловых потерь) тепловой машины, состоящий из двух изотерм и
, а температура газа будет изменяться в процессе совершения работы (газом или над ним). Поскольку организовать круговой процесс, используя только изотермические процессы, невозможно, то Карно предложил цикл идеальной (не имеющей тепловых потерь) тепловой машины, состоящий из двух изотерм и  двух адиабат. На этапе (
двух адиабат. На этапе ( 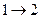 ) цилиндр тепловой машины приводят в контакт с нагревателем: газ в цилиндре получает тепло
) цилиндр тепловой машины приводят в контакт с нагревателем: газ в цилиндре получает тепло 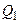 и, изотермически расширяясь при температуре нагревателя Т1, совершает работу. На этапе (
и, изотермически расширяясь при температуре нагревателя Т1, совершает работу. На этапе ( 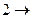 3) система термоизолирована, и газ продолжает расширяться, но теперь - адиабатически. При этом газ совершает работу за счёт своей внутренней энергии и его температура падает до температуры холодильника
3) система термоизолирована, и газ продолжает расширяться, но теперь - адиабатически. При этом газ совершает работу за счёт своей внутренней энергии и его температура падает до температуры холодильника 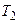 . На этапе (
. На этапе ( 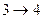 ) цилиндр с газом приводят в тепловой контакт с холодильником, которому газ отдаёт количество теплоты
) цилиндр с газом приводят в тепловой контакт с холодильником, которому газ отдаёт количество теплоты 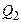 и изотермически сжимается при Т2 до объёма V4. На этапе (
и изотермически сжимается при Т2 до объёма V4. На этапе ( 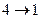 ) газ адиабатически сжимают, при этом его температура возрастает до значения
) газ адиабатически сжимают, при этом его температура возрастает до значения 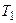 , и система возвращается в исходное состояние.
, и система возвращается в исходное состояние.
Применительно к циклу Карно, формулировка 2-го начала термодинамики, согласно Томсону, звучит так: невозможно создать циклический тепловой двигатель, который бы всё получаемое от нагревателя количество теплоты 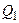 переводил бы в работу А, часть этого количества теплоты
переводил бы в работу А, часть этого количества теплоты 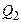 должна быть отдана холодильнику.
должна быть отдана холодильнику.
Применяя газовые законы и 1-е начало к каждому равновесному процессу цикла, можно получить формулу для расчёта КПД идеального теплового двигателя, работающего по циклу Карно: 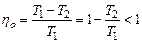 . Из этой формулы следует, что для повышения КПД теплового двигателя, работающего по циклу Карно, необходимо температуру холодильника Т2 брать как можно ниже, а температуру нагревателя Т1– как можно выше.
. Из этой формулы следует, что для повышения КПД теплового двигателя, работающего по циклу Карно, необходимо температуру холодильника Т2 брать как можно ниже, а температуру нагревателя Т1– как можно выше.
|
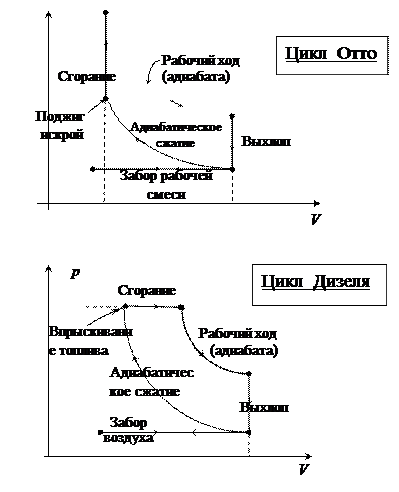
В реальных тепловых машинах реализация равновесных процессов потребовала бы бесконечно большого времени. Поэтому в реальных двигателях процессы неравновесны и их КПД h меньше КПД цикла Карно hо.
Кроме того, в реальных тепловых двигателях часто используют цикл Отто (двигатель внутреннего сгорания) или цикл Дизеля (с самовоспламенением горючей смеси) (рис. выше).
6.6. Энтропия(гр. Еntropia – превращение)
 Понятие энтропии введено в 1865 году Клаузиусом в ходе обоснования 2-го начала термодинамики. Для этого он ввёл понятие приведенного количества теплоты равное
Понятие энтропии введено в 1865 году Клаузиусом в ходе обоснования 2-го начала термодинамики. Для этого он ввёл понятие приведенного количества теплоты равное 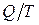 . При бесконечно малом изменении состояния системы (т.е. при равновесных процессах) приведенное количество теплоты равно
. При бесконечно малом изменении состояния системы (т.е. при равновесных процессах) приведенное количество теплоты равно  . Клаузиус доказал, что при любом круговом процессе:
. Клаузиус доказал, что при любом круговом процессе: 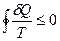 (неравенство Клаузиуса), где знак равенства - для обратимых, а неравенства - для необратимых процессов. Но с математической точки зрения неравенство Клаузиуса выполняется только в том случае, если подынтегральное выражение
(неравенство Клаузиуса), где знак равенства - для обратимых, а неравенства - для необратимых процессов. Но с математической точки зрения неравенство Клаузиуса выполняется только в том случае, если подынтегральное выражение  , с точностью до произвольной постоянной, является полным дифференциалом некоторой функции
, с точностью до произвольной постоянной, является полным дифференциалом некоторой функции 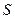 , т.е.
, т.е. 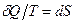 . Функция
. Функция 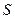 характеризует состояние системы и не зависит от пути, каким система пришла в это состояние. Функцию состояния
характеризует состояние системы и не зависит от пути, каким система пришла в это состояние. Функцию состояния 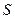 , дифференциал которой (в случае обратимых процессов) dS равен отношению
, дифференциал которой (в случае обратимых процессов) dS равен отношению  , называют энтропией.
, называют энтропией.
Вначале физический смысл энтропии был непонятен. Зато довольно просто истолковывалась разность энтропий двух состояний т/д системы 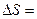
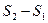 . Разность энтропий в двух равновесных состояниях 2и1равна приведенному количеству тепла, которое надо сообщить системе, чтобы перевести её из состояния1в состояние2по любому квазистатическому пути (т.е. равновесным образом):
. Разность энтропий в двух равновесных состояниях 2и1равна приведенному количеству тепла, которое надо сообщить системе, чтобы перевести её из состояния1в состояние2по любому квазистатическому пути (т.е. равновесным образом):
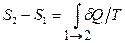 .
.
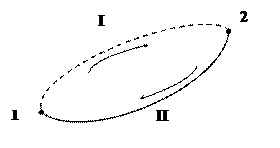 |
Выразим неравенство Клаузиуса через энтропию. Пусть система в результате необратимого процесса переходит из равновесного состояния1 в равновесное состояние2 (на рис. – пунктирная линия I). Вернём систему квазистатически из состояния 2 в состояние 1по пути II. На основании неравенства Клаузиуса имеем:
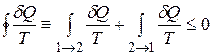 .
.
Так как процесс II – равновесный, то  = S1-S2. Поэтому неравенство принимает вид:
= S1-S2. Поэтому неравенство принимает вид: 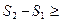
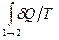 . Но в случае термоизолированной системы
. Но в случае термоизолированной системы  и интеграл в последнем неравенстве обращается в нуль. Таким образом:
и интеграл в последнем неравенстве обращается в нуль. Таким образом: 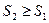
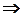
 , то есть, энтропия изолированной системы не может убывать: она либо возрастает (в случае необратимости процессов в системе),либо остаётся постоянной (в случае обратимости процессов).
, то есть, энтропия изолированной системы не может убывать: она либо возрастает (в случае необратимости процессов в системе),либо остаётся постоянной (в случае обратимости процессов).
Если же система обменивается теплотой с внешней средой (т.е. система не является изолированной), то её энтропия может вести себя любым образом.
Так как для адиабатического процесса  , то
, то 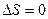 и, следовательно,
и, следовательно, 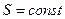 , т.е. обратимый адиабатический процесс протекает при постоянной энтропии. Поэтому такой процесс называют изоэнтропийным процессом.
, т.е. обратимый адиабатический процесс протекает при постоянной энтропии. Поэтому такой процесс называют изоэнтропийным процессом.
 Физический смысл энтропии был впервые объяснён австрийским физиком Больцманом. С этой целью он ввёл понятие т/д вероятности состояния системы
Физический смысл энтропии был впервые объяснён австрийским физиком Больцманом. С этой целью он ввёл понятие т/д вероятности состояния системы 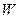 как числа способов, которыми может быть реализовано данное состояние. По мнению Больцмана, энтропия системы и т/д вероятность её определённого состояния связаны между собой следующим образом:
как числа способов, которыми может быть реализовано данное состояние. По мнению Больцмана, энтропия системы и т/д вероятность её определённого состояния связаны между собой следующим образом:  , где
, где 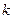 - постоянная Больцмана. Из формулы Больцмана следует, что чем больше способов реализации состояния системы, тем больше её энтропия в данном состоянии. Наиболее вероятным состоянием системы является состояние её равновесия (т/д равновесия), как состояние, характеризуемое минимумом потенциальной энергии взаимодействия частиц системы между собой. Но при т/д равновесии макроскопические параметры системы одинаковы и неизменны по всему объёму системы, т.е. в случае т/д равновесия система является однородной (неупорядоченной). Таким образом, можно утверждать,что энтропия является мерой неупорядоченности (однородности) системы.
- постоянная Больцмана. Из формулы Больцмана следует, что чем больше способов реализации состояния системы, тем больше её энтропия в данном состоянии. Наиболее вероятным состоянием системы является состояние её равновесия (т/д равновесия), как состояние, характеризуемое минимумом потенциальной энергии взаимодействия частиц системы между собой. Но при т/д равновесии макроскопические параметры системы одинаковы и неизменны по всему объёму системы, т.е. в случае т/д равновесия система является однородной (неупорядоченной). Таким образом, можно утверждать,что энтропия является мерой неупорядоченности (однородности) системы.
Физический же смысл возрастания энтропии следующий: коллектив частиц, образующих замкнутую систему и предоставленный самому себе, стремится перейти в такое состояние, в котором при данных условиях возможен наибольший беспорядок (т.е. система самопроизвольно переходит от менее вероятных состояний к более вероятным, осуществляемым бóльшим числом способов). Максимальная энтропия соответствует полному хаосу (полной однородности).
Итак, второе начало термодинамики можно сформулировать как закон возрастания энтропиизамкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Дата добавления: 2019-12-09; просмотров: 373;










