Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье
При внешнем воздействии на систему происходит смещение химического равновесия, т. е. изменяются равновесные концентрации исходных веществ и продуктов реакции. Если в результате внешнего воздействия увеличиваются равновесные концентрации продуктов реакции, то говорят о смещении равновесия вправо (в сторону прямой реакции). Если вследствие внешнего воздействия увеличиваются равновесные концентрации исходных веществ, то говорят о смещении равновесия влево (в сторону обратной реакции).
Влияние различных факторов на смещение химического равновесия отражает принцип Ле-Шателье (1884): если на систему, находящуюся в устойчивом химическом равновесии воздействовать извне, изменяя температуру, давление или концентрацию, то химическое равновесие смещается в том направлении, при котором эффект произведенного воздействия уменьшается.
Необходимо отметить, что катализатор не смещает химическое равновесие, а только ускоряет его наступление.
Рассмотрим влияние каждого фактора на смещение химического равновесия для реакции общего вида:
аA + вB = сC + dD ± Q.
Влияние изменения концентрации. Согласно принципу Ле-Шателье, увеличение концентрации одного из компонентов равновесной химической реакции приводит к сдвигу равновесия в сторону усиления той реакции, при которой происходит химическая переработка этого компонента. И наоборот, уменьшение концентрации одного из компонентов приводит к сдвигу равновесия в сторону образования этого компонента.
Таким образом, увеличение концентрации вещества А или В смещает равновесие в прямом направлении; увеличение концентрации вещества С или D смещает равновесие в обратном направлении; уменьшение концентрации А или В смещает равновесие в обратном направлении; уменьшение концентрации вещества С или D смещает равновесие в прямом направлении.
Влияние температуры. Общее правило, определяющее влияние температуры на равновесие, имеет следующую формулировку: повышение температуры способствует сдвигу равновесия в сторону эндотермической реакции (- Q); понижение температуры способствует сдвигу равновесия в сторону экзотермической реакции (+ Q).
Реакции, протекающие без тепловых эффектов, не смещают химического равновесия при изменении температуры. Повышение температуры в этом случае приводит лишь к более быстрому установлению равновесия, которое было бы достигнуто в данной системе и без нагревания, но за более длительное время.
Таким образом, в экзотермической реакции (+ Q) увеличение температуры приводит к сдвигу равновесия в обратном направлении и, наоборот, в эндотермической реакции (- Q) увеличение температуры приводит к сдвигу в прямом направлении, а уменьшение температуры – в обратном направлении.
Влияние давления. Как показывает опыт, давление оказывает заметное влияние на смещение только тех равновесных реакций, в которых участвуют газообразные вещества, и при этом изменение числа молей газообразных участников реакции (Δn) не равно нулю. При увеличении давления равновесие смещается в сторону той реакции, которая сопровождается образованием меньшего количества молей газообразных веществ, а при понижении давления – в сторону образования большего количества молей газообразных веществ.
Таким образом, если Δn = 0, то давление не влияет на смещение химического равновесия; если 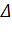 n < 0, то увеличение давления смещает равновесие в прямом направлении, уменьшение давления в сторону обратной реакции; если Δn > 0, то увеличение давления смещает равновесие в обратном направлении, а уменьшение давления – в сторону прямой реакции. Принцип Ле-Шателье применим как к гомогенным, так и к гетерогенным системам и дает качественную характеристику сдвига равновесия.
n < 0, то увеличение давления смещает равновесие в прямом направлении, уменьшение давления в сторону обратной реакции; если Δn > 0, то увеличение давления смещает равновесие в обратном направлении, а уменьшение давления – в сторону прямой реакции. Принцип Ле-Шателье применим как к гомогенным, так и к гетерогенным системам и дает качественную характеристику сдвига равновесия.
Свободная энергия и константа равновесия Для любого химического процесса общее соотношение между изменением свободной энергии при стандартных условиях ΔG0 и изменением свободной энергии при любых других условиях определяется выражением
ΔGT = ΔG0T + RT ln Q, (12) где R = 8,31 Дж/моль⋅K; Q – произведение концентраций, которое определяется формулой (9), но для неравновесных концентраций.
В состоянии равновесия ΔGT = 0, а Q должна совпадать с истинной константой равновесия К, тогда формула (12) преобразуется:
ΔG0T = −RT⋅lnKр, или ΔG0 T = −2,3RT⋅lgKр. (13)
Выражения (12)−(13) носят название уравнений Вант-Гоффа. Если стандартное состояние определено при 298 К, то уравнение (13) может быть записано в следующем виде: 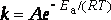
где k – константа скорости реакции; А – предэкспоненциальный множитель; е – основание натурального логарифма; Еа – постоянная, называемая энергией активации, определяемая природой реакции. Значения Еа для химических реакций лежат в пределах 40 – 400 кДж/ моль.
После логарифмирования уравнение имеет вид
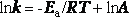
Если представить графическую зависимость lnk = f(1/T), то она имеет вид (рис 3).
Здесь tgα = -Еа/R и Еа = - Rtgα. Отрезок, отсекаемый на оси ординат равен lnА.
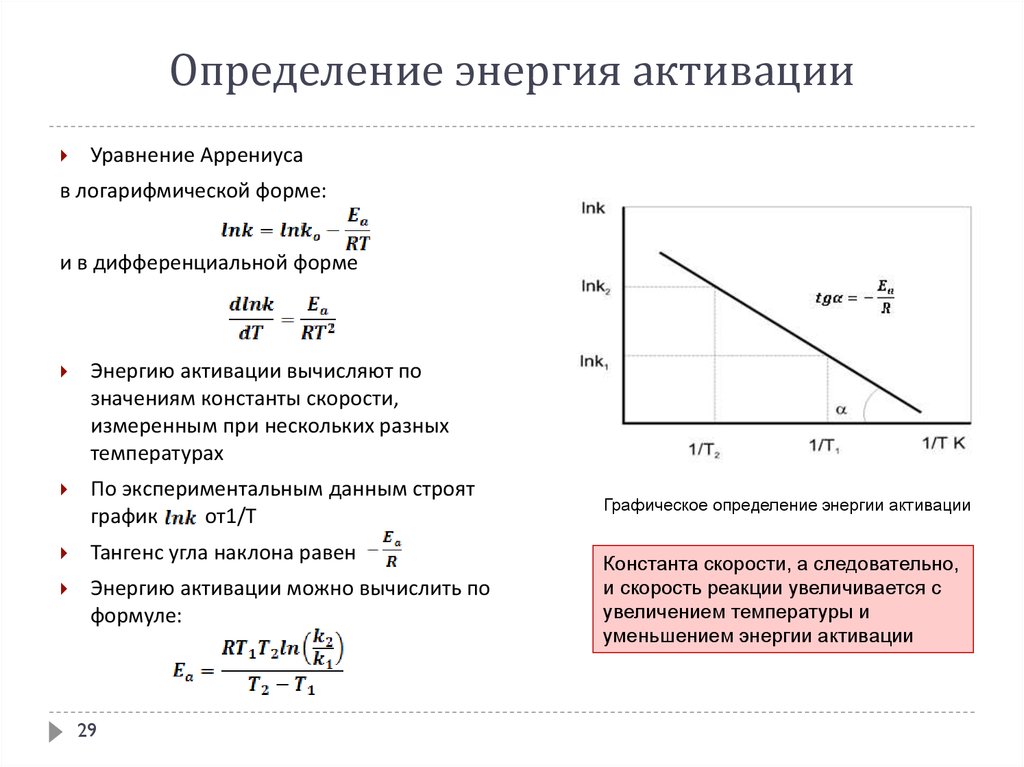
Рис.3 Определение энергии активации
Рассчитав величину ΔG0298 химической реакции, можно определить константу равновесия. Из уравнения (13) следует, что если величина ΔG0 отрицательна, то lgК должен быть положительным, что, в свою очередь, означает, что К >1. И наоборот, если ΔG0 > 0, то К<1.
Химическая термодинамика дает сведения о возможности протекания реакции, но важно знать и скорость того или иного процесса.
Дата добавления: 2021-02-19; просмотров: 138;










