МЕТОДЫ ЛУЧЕВОЙ ТЕРАПИИ
Методы лучевой терапии делятся на наружные и внутренние в зависимости от способа подведения ионизирующего излучения к облучаемому очагу. Сочетание методов называют сочетанной лучевой терапией.
Наружные методы облучения — методы, при которых источник излучения находится вне организма. К наружным методам относятся методы дистанционного облучения на различных установках с использованием разного расстояния от источника излучения до облучаемого очага.
К наружным методам облучения относятся:
— дистанционная у-терапия;
— дистанционная, или глубокая, рентгенотерапия;
— терапия тормозным излучением высокой энергии;
— терапия быстрыми электронами;
— протонная терапия, нейтронная и терапия другими ускоренными частицами;
— аппликационный метод облучения;
— близкофокусная рентгенотерапия (при лечении злокачественных опухолей кожи).
Дистанционная лучевая терапия может проводиться в статическом и подвижном режимах. При статическом облучении источник излучения неподвижен по отношению к больному. К подвижным методам облучения относятся ротационно-маятниковое или секторное тангенциальное, рота-ционно-конвергентное и ротационное облучение с управляемой скоростью. Облучение может осуществляться через одно поле или быть многопольным — через два, три и более полей. При этом возможны варианты встречных или перекрестных полей и др. Облучение может проводиться открытым пучком или с использованием различных формирующих устройств — защитных блоков, клиновидных и выравнивающих фильтров, решетчатой диафрагмы.
При аппликационном методе облучения, например в офтальмологической практике, аппликаторы, содержащие радионуклиды, прикладывают к патологическому очагу.
Близкофокусную рентгенотерапию применяют для лечения злокачественных опухолей кожи, при этом расстояние от выносного анода до опухоли составляет несколько сантиметров.
Внутренние методы облучения — методы, при которых источники излучения вводят в ткани или в полости организма, а также применяют в виде радиофармацевтического препарата, введенного внутрь пациента.
К внутренним методам облучения относятся:
— внутриполостное облучение;
— внутритканевое облучение;
— системная радионуклидная терапия.
При проведении брахитерапии источники излучения с помощью специальных устройств вводятся в полые органы методом последовательного введения эндостата и источников излучения (облучение по принципу afterloading). Для осуществления лучевой терапии опухолей разных локализаций существуют различные эндостаты: метрокольпостаты, метрастаты, кольпостаты, проктостаты, стомататы, эзофагостаты, бронхостаты, цитоста-ты. В эндостаты поступают закрытые источники излучения, радионуклиды, заключенные в оболочку-фильтр, в большинстве случаев имеющие форму цилиндров, игл, коротких стерженьков или шариков.
При радиохирургическом лечении установками гамма-нож, кибер-нож осуществляют прицельное облучение малых мишеней с помощью специальных стереотаксических устройств с использованием точных оптических направляющих систем для трехмерной (three-dimensional — 3D) радиотерапии множественными источниками.
При системной радионуклидной терапии используют радиофармацевтические препараты (РФП), вводимые пациенту внутрь, соединения, тропные к определенной ткани. Например, путем введения радионуклида йода проводят лечение злокачественных опухолей щитовидной железы и метастазов, при введении остеотропных препаратов — лечение метастазов в кости.
Виды лучевого лечения. Различают радикальную, паллиативную и симптоматическую цели лучевой терапии. Радикальную лучевую терапию проводят с целью излечения больного с применением радикальных доз и объемов облучения первичной опухоли и зон лимфогенного метастазирования.
Паллиативное лечение, направленное на продление жизни больного путем уменьшения размеров опухоли и метастазов, выполняют меньшими, чем при радикальной лучевой терапии, дозами и объемами облучения. В процессе проведения паллиативной лучевой терапии у части больных при выраженном положительном эффекте возможно изменение цели с увеличением суммарных доз и объемов облучения до радикальных.
Симптоматическую лучевую терапию проводят с целью снятия каких-либо тягостных симптомов, связанных с развитием опухоли (болевой синдром, признаки сдавления сосудов или органов и др.), для улучшения качества жизни. Объемы облучения и суммарные дозы зависят от эффекта лечения.
Лучевую терапию проводят с различным распределением дозы облучения во времени. В настоящее время применяют:
— однократное облучение;
— фракционированное, или дробное, облучение;
— непрерывное облучение.
Примером однократного облучения служит протонная гипофизэктомия, когда лучевую терапию выполняют за один сеанс. Непрерывное облучение происходит при внутритканевом, внутри полостном и аппликационном методах терапии.
Фракционированное облучение является основным методом подведения дозы при дистанционной терапии. Облучение проводят отдельными порциями, или фракциями. Применяют различные схемы фракционирования дозы:
— обычное (классическое) мелкое фракционирование — 1,8—2,0 Гр в день 5 раз в неделю; СОД (суммарная очаговая доза) — 45—60 Гр в зависимости от гистологического вида опухоли и других факторов;
— среднее фракционирование — 4,0—5,0 Гр в день 3 раза в неделю;
— крупное фракционирование — 8,0—12,0 Гр в день 1—2 раза в неделю;
— интенсивно-концентрированное облучение — 4,0—5,0 Гр ежедневно в течение 5 дней, например в качестве предоперационного облучения;
— ускоренное фракционирование — облучение 2—3 раза в сутки обычными фракциями с уменьшением суммарной дозы за весь курс лечения;
— гиперфракционирование, или мультифракционирование — дробление суточной дозы на 2—3 фракции с уменьшением дозы за фракцию до 1,0—1,5 Гр с интервалом 4—6 ч, при этом продолжительность курса может не измениться, но суммарная доза, как правило, повышается;
— динамическое фракционирование — облучение с различными схемами фракционирования на отдельных этапах лечения;
— сплит-курсы — режим облучения с длительным перерывом на 2—4 нед в середине курса или после достижения определенной дозы;
— низкодозный вариант фотонного тотального облучения тела — от 0,1— 0,2 Гр до 1—2 Гр суммарно;
— высокодозный вариант фотонного тотального облучения тела от 1—2 Гр до 7—8 Гр суммарно;
— низкодозный вариант фотонного субтотального облучения тела от 1—1,5 Гр до 5—6 Гр суммарно;
— высокодозный вариант фотонного субтотального облучения тела от 1—3 Гр до 18—20 Гр суммарно;
— электронное тотальное или субтотальное облучение кожи в различных режимах при ее опухолевом поражении.
Величина дозы за фракцию имеет большее значение, чем общее время курса лечения. Крупные фракции более эффективны, чем мелкие. Укрупнение фракций при уменьшении их числа требует уменьшения суммарной дозы, если не изменяется общее время курса.
Различные варианты динамического фракционирования дозы хорошо разработаны в МНИОИ имени П. А. Герцена. Предложенные варианты оказались гораздо эффективнее, чем классическое фракционирование или подведение равных укрупненных фракций. При проведении самостоятельной лучевой терапии или в плане комбинированного лечения используют изо-эффективные дозы при плоско клеточном и аденогенном раке легкого, пищевода, прямой кишки, желудка, гинекологических опухолях, саркомах мягких тканей. Динамическое фракционирование существенно повысило эффективность облучения за счет увеличения СОД без усиления лучевых реакций нормальных тканей.
Величину интервала при сплит-курсе рекомендуется сокращать и до 10— 14 дней, так как репопуляция выживших клоновых клеток появляется в начале 3-й недели. Тем не менее при расщепленном курсе улучшается переносимость лечения, особенно в случаях, когда острые лучевые реакции препятствуют проведению непрерывного курса. Исследования показывают, что выживающие клоногенные клетки развивают настолько высокие темпы репопуляции, что для компенсации каждый дополнительный день перерыва требует прибавки примерно 0,6 Гр.
При проведении лучевой терапии используют методы модификации радиочувствительности злокачественных опухолей. Радиосенсибилизация лучевого воздействия — процесс, при котором различные способы приводят к увеличению поражения тканей под влиянием облучения. Радиопротекция — действия, направленные на снижение поражающего эффекта ионизирующего излучения.
Оксигенотерапия — метод оксигенации опухоли во время облучения с использованием для дыхания чистого кислорода при обычном давлении.
Оксигенобаротерапия — метод оксигенации опухоли во время облучения с использованием для дыхания чистого кислорода в специальных барокамерах под давлением до 3—4 атм.
Использование кислородного эффекта при оксигенобаротерапии, по данным СЛ. Дарьяловой, было особенно эффективно при лучевой терапии недифференцированных опухолей головы и шеи.
Регионарная турникетная гипоксия — метод облучения больных со злокачественными опухолями конечностей в условиях наложения на них пневматического жгута. Метод основан на том, что при наложении жгута р02 в нормальных тканях в первые минуты падает почти до нуля, а в опухоли напряжение кислорода еще некоторое время остается значительным. Это дает возможность увеличить разовую и суммарную дозы облучения без повышения частоты лучевых повреждений нормальных тканей.
Гипоксическая гипоксия — метод, при котором до и во время сеанса облучения пациент дышит газовой гипоксической смесью (ГГС), содержащей 10 % кислорода и 90 % азота (ГГС-10) или при уменьшении содержания кислорода до 8 % (ГГС-8). Считается, что в опухоли имеются так называемые ос-трогипоксические клетки. К механизму возникновения таких клеток относят периодическое, длящееся десятки минут резкое уменьшение — вплоть до прекращения — кровотока в части капилляров, которое обусловлено в числе других факторов повышенным давлением быстрорастущей опухоли. Такие острогипоксические клетки радиорезистентны, в случае наличия их в момент сеанса облучения они «ускользают» от лучевого воздействия. В РОНЦ РАМН этот метод применяют с обоснованием, что искусственная гипоксия снижает величину предсуществующего «отрицательного» терапевтического интервала, который определяется наличием гипоксических радиорезистентных клеток в опухоли при их практически полном отсутствии в нормальных тканях. Метод необходим для защиты высокочувствительных к лучевой терапии нормальных тканей, расположенных вблизи облучаемой опухоли.
Локальная и общая термотерапия. Метод основан на дополнительном разрушительном воздействии на опухолевые клетки. Обоснован метод перегревом опухоли, который происходит в связи со сниженным кровотоком по сравнению с нормальными тканями и замедлением вследствие этого отвода тепла. К механизмам радиосенсибилизирующего эффекта гипертермии относят блокирование ферментов репарации облученных макромолекул (ДНК, РНК, белки). При комбинации температурного воздействия и облучения наблюдается синхронизация митотического цикла: под воздействием высокой температуры большое число клеток одновременно вступает в наиболее чувствительную к облучению фазу G2. Наиболее часто применяют локальную гипертермию. Существуют аппараты «ЯХТА-3», «ЯХТА-4», «PRI-MUS и+Я»для микроволновой (СВЧ) гипертермии с различными датчиками для прогревания опухоли снаружи или с введением датчика в полости (см. рис. 20, 21 на цв. вклейке). Например, для прогревания опухоли предстательной железы используют ректальный датчик. При СВЧ-гипертермии с длиной волны 915 МГц в предстательной железе автоматически поддерживается температура в пределах 43—44 °С в течение 40—60 мин. Облучение следует сразу за сеансом гипертермии. Имеется возможность для одновременной лучевой терапии и гипертермии («Гамма Мет», Англия). В настоящее время считается, что по критерию полной регрессии опухоли эффективность термолучевой терапии в полтора-два раза выше, чем при проведении только лучевой терапии.
Искусственная гипергликемия приводит к снижению внутриклеточного рН в опухолевых тканях до 6,0 и ниже при очень незначительном уменьшении этого показателя в большинстве нормальных тканей. Кроме того, гипергликемия в условиях гипоксии ингибирует процессы пострадиационного восстановления. Считается оптимальным одновременное или последовательное проведение облучения, гипертермии и гипергликемии.
Электронакцепторные соединения (ЭАС) — химические вещества, способные имитировать действие кислорода (его сродство с электроном) и избирательно сенсибилизировать гипоксические клетки. Наиболее употребительными ЭАС являются метронидазол и мизонидазол, особенно при локальном применении в растворе диметилсульфоксида(ДМСО), что позволяет при создании в некоторых опухолях высоких концентраций препаратов существенно улучшить результаты лучевого лечения.
Для изменения радиочувствительности тканей применяют также препараты, не связанные с кислородным эффектом, например ингибиторы репарации ДНК. К числу таких препаратов относятся 5-фторурацил, галои-дированные аналоги пуриновых и пиримидиновых оснований. В качестве сенсибилизатора применяют обладающий противоопухолевой активностью ингибитор синтеза ДНК-оксимочевину. К ослаблению пострадиационного восстановления ведет также прием противоопухолевого антибиотика акти-номицина Д. Ингибиторы синтеза ДНК могут быть использованы для вре-
Глава 4
менной искусственной синхронизации деления опухолевых клеток с целью последующего их облучения в наиболее радиочувствительных фазах мито-тического цикла. Определенные надежды возлагаются на применение фактора некроза опухолей.
Применение нескольких агентов, изменяющих чувствительность опухолевой и нормальной тканей к облучению, называется полирадиомодифика-цией.
Комбинированные методы лечения — сочетание в различной последовательности хирургического вмешательства, лучевой терапии и химиотерапии. При комбинированном лечении лучевую терапию проводят в виде пред- или послеоперационного облучения, в некоторых случаях используют интраоперационное облучение.
Целями предоперационного курса облучения являются уменьшение опухоли для расширения границ операбельности, особенно при опухолях больших размеров, подавление пролиферативной активности опухолевых клеток, уменьшение сопутствующего воспаления, воздействие на пути регионарного метастазирования. Предоперационное облучение приводит к уменьшению числа рецидивов и возникновения метастазов. Предоперационное облучение является сложной задачей в плане решения вопросов уровня доз, методов фракционирования, назначения сроков операции. Для нанесения серьезных повреждений опухолевым клеткам необходимо подведение высоких туморицидныхдоз, что увеличивает риск послеоперационных осложнений, так как в зону облучения попадают здоровые ткани. В то же время операция должна быть проведена вскоре после окончания облучения, так как выжившие клетки могут начать размножаться — это будет клон жизнеспособных радиорезистентных клеток.
Поскольку преимущества проведения предоперационного облучения в определенных клинических ситуациях доказаны по увеличению показателей выживаемости больных, уменьшению числа рецидивов, необходимо четко соблюдать принципы проведения такого лечения. В настоящее время предоперационное облучение проводят укрупненными фракциями при дневном дроблении дозы, используются схемы динамического фракционирования, что позволяет провести предоперационное облучение в короткие сроки с интенсивным воздействием на опухоль с относительным щажением окружающих тканей. Операцию назначают через 3—5 дней после интенсивно-концентрированного облучения, через 14 дней после облучения с использованием схемы динамического фракционирования. Если предоперационное облучение проводят по классической схеме в дозе 40 Гр, приходится назначать операцию через 21—28 дней после стихания лучевых реакций.
Послеоперационное облучение проводятся в качестве дополнительного воздействия на остатки опухоли после нерадикальных операций, а также для уничтожения субклинических очагов и возможных метастазов в регионарных лимфатических узлах. В тех случаях, когда операция является первым этапом противоопухолевого лечения, даже при радикальном удалении опухоли, облучение ложа удаленной опухоли и путей регионарного метастазирования, а также всего органа может существенно повысить результаты лечения. Следует стремиться к началу проведения послеоперационного облучения не позднее чем через 3—4 нед после операции.
При интраоперационном облучении больного, находящегося под наркозом, подвергают однократному интенсивному лучевому воздействию через открытое операционное поле. Применение такого облучения, при котором здоровые ткани просто механически отодвигаются из зоны предполагаемого облучения, позволяет повысить избирательность лучевого воздействия при местно распространенных новообразованиях. С учетом биологической эффективности подведение однократных доз от 15 до 40 Гр эквивалентны 60 Гр и более при классическом фракционировании. Еще в 1994г. на V Международном симпозиуме в Лионе при обсуждении проблем, связанных с ин-траоперационным облучением, были приняты рекомендации об использовании 20 Гр в качестве максимальной дозы для снижения риска лучевых повреждений и возможности проведения в дальнейшем при необходимости дополнительного наружного облучения.
Лучевую терапию чаще всего применяют в качестве воздействия на патологический очаг (опухоль) и области регионарного метастазирования. Иногда используют системную лучевую терапию — тотальное и субтотальное облучение с паллиативной или симптоматической целью при генерализации процесса. Системная лучевая терапия позволяет добиться регресса очагов поражения у пациентов с резистентностью к химиопрепаратам.
Глава 5
ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ ЛУЧЕВОЙ ТЕРАПИИ
5.1. АППАРАТЫ ДЛЯ ДИСТАНЦИОННОЙ ЛУЧЕВОЙ ТЕРАПИИ
5.1.1. Рентгенотерапевтические аппараты
Рентгенотерапевтические аппараты для дистанционной лучевой терапии разделяются на аппараты для дальнедистанционной и близкодистанцион-ной (близкофокусной) лучевой терапии. В России дальнедистанционное облучение проводят на аппаратах типа «РУМ-17», «Рентген ТА-Д», в которых рентгеновское излучение генерируется напряжением на рентгеновской трубке от 100 до 250 кВ. Аппараты имеют набор дополнительных фильтров из меди и алюминия, комбинация которых при разных напряжениях на трубке позволяет индивидуально для разной глубины патологического очага получить необходимое качество излучения, характеризуемое слоем половинного ослабления. Используют эти рентгенотерапевтические аппараты для лечения неопухолевых заболеваний. Близкофокусная рентгенотерапия осуществляется на аппаратах типа «РУМ-7», «Рентген-ТА», которые генерируют низкоэнергетическое излучение от 10 до 60 кВ. Применяют для лечения поверхностных злокачественных опухолей.
Основными аппаратами для проведения дистанционного облучения являются гамма-терапевтические установки различной конструкции («Агат-Р», «Агат-С», «Рокус-М», «Рокус-АМ») и ускорители электронов, которые генерируют тормозное, или фотонное, излучение с энергией от 4 до 20 МэВ и электронные пучки разной энергии. На циклотронах генерируют нейтронные пучки, протоны ускоряют до больших энергий (50—1000 МэВ) на синхрофазотронах и синхротронах.
5.1.2. Гамма-терапевтические аппараты
В качестве радионуклидных источников излучения для дистанционной гамма-терапии чаще всего используют 60Со, а также l36Cs. Период полураспада 60Со составляет 5,271 года. Дочерний нуклид 60Ni является стабильным.
Источник помещают внутрь радиационной головки гамма-аппарата, которая создает надежную защиту в нерабочем состоянии. Источник имеет форму цилиндра диаметром и высотой 1—2 см. Корпус аппарата изготав
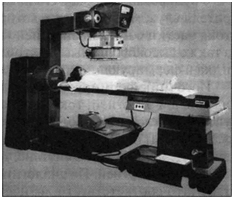 |
ливают из нержавеющей стали, внутри помещают активную часть источника в виде набора дисков. Радиационная головка обеспечивает выпуск, формирование и ориентацию пучка у-излучения в рабочем режиме. Аппараты создают значительную мощность дозы на расстоянии десятков сантиметров от источника. Поглощение излучения вне заданного поля обеспечивается диафрагмой специальной конструкции. Существуют аппараты для статичес-
кого и подвижного облучения. В пос- Рис. 22. Гамма-терапевтический ап-леднем случае источник излучения, парат для дистанционного облучения больной или оба одновременно в про- рОкус"м цессе облучения движутся относительно друг друга по заданной и контролируемой программе. Дистанционные аппараты бывают статические (например, «Агат-С»), ротационные («Агат-Р», «Агат-Р1», «Агат-Р2» — секторное и круговое облучение) и конвергентные («Рокус-М», источник одновременно участвует в двух согласованных круговых движениях во взаимно перпендикулярных плоскостях) (рис. 22).
В России (Санкт-Петербург), например, выпускается гамма-терапевтический ротационно-конвергентный компьютеризированный комплекс «Рокус-АМ». При работе на этом комплексе можно осуществлять ротационное облучение с перемещением радиационной головки в пределах 0-^360° с открытым затвором и остановкой в заданных позициях по оси ротации с минимальным интервалом в 10°; использовать возможность конвергенции; проводить секторное качание с двумя и более центрами, а также применять сканирующий способ облучения при непрерывном продольном движении лечебного стола с возможностью перемещения радиационной головки в секторе по оси эксцентричности. Необходимыми программами обеспечиваются: дозное распределение в облучаемом пациенте с оптимизацией плана облучения и распечаткой задания на расчеты параметров облучения. С помощью системной программы контролируют процессы облучения, управления, обеспечения безопасности проведения сеанса. Форма полей, создаваемых аппаратом, прямоугольная; пределы изменения размеров поля от 2,0х2,0ммдо 220 х 260 мм.
5.1.3. Ускорители частиц
Ускоритель частиц — это физическая установка, в которойс помощьюэлект-рическихи магнитных полей получают направленные пучки электронов, протонов, ионов и других заряженных частиц с энергией, значительно превышающей тепловую энергию. В процессе ускорения повышаются скорости частиц. Основная схема ускорения частиц предусматривает три стадии: 1) формирование пучка и его инжекцию; 2) ускорение пучка и 3) вывод пучка на мишень или осуществление соударения встречных пучков в самом ускорителе.
Формирование пучка и его инжекция. Исходным элементом любого ускорителя служит инжектор, в котором имеется источник направленного потока частиц с низкой энергией (электронов, протонов или других ионов), а также высоковольтные электроды и магниты, выводящие пучок из источника и формирующие его.
Источник формирует пучок частиц, который характеризуется средней начальной энергией, током пучка, его поперечными размерами и средней угловой расходимостью. Показателем качества инжектируемого пучка служит его эмиттанс, то есть произведение радиуса пучка на его угловую расходимость. Чем меньше эмиттанс, тем выше качество конечного пучка частиц с высокой энергией. По аналогии с оптикой ток частиц, деленный на эмиттанс (что соответствует плотности частиц, деленной на угловую расходимость), называют яркостью пучка.
Ускорение пучка. Пучок формируется в камерах или инжектируется в одну или несколько камер ускорителя, в которых электрическое поле повышает скорость, а следовательно, и энергию частиц.
В зависимости от способа ускорения частиц и траектории их движения установки подразделяют на линейные ускорители, циклические ускорители, микротроны. В линейных ускорителях частицы ускоряются в волноводе с помощью высокочастотного электромагнитного поля и движутся прямолинейно; в циклических ускорителях происходит ускорение электронов на постоянной орбите с помощью возрастающего магнитного поля, и движение частиц происходит по круговым орбитам; в микротронах ускорение происходит на спиральной орбите.
Линейные ускорители, бетатроны и микротроны работают в двух режимах: в режиме вывода пучка электронов с диапазоном энергии 5—25 МэВ и в режиме генерирования тормозного рентгеновского излучения с диапазоном энергии 4—30 МэВ.
К циклическим ускорителям относятся также синхротроны и синхроциклотроны, в которых получают пучки протонов и других тяжелых ядерных частиц в диапазоне энергии 100—1000 МэВ. Протонные пучки получены и используются в крупных физических центрах. Для дистанционной нейтронной терапии используют медицинские каналы циклотронов и ядерных реакторов.
Пучок электронов выходит из вакуумного окна ускорителя через коллиматор. В дополнение к этому коллиматору непосредственно около тела пациента существует еще один коллиматор, так называемый аппликатор. Он состоит из набора диафрагм из материалов с малым атомным номером, чтобы уменьшить возникновение тормозного излучения. Аппликаторы имеют разные размеры для установки и ограничения поля облучения.
Электроны высоких энергий меньше рассеиваются в воздухе, чем фотонное излучение, однако требуют дополнительных средств для выравнивания интенсивности пучка в его сечении. К таковым относятся, например, выравнивающие и рассеивающие фольги из тантала и профилированного алюминия, которые помещают за первичным коллиматором.
Тормозное излучение генерируется при торможении быстрых электронов в мишени из материала с большим атомным номером. Пучок фотонов формируется коллиматором, расположенным непосредственно за мишенью, и диафрагмой, которая ограничивает поле облучения. Средняя энергия фотонов максимальна в переднем направлении. Устанавливаются выравнивающие фильтры, так как мощность дозы в сечении пучка неоднородна.
В настоящее время созданы линейные ускорители с многолепестковыми коллиматорами для проведения конформного облучения (см. рис. 23 на цв. вклейке). Конформное облучение проводится с контролем положения коллиматоров и различных блоков с помощью компьютерного управления при создании фигурных полей сложной конфигурации. Конформное лучевое воздействие требует обязательного применения трехмерного планирования облучения (см. рис. 24 на цв. вклейке). Наличие многолепесткового коллиматора с подвижными узкими лепестками позволяет блокировать часть радиационного пучка и формировать необходимое поле облучения, причем положение лепестков меняется под управлением компьютера. В современных установках можно осуществлять непрерывную регулировку формы поля, то есть можно менять положение лепестков в процессе вращения пучка, чтобы сохранять облучаемый объем. С помощью этих ускорителей появилась возможность создавать максимальное по величине падение дозы на границе опухоли и окружающей здоровой ткани.
Дальнейшие разработки позволили выпустить ускорители для выполнения современного облучения с модулированной интенсивностью. Интенсивно модулированное облучение — облучение, при котором существует возможность создавать не только радиационное поле любой требуемой формы, но и осуществлять облучение с различной интенсивностью во время одного и того же сеанса. Дальнейшие усовершенствования позволили осуществлять радиотерапию, корректируемую по изображениям. Созданы специальные линейные ускорители, в которых планируется высокопрецизионное облучение, при этом лучевое воздействие контролируется и корректируется в процессе сеанса путем осуществления флюороскопии, радиографии и объемной компьютерной томографии на конусном пучке. Все диагностические конструкции вмонтированы в линейный ускоритель.
Благодаря постоянно контролируемой позиции больного на лечебном столе линейного ускорителя электронов и контролю над смещением изо-дозного распределения на экране монитора уменьшается риск ошибок, связанных с движением опухоли во время дыхания и постоянно происходящего смещения ряда органов.
В России для проведения облучения больных используют различные виды ускорителей. Отечественный линейный ускоритель ЛУЭР-20 (НИ-ИФА, Санкт-Петербург) характеризуется граничной энергией тормозного излучения 6 и 18 MB и электронов 6—22 МэВ. НИИФА по лицензии фирмы Philips производит линейные ускорители СЛ-75-5МТ, которые укомплектованы дозиметрическим оборудованием и планирующей компьютерной системой. Существуют ускорители PRIMUS (Siemens), многолепестковый Л УЭ Clinac (Varian) и др. (см. рис. 25 на цв. вклейке).
Установки для адронной терапии. Первый в Советском Союзе медицинский протонный пучок с необходимыми для лучевой терапии параметрами был соз-
Глава 5
дан по предложению В. П. Джелепова на фазотроне 680 МэВ в Объединенном институте ядерных исследований в 1967г. Клинические исследования проводились специалистами Института экспериментальной и клинической онкологии АМН СССР. В конце 1985 г. в лаборатории ядерных проблем ОИЯИ было завершено создание шестикабииного клинико-физического комплекса, включающего в себя: три протонных канала медицинского назначения для облучения глубокозалегающих опухолей широкими и узкими протонными пучками различной энергии (от 100 до 660 МэВ); л-мезонный канал медицинского назначения для получения и использования в лучевой терапии интенсивных пучков отрицательных л-мезонов с энергиями от 30 до 80 МэВ; канал сверхбыстрых нейтронов медицинского назначения (средняя энергия нейтронов в пучке около 350 МэВ) для облучения больших резистентных опухолей.
Центральным научно-исследовательским рентгенорадиологическим институтом и Петербургским институтом ядерной физики (ПИЯФ) РАН разработан и реализован метод протонной стереотаксической терапии с использованием узкого пучка протонов высокой энергии (1000 МэВ) в сочетании с ротационной техникой облучения на синхроциклотроне (см. рис. 26 на цв. вклейке). Достоинством данного метода облучения «напролет» является возможность четкой локализации зоны облучения внутри объекта, подвергаемого протонной терапии. При этом обеспечиваются резкие границы облучения и высокое отношение радиационной дозы в центре облучения к дозе на поверхности облучаемого объекта. Метод применяется при лечении различных заболеваний головного мозга.
В России в научных центрах Обнинска, Томска и Снежинска ведутся клинические испытания терапии быстрыми нейтронами. В Обнинске в рамках сотрудничества Физико-энергетического института и Медицинского радиологического научного центра РАМН (МРНЦ РАМН) до 2002г. использовался горизонтальный пучок реактора мощностью 6 МВт со средней энергией нейтронов около 1,0 МэВ. В настоящее время начато клиническое использование малогабаритного нейтронного генератора ИНГ-14.
В Томске на циклотроне У-120 НИИ ядерной физики сотрудниками НИИ онкологии используются быстрые нейтроны со средней энергией 6,3 МэВ. С 1999 г. проводится нейтронная терапия в Российском ядерном центре г. Снежинска с использованием нейтронного генератора НГ-12, дающего пучок нейтронов 12—14 МэВ.
5.2. АППАРАТЫ ДЛЯ КОНТАКТНОЙ ЛУЧЕВОЙ ТЕРАПИИ
Для контактной лучевой терапии, брахитерапии имеется серия шланговых аппаратов разной конструкции, позволяющих автоматизированным способом размещать источники вблизи опухоли и осуществлять ее прицельное облучение: аппараты серии «Агат-В», «Агат-ВЗ», «Агат-ВУ», «Агам» с источниками у-излучения 60Со (или 137Cs, l92lr), «Микроселектрон» (Nucletron) с источником 1921г, «Селектрон» с источником 137Cs, «Анет-В» с источником смешанного гамма-нейтронного излучения 252Cf (см. рис. 27 на цв. вклейке).
Это аппараты с полуавтоматическим многопозиционным статическим облучением одним источником, перемещающимся по заданной программе внутри эндостата. Например, аппарат гамма-терапевтический внутриполостной многоцелевой «Агам» с комплектом жестких (гинекологических, урологических, стоматологических) и гибких (желудочно-кишечных) эндостатов в двух вариантах применения — в защитной радиологической палате и каньоне.
Используются закрытые радиоактивные препараты, радионуклиды, помещенные в аппликаторы, которые вводят в полости. Аппликаторы могут быть в виде резиновой трубки либо специальными металлическими или пластиковыми (см. рис. 28 на цв. вклейке). Существует специальная радиотерапевтическая техника для обеспечения автоматизированной подачи источника в эндостаты и их автоматический возврат в специальный контейнер-хранилище по окончании сеанса облучения.
В комплект аппарата типа «Агат-ВУ» входят метрастаты небольшого диаметра — 0,5 см, что не только упрощает методику введения эндостатов, но и позволяет довольно точно формировать распределение дозы в соответствии с формой и размерами опухоли. В аппаратах типа «Агат-ВУ» три малогабаритных источника высокой активности 60Со могут дискретно перемещаться с шагом в 1 см по траекториям длиной 20см каждая. Использование малогабаритных источников приобретает важное значение при небольших объемах и сложных деформациях полости матки, так как позволяет избежать осложнений, например перфорации при инвазивных формах рака.
К преимуществам применения l37Cs гамма-терапевтического аппарата «Селектрон» средней мощности дозы (MDR — Middle Dose Rate) относится более длительный, чем у 60Со, период полураспада, что позволяет проводить облучение в условиях почти постоянной мощности дозы излучения. Существенным является также расширение возможностей широкого варьирования пространственным дозным распределением благодаря наличию большого числа излучателей сферической или малогабаритной линейной формы (0,5 см) и возможности чередования активных излучателей и неактивных имитаторов. В аппарате происходит пошаговое перемещение линейных источников в диапазоне мощностей поглощенных доз 2,53—3,51 Гр/ч.
Внутриполостная лучевая терапия с использованием смешанного гамма-нейтронного излучения 252Cf на аппарате «Анет-В» высокой мощности дозы (HDR — High Dose Rate) расширила диапазон применения, в том числе для лечения радиорезистентных опухолей. Комплектация аппарата «Анет-В» метрастатами трехканального типа с использованием принципа дискретного перемещения трех источников радионуклида 252Cf позволяет формировать суммарные изодозные распределения путем использования одной (с неравным временем экспонирования излучателя в определенных позициях), двумя, тремя или более траекториями перемещения источников излучения в соответствии с реальной длиной и формой полости матки и церви-кального канала. По мере регрессии опухоли под влиянием лучевой терапии и уменьшения длины полости матки и цервикального канала существует коррекция (уменьшение длины излучающих линий), что способствует снижению радиационного воздействия на окружающие нормальные органы.
Наличие системы компьютерного планирования контактной терапии позволяет проводить клинико-дозиметрический анализ для каждой конкретной ситуации с выбором дозного распределения, наиболее полно соответствующего форме и протяженности первичного очага, что позволяет снижать интенсивность лучевого воздействия на окружающие органы.
Выбор режима фракционирования разовых суммарных очаговых доз при использовании источников средней (MDR) и высокой (HDR) активности осно
| <== предыдущая лекция | | | следующая лекция ==> |
| Возможности препроцессора и его вызов | | | ОПРЕДЕЛЕНИЕ УДАРНОЙ ВЯЗКОСТИ МАТЕРИАЛОВ |
Дата добавления: 2016-09-26; просмотров: 8297;










