Законы газовой динамики
Физические и физиологические особенности подводных погружений. Основные законы газо- и гидродинамики
Воздух и его свойства
Состав воздуха
Давление воздуха
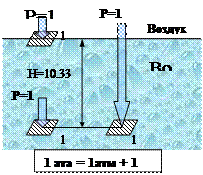
Масса воздуха, составляющая атмосферу Земли, оказывает своим весом на ее поверхность определенное давление, которое называется атмосферным. Измеренное на уровне моря при температуре 0°С атмосферное давление уравновешивается в трубке сечением 1 см2 барометра столбом ртути высотой 760мм или столбом воды высотой 10,33 м, что соответствует давлению на 1 см2 поверхности с силой 1,033 кгс (или 10,1325Н). Эта величина носит название физической атмосферы (атм).
1 атм = 760 мм рт.ст. = 10,33 м вод.ст. = 1,033 кгс/см2 = 101325 Н/м2
Атмосферное давление (барометрическое), равное 1 атм, называется нормальным.
В технике для удобства расчетов за единицу давления принимается техническая атмосфера (ат), что соответствует давлению на 1 см2 поверхности силы в 1 кгс, или 1 Н на 1 м2 (в системе СИ):
1 ат = 1 кгс/см2 = 10s Н/м2 = 10 м вод.ст.,
 т.е. одна техническая атмосфера соответствует давлению10 м водяного столба (в честь французского ученого 17 века Б.Паскаляединицадавления 1 Н/м2 называется паскалем - обозначается Па).
т.е. одна техническая атмосфера соответствует давлению10 м водяного столба (в честь французского ученого 17 века Б.Паскаляединицадавления 1 Н/м2 называется паскалем - обозначается Па).
Давление сверх атмосферного называется избыточнымдавлением.Избыточное давление измеряется манометрами, и поэтому часто оно называется манометрическим давлением.Сумма избыточного и атмосферного давлений называетсяабсолютным давлением.
| Рабс = Ризб + Ратм где: |
| (1) |
|
Рабс - абсолютное давление (измеряется в технических атмосферах и обозначается ата - атмосфера техническая абсолютная).Для упрощенных расчетов атмосферное давление рассчитается постоянным и равным 1 атм, тогда
Рабс = Ризб+1атм (2)
Таким образом, на каждые 10 метров глубины погружения избыточное давление увеличивается на1 атм (1кгс/см2).
Состояние любого газа или газовой смеси определяется четырьмяосновными параметрами, объемом V,давлением р, температурой Т, массой М, которые находятся во взаимозависимости, определяемой рассмотренныминиже газовыми законами.
Законы газовой динамики
Закон Бойля-Мариотта.(Изотермическийпроцесс). Для данной массы газа М при постоянной температуреТ его объемобратно пропорционален давлению р:
pV = const (3)
Иными словами, справедливы равенства
p1V1=p2V2 или
p1/p2=V2/V1 (4) 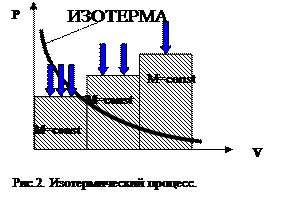
где:
р1,р2. - соответственно начальное и конечное давление газа;
V1, V2- - соответственно начальный и конечный объем газа.
Проще говоря,во сколько раз увеличивается давление, во столько раз уменьшается объём.Пользуясь этим законом,можно понять, почему с ростом глубины погружениявозрастает расход воздухадля дыхания подводного пловца, а также рассчитать время пребывания подводой.
Закон Шарля(Изохорный процесс). Для данной массы газаМ припостоянном объёмеV обеление р прямо пропорциональноизменению абсолютной температурыТ:
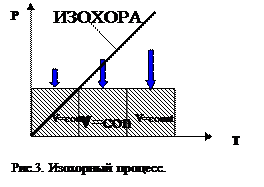 pt = p0apT (5)
pt = p0apT (5)
где:
pt - давление газа при абсолютной температуре Т;
р0 - давление газа при температуре 0°С;
ap - температурный коэффициент давления газов, равный 1/273 К-1;
Т - абсолютная температура газа, К (по шкале Кельвина).
Закон Гей-Люссака (Изобарный процесс).Для данной массыгаза М припостоянном давлении р объем газа V прямо пропорционален изменению его абсолютной температурыТ:
VT=V0aVT (6)
где:
VT- объем газа при абсолютной температуреТ;
V0 - объем газа при температуре 0 0С;
Т - абсолютная температура газа, К;
 aV -температурный коэффициент объемного расширениягазов,равный 1/273 К-1.
aV -температурный коэффициент объемного расширениягазов,равный 1/273 К-1.
Часто для решения практических задач удобнее зависимости (5) и (6) выражать в виде:
p1/р2 = Т1/T2 (7)
V1/V2=Т1/T2 (8)
где:
p1И р2- начальное и конечное давление газовпри постоянном объеме;
V1 и V2-начальный и конечный объем газов при постоянном давлении;
Т1 и T2 - начальная и конечная абсолютные температурыгазов.Абсолютная температура Т по шкале Кельвина (К) итемпература t по шкале Цельсия (°С) связаны между собой соотношением:
Т = t + 273 (9)
Приведенные зависимости, выражающие законы Шарля и Гей-Люссака, позволяют решать важные практические задачи при подготовке и планировании подводных погружений, такие, например, как определение давления воздуха в баллонах при изменении температуры, соответствующие ему изменение запасов воздуха и времени пребывания на данной глубине и т. п.
Закон Дальтона. Давление смеси газов равно сумме парциальных (частичных) давлений отдельных газов, составляющих смесь, т.е. тех давлений, которые производил бы каждыйгаз в отдельности, еслибыон был взят при той же температуре в объеме смеси.
Парциальное давление газа рг, пропорционально процентному содержанию n данного газа и величине абсолютного давления рабс газовой смеси и определяется по формуле:
рг = рабс n/100 (10)
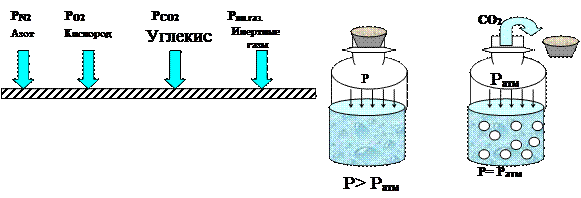 |
Рис. 5 Парциальное давление газов. Рис б. Иллюстрация закона Генри
Проиллюстрировать данный закон можно,сравнив смесь газов в замкнутом объеме с набором гирь различного веса, положенных на весы. Очевидно, что каждая из гирь будет оказывать давление на чашу весов независимо от наличия на ней других гирь.
Закон Генри.Количество газа, растворенного в жидкости, прямопропорционально его парциальному давлению.
Поскольку парциальное давление отражаетфактическое количествогаза,поступающего в организм, знание парциальныхдавлений газов всмеси позволяет правильно оценить действие этих газов, сильно изменяющееся в зависимости от величиныабсолютного давления рабс.
Дата добавления: 2022-04-12; просмотров: 220;










