Теоретическая часть
Химическая кинетика и катализ
Исследование реакции второго порядка
Цель работы
Получение навыков проведения кинетического эксперимента, построения кинетических кривых, вывода кинетических уравнений реакций различного порядка, расчета по кинетическим уравнениям, оценки погрешности эксперимента.
Теоретическая часть
Реакция йодирования ацетона протекает по уравнению:
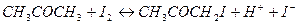
В кислой среде процесс протекает автокаталитически, т.е. происходит ускорение одним из продуктов реакции (ионами водорода). В нейтральной среде реакция идет очень медленно.
В кислой среде йодирование ацетона протекает в две стадии:
1) обратимая реакция энолизации ацетона
H+
CH3 – C – CH3 ↔ CH3 – C = CH2
|| |
O OH
2) взаимодействие йода с энольной формой
CH3 – C = CH2 + I2 → CH3 – C – CH2I + H+ + I-
| ||
OH O
Первая реакция протекает медленно, вторая быстро и практически до конца. В последовательных реакциях скорость всего процесса определяется скоростью самой медленной, «лимитирующей» стадии. Поэтому скорость реакции йодирования ацетона определяется скоростью второй стадии – взаимодействие йода с энольной формой и, следовательно, зависят от концентрации ацетона и ионов водорода, но не от концентрации йода. В результате, реакция протекает по второму порядку и подчиняется следующим уравнениям:
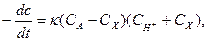 (1)
(1)
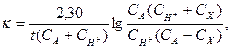 (2)
(2)
где СA и CH+ - начальные концентрации, соответственно ацетона и ионов водорода;
Cx – концентрация ацетона, превратившегося за время t от начала реакции;
t – время от начала реакции до данного измерения.
Дата добавления: 2020-07-18; просмотров: 284;










