Апоптоз и продолжительность жизни
Еще в 1982 г. было предположено, что старение может быть следствием плейотропного эффекта группы генов, несущих информацию о программированной гибели клетки (апоптозе, рис. 8.3.3.). С одной стороны, эта программа необходима для развития и функционирования многоклеточного организма, с другой - она делает неизбежной гибель клеток у взрослого организма. В таком случае старение может являться следствием постепенной убыли функционально активных клеток.
Возможны два способа участия апоптоза в процессе старения:
1. При помощи апоптоза устраняются поврежденные стареющие клетки (например, фибробласты, гепатоциты), которые затем могут быть заменены путем клеточной пролиферации, таким образом, сохраняется тканевой гомеостаз.
2. Путем апоптоза происходит элиминация постмитотических клеток (например, нейронов, кардиомиоцитов), которые не могут быть заменены, что ведет к патологии.
Интенсивные исследования паттерна апоптоза при старении выявили множество примеров возрастзависимой дерегуляции этого процесса и показали некоторые механизмы, лежащие в основе этого изменения. Была
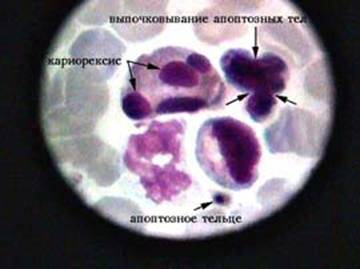
Рис. 8.3.3. Апоптоз клеток. Стрелки указывают на клетки, подвергающиеся в данный момент апоптозу.
также выявлена их связь с различными старческими патологиями. Как оказалось, старение многих типов клеток ассоциировано с изменением их чувствительности к апоптозу. Наибольшее количество типов клеток характеризуется возрастзависимым повышением чувствительности к индукции апоптоза: гепатоциты, Т-клетки, ооциты, мегакариоциты, макрофаги, хондроциты-эндотелиоциты, нейроны, спленоциты, кардиомиоциты. В то же время показано, что данная чувствительность для кератиноцитов не изменяется, а для фибробластов даже снижается.
Целый ряд генов, участвующих в контроле апоптоза (как животных, так и растительных), претерпевает возрастзависимое изменение экспрессии. Апоптоз является столь же эволюционно консервативным и присущим каждой клетке организма процессом, как и само старение. У животных апоптоз играет важную роль в тканевом гомеостазе (поддержании постоянного числа клеток).
Он осуществляет протективную функцию элиминации старых, предопухолевых или излишних клеток. Дисфункция программы клеточной гибели может, следовательно, оказывать прямое влияние на развитие дегенеративных или неопластических возрастных изменений.
Выявление роли соматических мутаций и репарации ДНК в механизмах старения ставит вопрос об их непосредственной связи с процессами дифференцировки и программированной клеточной гибели и злокачественного роста. Если одноклеточным организмам позволяет выжить при изменении условий окружающей среды лишь репарация повреждений ДНК, то оптимальная стратегия Metazoa в отношении клеток, несущих повреждения ДНК, не столь однозначна, поскольку некоторые мутации в генах, регулирующих клеточную пролиферацию, адгезию и апоптоз, могут вызывать развитие фатальных злокачественных новообразований. Поэтому для организма в целом "безопаснее" иметь механизмы элиминации таких генетически поврежденных клеток, чем риск возникновения очагов неконтролируемого автономного роста. Выбор конкретной "стратегии" организма - репарации ДНК, блокады пролиферации или апоптоза - зависит во многом от типа клеток, их локализации, микроокружения, характера повреждающего фактора и степени повреждения. В любом случае эффективный ответ на повреждение ДНК является ключевым звеном для выживания многоклеточного организма.
В последние годы достигнут значительный прогресс как в изучении самого феномена программированной клеточной гибели (апоптоза), так и в понимании молекулярных механизмов его реализации и регуляции. Установлена ключевая роль антионкогена р53 в этом процессе. Опосредованная р53 остановка пролиферации в стадии G1 или G2 клеточного цикла необратима. Такая клетка хотя и не погибает, но генетически она уже "мертва", поскольку не способна к развитию опухоли. Реализации такого эффекта р53 предшествует индукция циклинзависимого ингибитора киназы р21.
Менее ясна роль р53 в стимуляции собственно апоптоза. Установлено, что мишенями для р53 являются несколько специфических генов, таких, как антагонист гена Вах ген Bcl2 , рецептор инсулиноподобного фактора роста-I (IGFR-I), связывающий белок IGF-BP3, компоненты ренин-ангиотензинной системы и белки, регулирующие ангиогенез. Более того, в некоторых случаях показано участие в этом процессе трансэкспрессии генов антиапоптоза и даже некоторых нетранскрипционных механизмов. Выявлено также, что р53 участвует в реакции клетки на воздействия, которые не повреждают непосредственно ДНК, например, при метаболической депривации, физических травмах, тепловом шоке, гипоксии и экспрессии таких онкогенов, как Мус и Е1А.
Выше уже обсуждалась модель клеточного старения Хейфлика и роль теломер и теломеразы в продолжительности жизни клеток in vitro. Использование этой модели оказалось весьма плодотворным для изучения механизмов репликативного старения. Прекращение способности к пролиферации клеток в культуре можно было объяснить потерей экспрессии пострепликативных генов, например, репрессией с-mус, или неспособностью фосфорилироваться белка ретинобластомы (RB), или, напротив, увеличением экспрессии антирепликативных генов, например, ингибитора циклинзависимой киназы (cdk) p21. Недавно было установлено, что находящиеся в фазе репликативного старения фибробласты человека резистентны к апоптозу. Угнетение экспрессии ключевых генов G1-фазы, удерживающих стареющие фибробласты человека от вступления в фазу S клеточного цикла, по-видимому, является тем механизмом, который запускает процесс клеточной гибели. Уровень антиапоптотического фактора bсl2 постоянно высок в таких клетках, при этом не наблюдается протеолиза терминина от формы с молекулярной массой 90 кДа до формы 30 кДа. Таким образом, репрессия генов S фазы, увеличение экспрессии гена антиапоптоза bсl2 и отсутствие протеолиза представляется, по образному выражению Ванг, крепким "тройным замком", который предотвращает апоптотическую гибель стареющих фибробластов. Закономерен вопрос - имеют ли отношение эти результаты, полученные в опытах in vitro, к реальной ситуации старения in vivo, прежде всего, к старению кожи человека? Недавно было установлено, что в коже пожилых лиц в большом количестве содержатся стареющие фибробласты. Хорошо известна высокая чувствительность кожи пожилых к канцерогенному действию ультрафиолета и сниженная способность к заживлению ран. Следует заметить, что еще в 1985 г. Эббесен выявил существенное повышение чувствительности кожи старых мышей к действию промотора кожного канцерогенеза 12-О-тетрадеканоилфорбол-13-ацетата по сравнению с кожей молодых животных. При подкожном введении старым животным самых разнообразных канцерогенных агентов (полициклических ароматических углеводородов, нитрозосоединений, пластмассовых пленок или вируса Молони) саркомы на месте введения развивались с большей частотой и значительно раньше, чем у молодых. Вместе с тем стимуляция апоптоза в клетках печени ограничением калорийности питания угнетала развитие пренеопластических узелков в печени у старых крыс и мышей. Введение мелатонина стимулировало апоптоз в клетках аденокарцином толстой кишки, индуцируемых 1,2-диметилгидразином, что сопровождалось отчетливым торможением развития опухолей, тогда как в постмитотических клетках головного мозга этот геропротектор угнетал индуцированную оксидативным стрессом клеточную гибель. Таким образом, накопление в тканях с возрастом резистентных к апоптозу стареющих клеток, возможно, является тем айсбергом, который аккумулирует множественные повреждения, приводящие, в конечном счете, к неоплазии, нейродегенеративным процессам или вторичной смерти вследствие инфаркта миокарда.
Дата добавления: 2022-07-20; просмотров: 187;











