ТЕХНОЛОГИЯ РЕКОМБИНАНТНЫХ ДНК
Основной задачей генетической инженерии является создание в условиях in vitro рекомбинантных молекул ДНК посредством соединения фрагментов ДНК, которые в природе чаще не сочетаются. Причиной невозможности естественного генетического обмена между разными видами является отсутствие гомологии в нуклеотидных последовательностях их ДНК. Посредством же методов генной инженерии можно осуществить обмен генами между эволюционно отдаленными геномами, равно как и введение в клетку гена принадлежащего другому виду.
Совокупность экспериментальных методов, позволяющая осуществить перенос генетического материала из одного организма в другой была названа технологией рекомбинантных ДНК. Этот подход был разработан на бактериях, в частности на кишечной палочке Escherichia coli, в клетки которой вводили гены животных и человека и добивались их репликации. В связи с этим технология рекомбинантных ДНК включает как методы генной инженерии, так и методы генетики микроорганизмов.
Технология рекомбинантных ДНК включает два этапа, каждый из которых подразделен на ряд подэтапов, содержащих определенные методы (рис. 1).
Конечной целью данной технологии является синтез нужных белков для применения в медицине и фармацевтической промышленности, синтез белков-ферментов для генноинженерных исследований.
| I. Создание рекомбинантных ДНК | II. Введение и экспрессия рекомбинантных ДНК в клетки реципиента |
| выделение ДНК из клеток донора | трансформация реципиентных клеток рекомбинантными ДНК |
| ↓ | ↓ |
| подготовка ДНК к клонированию | отбор трансформированных клеток |
| ↓ | ↓ |
| секвенирование фрагментов ДНК | получение экспрессируемого белкового продукта и его анализ |
| ↓ | ↓ |
| конструирование рекомбинантных ДНК | промышленное получение полипептидного препарата |
Рис. 1. Этапы технологии рекомбинантных ДНК
Получаемые полипептидные препараты имеют высокую степень чистоты, относительно недороги, кроме того, их трудно было бы получить иным путем. К числу таких препаратов относятся интерфероны, инсулин, гормон роста человека, белки, кодируемые вирусом гепатита В и возбудителем малярии человека, используемые в качестве антигенов и некоторых вакцин, а также ДНК-полимераза I, ДНК-лигаза Е. coli, обратная транскриптаза.
Технология рекомбинантных ДНК стимулировала развитие различных областей биологии, но, прежде всего, биотехнологии.
Выделение ДНК из клеток донора– одна из главных стадий создания рекомбинантных ДНК. Успех на данной стадии зависит прежде всего от изученности нужного исследователю гена и его положения в геноме, от разработки методов выделения иРНК этого гена, от существования доноров, у которых этот ген особенно активен, что позволяет выделить достаточное количество его иРНК с целью синтеза на ее матрице нужного гена с помощью обратной транскриптазы. В связи с этим существует и несколько путей получения нужного гена:
– химический или ферментативный синтез;
– отбор из клонотеки комплементарной ДНК (кДНК), которая соответствует определенному гену без интронов;
– экстрагирование из клеток донора нужного гена в составе ДНК.
Впервые в 1968 году в лаборатории Г. Кораны был синтезирован химическим путем ген фенилаланиновой тРНК дрожжей размером в 77 п.н. В настоящее время химическим методом из-за его высокой стоимости, трудоемкости и длительности синтезируют только небольшие гены (до 100 нуклеотидов) с известной нуклеотидной последовательностью, например ген гормона человека инсулина, а также ДНК-зонды, представляющие собой небольшие участки генов (20-30 п.н.). Установление нуклеотидной последовательности большинства интересующих исследователя генов, а также автоматизация этого метода позволит в ближайшем будущем облегчить и ускорить синтез новых генов.
Ферментативный синтез генов стал возможным после открытия у ретровирусов фермента – обратной транскриптазы, РНК-зависимой ДНК-полимеразы или ревертазы – который синтезирует двунитчатую ДНК на матрице однонитчатой РНК. Такой подход синтеза гена может быть реализован только в случае доступности зрелой эукариотической иРНК, обратная транскрипция которой позволит получить in vitro лишенную интронов кДНК. Однако выделить иРНК по каждому гену в чистом виде практически невозможно кроме тех клеток и тканей, в которых этот ген избирательно активно экспрессируется.
Совокупность кДНК по различным генам, которая включена в состав подходящего вектора, называют клонотекой, библиотекой кДНК. Библиотеки кДНК, в отличие от геномных библиотек, представляют не все последовательности генома и даже не все гены, а только ту их часть, которая экспрессируется в организме в определенный момент. Библиотека кДНК может включать молекулы иРНК данной клетки на одной и той же стадии развития. Помимо библиотеки кДНК растений или животных можно получить библиотеки кДНК отдельных органов и тканей (органо- или тканеспецифичные библиотеки кДНК) или библиотеки кДНК, характерные для различных стадий онтогенеза. Найти в такой клонотеке нужный фрагмент ДНК с интересующим геном можно с помощью молекулярного зонда (см. метод Саузерн-блот гибридизации).
Нужный ген или фрагмент для клонирования может быть получен путем непосредственного расщепления экстрагированной из клеток донора геномной ДНК под действием подходящей рестрикционной эндонуклиазы. Одним из наглядных примеров данного способа является выделение ДНК из плазмидсодержащих бактериальных клеток (рис. 2).
| Получение культуры бактериальных клеток |
| ↓ |
| Получение клеточных экстрактов при осаждении культур центрифугированием |
| ↓ |
| Добавление к экстракту лизоцима для разрушения клеточных стенок и получения сферопластов |
| ↓ |
| Добавление детрегента для растворения мембраны и инактивации гидролитических ферментов |
| ↓ |
| Выделение хромосомной и плазмидной ДНК ультрацентрифугированием |
Рис. 2. Порядок выделения ДНК из плазмидсодержащих бактериальных клеток
Такой подход наиболее распространен при поиске интересующих исследователя генов с целью их дальнейшего клонирования.
Подготовка ДНК к клонированию состоит из двух этапов: расщепление ДНК донора на фрагменты и разделение фрагментов ДНК методом гель-электрофореза.
Расщепить ДНК на фрагменты можно путем дробления ультразвуком или гидродинамическим способом. В ходе этих простых операций разрывы генома происходят случайно, поэтому при каждой обработке одной и той же ДНК получается совершенно новый набор фрагментов. Более приемлемым является ферментативный способ расщепления ДНК с помощью рестриктаз.
Рестриктазы представляют собой специфический класс эндонуклеаз бактерий, из которых они были выделены в 1968 году В. Арбером. В настоящее время показано, что рестриктазы могут кодироваться не только хромосомной, но и плазмидной ДНК бактерий, а также и геномом бактериофагов. Рестриктазы – ферменты рестрикции, которые разрезают ДНК по определенным нуклеотидным последовательностям, называемым сайтом рестрикции. Каждая из рестриктаз узнает свой сайт рестрикции и разрезает нуклеотидную последовательность ДНК либо внутри сайта узнавания (распознаваемого участка), с которым они связываются, либо в непосредственной близости от него. Таким образом, при действии конкретной рестриктазы одна и та же нуклеотидная последовательность ДНК будет всегда образовывать одинаковый набор фрагментов. Основными ферментами, используемыми в генетической инженерии для получения рекомбинантных ДНК, являются рестриктазы II типа. Отличительной их особенностью является то, что у них сайты узнавания и места рестрикции совпадают, т.е. с сайта узнавания начинается расщепление молекулы ДНК данным ферментом. Сайт рестрикции рестриктаз II типа представлен симметричными при повороте на 1800 нуклеотидными последовательностями двуцепочной ДНК– палиндромами. Палиндромы могут быть любых размеров, но в генетической инженерии используют в основном те, которые состоят из 4, 5, 6 реже 8 п.н. Рестриктазы II типа могут расщеплять ДНК как по оси симметрии сайта рестрикции, так и со смещением, с образованием так называемой «ступеньки». В первом случае образуются фрагменты ДНК с «тупыми» (ровными) концами, а во втором – с «липкими» (на концах имеются выступающие одноцепочные участки) (рис. 3).
Ферментативная активность рестриктаз измеряется в единицах активности, показывающих какое количество фермента необходимо для полного гидролиза за один час 1 мкг ДНК фага лямбда при оптимальных условиях. Оптимальные условия рестрикции для каждой рестриктазы являются индивидуальными и зависят от рН, ионной силы, присутствия определенных ионов, температуры проведения реакции.
| Tag I | ||||
| 5′ ___Т-Ц↓Г-А___ 3′ 3′ ___А-Г↑Ц-Т___ 5′ | → | 5′ ___Т-Ц 3′ ___А-Г | + | Г-А___ 3′ Ц-Т___ 5′ |
| фрагменты ДНК с «тупыми» концами | ||||
| EcoR I | ||||
| 5′ ___Г↓А-А-Т-Т-Ц___ 3′ 3′ ___Ц-Т-Т-А-А↑Г___ 5′ | → | 5′ ___Г 3′ ___Ц-Т-Т-А-А | + | А-А-Т-Т-Ц___ 3′ Г___ 5′ |
| фрагменты ДНК с «липкими» концами |
Рис. 3. Действие рестриктаз Tag I и EcoR I на ДНК, с указанием участка распознавания и сайта рестрикции.
Фрагменты, полученные под действием рестриктаз, разделяют с помощью метода электрофореза в агарозном или полиакриламидном гелях. Метод электрофореза основан на разделении фрагментов ДНК, движущихся с различной скоростью в электрическом поле. Находящиеся в буферном растворе короткие фрагменты ДНК при пропускании через гель электрического тока мигрируют намного быстрее, чем длинные, при этом электрофоретическая подвижность фрагментов линейно связана с логарифмом его относительной молекулярной массы.
Для разделения фрагментов ДНК среднего размера обычно применяют агарозный гель. Агарозный гель образует трехмерную полимерную ячеистую структуру. Он электронейтрален и химически инертен по отношению к ДНК, поэтому всегда можно легко элюировать необходимый фрагмент ДНК из геля с сохранением его биологической активности. Фрагменты ДНК обладают некоторым суммарным электрическим зарядом и в электрическом поле движутся к положительно заряженному полюсу. Таким образом, рестрикционные фрагменты распределяются по длине гелевой пластинки. После окрашивания геля красителем, например бромистым этидием, который связывается с ДНК, выявляется набор полос, каждая из которых соответствует рестрикционному фрагменту (рестрикту). Молекулярную массу разделенных фрагментов ДНК определяют калибровкой с помощью маркерных фрагментов с известными молекулярными массами.
Результативность электрофореза очень высока. Так, в 1,0% агарозном геле можно разделить рестрикты ДНК размером от 600 до 20000 п.н. В 20% полиакриламидном геле можно разделить фрагменты ДНК, состоящие всего из шести оснований и различающихся лишь одним нуклеотидом.
Обработка образца ДНК определенной рестриктазой всегда дает один и тот же набор фрагментов. Если использовать несколько рестриктаз и сначала обработать ДНК каждой из рестриктаз в отдельности, затем их смесями, и определить размер полученных рестриктов методом гель-электрофореза, можно построить рестрикционную карту. Рестрикционная карта – это физическая карта молекулы ДНК, на которой показан порядок следования сайтов рестрикции различных рестриктаз.
Первую рестрикционную карту ДНК, содержащую 14 сайтов рестрикции, составил Д. Натанс для вируса SV 40. Порядок их расположения в кольцевой ДНК, содержащей 5423 п.н., был установлен путем исследования длины и массы наборов образовавшихся фрагментов при использовании рестриктазы Hind III. Первый разрыв превращал кольцевую молекулу ДНК в линейную, которая затем расщеплялась на все меньшие фрагменты. Сравнив размер полученных рестриктов, была построена рестрикционная карта кольцевой вирусной ДНК, на которой нанесены сайты рестрикции фермента Hind III.
Рестрикционные карты помогают оценить степень гомологии между отдельными фрагментам различных ДНК без определения их нуклеотидной последовательности. В целом рестрикционные карты важны для клонирования ДНК, решения эволюционных и филогенетических задач.
Сиквенирование фрагментов ДНК, выделенных после электрофореза из агарозного геля, позволяет довольно быстро определить их нуклеотидную последовательность. Так, сиквенировав ген, часто удается установить его функцию, сравнив его нуклеотидную последовательность с таковыми для генов, функция которых уже известна. Также на основании генетического кода можно определить аминокислотную последовательность белка в соответствии с нуклеотидной последовательностью сиквенированного гена. Существует два основных метода сиквенирования – химический и ферментативный.
Химический метод сиквенирования ДНК основан на избирательной химической модификации оснований нуклеотидов, которая приводит их к разрушению. Этот метод был предложен в 1977 году А. Максамом и В. Гилбертом и назван их именем (метод Максама–Гилберта).
Метод основан на получении меченных радиоактивным фосфором 32Р или серой 35S одноцепочных фрагментов ДНК и удалении из них с помощью различных веществ одного из оснований в четырех типах реакций с последующим учетом результатов радиоавтографии гелей после электрофореза, содержащих эти фрагменты. Фрагменты, содержащие радоактивную метку, оставляют на рентгеновской пленке «отпечатки». По их положению можно определить, на каком расстоянии от меченого конца находилось разрушенное основание, а зная это основание – его положение.
Сиквенирование методом Максама–Гильберта имеет ряд недостатков, связанных с длительностью и значительной трудоемкостью процедур. В настоящее время на его основе разработаны более быстрые методы.
Ферментативный метод сиквенирования предложен Ф. Сэнгером в 1977 году. Этот метод предполагает осуществление в условиях in vitro репликации комплементарной цепи ДНК на одноцепочной ДНК-матрице при происходящем в разных местах строящейся последовательности ДНК обрыве синтеза, т.е. терминации роста цепи. Терминация синтеза полинуклеотидной цепи происходит путем введения дидезоксинуклеотида. Дидезоксинуклеотиды (терминирующае нуклеотиды) – это полученные искусственным путем нуклеотиды, лишенные гидрксильных групп у 2′ и 3′-атомов углерода дезоксирибозы. В качестве терминирующего нуклеотида используются 2′,3′-дидезокситрифосфаты (ддАТФ, ддГТФ, ддТТФ, ддЦТФ). Эти модифицированные нуклеотиды не могут образовать фосфодиэфирную связь со следующим дезоксирибонуклеотидом, поэтому элонгация цепи терминируется. Синтезированные фрагменты ДНК разделяют с помощью гель-электрофореза, проводят радиоавтографию и считывают нуклеотидную последовательность.
Оба метода позволяют определить в одном эксперименте последовательности не более чем в 500 нуклеотидов, поэтому для установления последовательности нуклеотидов целых геномов требуется предварительная разработка стратегии сиквенирования. Она сводится к выбору метода сиквенирования, способа фрагментации ДНК и способа восстановления полной последовательности нуклеотидов в анализируемом геноме. Тем не менее, определение точной нуклеотидной последовательности любого фрагмента ДНК в настоящее время вполне разрешимая задача. Сегодня особенно широко используется ферментативный метод, причем он автоматизирован и усовершенствован. Полученные результаты сиквенирования геномов видов заносятся в базы данных – банки генов, представляющих собой набор клонированных генов данного организма, полученных на основе рекомбинантных ДНК. Размеры банка, необходимые для полного клонирования того или иного генома, можно определить, зная молекулярную массу генома (М), средний размер клонируемого фрагмента (m) и задавая определенную вероятность (Р) того, что клонирован весь геном. Тогда объем банка, т.е. число клонов (N), равен: N = (М/m) х ln(1–Р). Наиболее крупными являются банки генов Genbank (США), EMBL (ОЕ), DDBJ (Япония), объединенные в единую сеть INSD. Нуклеотидные последовательности, представленные в этих банках данных, доступны по адресам: www.ebi.ac.uk, www.ddbj.nig.ac.jp, www.ncbi.nlm.nih.gov.
Этап сиквенирования рестрикционных фрагментов ДНК в технологии рекомбинантных молекул ДНК при работе с теми видами про- и эукариотических организмов, геномы которых расшифрованы, может быть заменен их анализом с помощью других методов. Одним из них является разработанный в 1975 году метод Саузерн-блот гибридизации, позволяющий идентифицировать интересующие исследователя гены и рестрикционные фрагменты ДНК после гель-электрофореза. Суть метода заключается в том, что сначала рестрикционные фрагменты ДНК денатурируются до одноцепочных молекул, а затем весь электрофоретический спектр переносится из геля на нитроцеллюлозную пленку и фиксируется при помощи высокой температуры. Затем одноцепочные рестрикционные фрагменты ДНК этой мембраны гибридизуются со специальным радиоактивномеченным ДНКовым зондом, имеющим определенную (известную) нуклеотидную последовательность. Зонд способен гибридизоваться только с определенным комплементарным фрагментом ДНК из всего электрофоретического спектра полученных рестрикционных фрагментов ДНК. Фрагменты, с которыми связался зонд, выявляются радиоавтографией. По полученным на радиоавтографе полосам судят о присутствии интересующего исследователя фрагмента (гена) в анализируемом геноме донора. В дальнейшем работают с отобранным геном (фрагментом ДНК).
Конструирование рекомбинантных ДНК предполагает создание конструкций «вектор + фрагмент ДНК», которое включает ряд этапов:
1) выбор вектора;
2) обработка вектора теми же рестриктазами, которые использовались для расщепления донорной ДНК;
3) смешивание этих двух образцов ДНК (векторного и донорного) и сшивание их ДНК-лигазой фага Т4.
Векторами называют молекулы ДНК, способные акцептировать чужеродную ДНК и обеспечивать ее репликацию, экспрессию и/или трансформацию (перенос в другой организм).
Идеальными векторными молекулами, созданными самой природой, оказались плазмиды, представляющие собой небольшие кольцевые молекулы ДНК, автономно реплицирующиеся в бактериальной клетке. В качестве исходного материала для векторов, как правило, используют помимо плазмид, бактериофаги, мобильные генетические элементы, вирусы. В настоящее время создано большое число векторов, но по профилю использования их можно разделить на несколько типов:
– векторы для клонирования используют для амплификации фрагмента ДНК, встроенного в такой вектор посредством репликации.
– векторы для экспрессии используют для анализа генов и их белковых продуктов, а также наработки конкретного белка.
– векторы для трансформации используют для введения чужеродного фрагмента ДНК в геном реципиента.
Современные векторные системы часто бывают полифункциональными, совмещая несколько функций в одном векторе.
К векторной молекуле предъявляются следующие требования:
1. Вектор должен содержать уникальный сайт рестрикции, в который может быть осуществлена вставка фрагмента чужеродной ДНК.
2. Вектор должен обладать определенной емкостью, при этом иметь небольшой размер и не абортировать встроенный фрагмент ДНК.
3. Вектор должен реплицироваться в определенных клетках за счет имеющейся нуклеотидной последовательности – точки начала репликации (ori-сайт).
4. Вектор должен содержать последовательность маркерного гена, облегчающего селекцию клеток, несущих векторную конструкцию, так как при встраивании в область маркерного гена чужеродного фрагмента ДНК его целостность нарушается и определяемый им признак исчезает.
Важным этапом в конструировании рекомбинантных молекул ДНК является обработка векторной и донорной ДНК одинаковыми рестриктазами с тем, чтобы на следующем этапе произвести успешно их объединение в составе гибридной ДНК с помощью ДНК-лигаз. ДНК-лигазы – ферменты, осуществляющие соединение фрагментов ДНК путем восстановления фосфодиэфирных связей между соседними нуклеотидами. Этот процесс называется лигированием.
Объединение фрагментов ДНК с одноименными «липкими» концами, т.е объединение любых двух фрагментов (независимо от происхождения), образовавшихся под действием одной и той же рестриктазы, происходит за счет образования водородных связей между однонитевыми участками комплементарных нуклеотидов. После такого объединения для восстановления целостности двойной спирали используют ДНК-лигазу.
Соединение фрагментов ДНК с разноименными «липкими» концами, которые образовались под действием различных рестриктаз, производят следующим образом. Разноименные «липкие» концы затупляют путем отщепления нуклеотидов одноцепочных «липких» концов с помощью фермента нуклеазы, либо путем синтеза второй нити ДНК на матрице однонитевых «липких» концов с помощью ДНК-полимеразы. В результате из фрагмента ДНК с «липкими» концами получается фрагмент с «тупыми» концами.
Фрагменты с «тупыми» концами также соединяются при помощи ДНК-лигазы. Однако в этом случае скорость процесса лигирования на порядок ниже, чем при сшивании по «липким» концам. Преимущество соединения фрагментов с «тупыми» концами по сравнению с «липкими» состоит в том, что не имеет значения, какие рестриктазы образовали эти «тупые» концы: фрагменты, образованные в результате действия разноименных рестриктаз, легко соединимы.
Векторы, применяемые в генетической инженерии прокариотических организмов,можно подразделить на три группы: плазмидные, фаговые, плазмидно-фаговые (космиды и фазмиды).
Впервые плазмида в качестве вектора была использована в лаборатории П. Берга. Эксперименты проводились с небольшой плазмидой кишечной палочки рSC101, несущей ген устойчивости к тетрациклину. Она содержала только один сайт рестрикции для EcoR I. Под действие рестриктазы кольцевая плазмида превращалась в линейную молекулу с «липкими» концами. Такую ДНК плазмиды рSC101 смешивали с фрагментом ДНК золотистого стафилококка, полученного с помощью той же рестриктазы. ДНК-лигаза объединяла чужеродные фрагменты в единую рекомбинантную молекулу ДНК. Затем такой рекомбинатной плазмидой трансформировали клетки E. coli. Клетки с рекомбинантной плазмидой отбирались на селективной среде с тетрациклином. Этот исторический опыт показал, что различные фрагменты чужеродных про- и эукариотических ДНК могут быть встроены в геном реципиента с целью придания ему новых свойств, а плазмиды обладают всеми основными свойствами, которые позволяют их использовать в качестве векторов.
По мере развития методов генной инженерии совершенствовались и плазмидные векторы. Широкое распространение в 80-е годы получил плазмидный вектор рВR322 (рис. 3). Данная плазмида обладает рядом свойств, необходимых для векторов: содержит уникальные сайты рестрикции для различных рестриктаз, несет два маркерных гена для селекции на бактериальных средах.
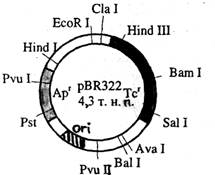
|
Рис. 3. Вектор рВR322, схема расположения сайтов рестрикции
Арг и Тсг - гены устойчивости к ампициллину и тетрациклину
Многие годы успешно применяется еще один класс плазмидных векторов типа pUC. Их отличительной особенностью является наличие в области маркерного гена полилинкера – участка множественного клонирования, представляющего собой синтетический олигонуклеотид, содержащий сайты рестрикции для наиболее часто используемых рестриктаз.
Плазмидные векторы, созданные для клонирования, имеют один важный недостаток – небольшую емкость. В таких векторах можно клонировать фрагменты ДНК длиной до 10 тысяч п.н., поэтому для клонирования фрагментов чужеродной ДНК большей длины были разработаны фаговые векторы, позже космиды – особый тип векторов, сочетающий свойства плазмиды и фага. В целом скрининг таких векторов на содержание чужеродной вставки провести проще, чем плазмидных векторов. Так, в реципиентной клетке, инфицированной молекулой рекомбинантного фагового вектора, образуется потомство, которое лизирует клетку и будет инфицировать соседние клетки, что в конечном итоге и приводит к формированию бляшек или, как их еще называют, негативных колоний.
Фаговые векторы для E. сoli сконструированы на основе двух бактериофагов – фага λ и М13. При получении фаговых векторов используется то обстоятельство, что вся центральная часть молекулы ДНК фага λ может быть заменена чужеродным фрагментом ДНК размером 10-21 тысяча п.н. При этом длина полученной рекомбинантной ДНК фага не должна быть меньше 30 тысяч п.н. и больше 52 тысяч п.н.
Для клонирования более длинных генов размером 30-45 тысяч п.н. были сконструированы специальные векторы с большой емкостью – космиды, представляющие собой гибридные молекулы, которые характеризуются плазмидным типом репликации и обладают способностью упаковываться в условиях in vitro в головки фага λ. Космиды, по существу, являются плазмидными векторами, имеющими лишь cos-сайт фага λ, необходимый для осуществления эффективной упаковки рекомбинантной ДНК in vitro. Истинными гибридами плазмиды и фага являются фазмиды – линейные молекулы ДНК, на концах которых расположены сегменты ДНК фага λ, содержащие все гены, требующиеся для инфекции, а средняя часть представлена плазмидной ДНК. Функции репликации как фага, так и плазмиды в фазмидах полностью сохранены и обычно реализуются при различных температурах.
Стратегия введения и экспрессии рекомбинантных ДНК в клетки реципиента рассматривается в частных разделах генетической инженерии.
Дата добавления: 2022-05-27; просмотров: 139;










