Изотермический процесс
Уравнение состояния идеального газа.
Основной задачей исследования ТД процессов является изучение основных закономерностей изменения состояния ТРТ в процессе и определение закона распределения энергии в процессе. Общий метод исследования ТД-процессов состоит в следующем:
1. В соответствии с заданными условиями определяется уравнение процесса φ(p,v)=0 и наносится в vp координатах график процесса. Уравнение в общем случае выводится из первого закона ТД: Q=Δu+AL.
2. Используя уравнение процесса и уравнение состояния, находят связь между параметрами газа в процессе (формулы соотношения параметров) в виде:
p=φ(v); T=f(v); T=ψ(p).
3. Определяется изменение внутренней энергии газа по общей для всех процессов формуле
Δu=u2-u1=cv(T2-T1).
4. Находится внешняя работа газа по формуле
L=ΣpΔv.
5. Определяется внешняя теплота, участвующая в процессе, по уравнению первого закона ТД в виде Q=Δu+AL или по уравнению 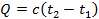 , где c – теплоёмкость произвольного процесса.
, где c – теплоёмкость произвольного процесса.
6. Определяется закон распределения энергии в процессе (т.е. коэффициент α=Δu/Q – доля теплоты, расходуемая на изменение внутренней энергии; (1-α) – доля теплоты, идущая на внешнюю работу). Т.е. закон распределения энергии характеризуется системой уравнений:
Δu=αQ
L=(1-α)Q.
Переход ТРТ из одного состояния в другое может проходить по различным процессам, в течение которых изменяется закон распределения энергии и одновременно изменяются параметры газа (p, v, T). Для ТД исследований из большой группы процессов выделяется, также большая, группа процессов, в течение которых закон распределения энергии постоянен. Исследование основных процессов позволило установить и обосновать методику расчёта, которую можно распространить на любые равновесные ТД процессы. К ним относятся:
1. Изохорный процесс, осуществляемый при постоянном объёме (v=const).
2. Изобарный процесс, осуществляемый при постоянном давлении (p=const).
3. Изотермический процесс, осуществляемый при постоянной температуре (T=const).
4. Адиабатный процесс, осуществляемый без подвода тепла (Q=0).
Изохорный процесс
| 1. Уравнение процесса v=const и график в системе v-p координат. Процесс охлаждения газа (отвод тепла) – 2-1, процесс нагревания газа (подвод тепла) – 1-2. 2. Соотношение параметров из уравнения состояния: p1v=RT1 и p2v=RT2, откуда p2/p1=T2/T1. Т.е. в изохорном процессе давление прямо пропорционально абсолютной температуре. | 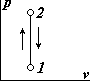
|
| 3. Изменение внутренней энергии как функции только состояния для всех процессов определяется по формуле Δu=cv(T2-T1). 4. При постоянном объёме внешняя работа не совершается, т.е. L=pΔv=0. 5. Внешнее тепло равно изменению внутренней энергии, т.е. Qv=u2-u1=Δu или Qv=cv(T2-T1). Т.е. в изохорном процессе всё подведённое тепло идёт на увеличение внутренней энергии газа. | |
| 6. Распределение энергии для изохорного процесса: Коэффициент α=Δu/Q: поскольку Δu=Q, то α=1, т.е. при подводе тепла к газу всё тепло идёт на увеличение внутренней энергии газа, а при отводе к уменьшению. | 
|
Изобарный процесс
| 1. Уравнение процесса p=const и график в системе v-p координат. Процесс расширения газа – 1-2, процесс сжатия – 2-1. 2. Соотношение параметров из уравнения состояния: pv1=RT1 и pv2=RT2, откуда v2/v1=T2/T1. Т.е. изобарном процессе объёмы газа пропорциональны абсолютным температурам. | 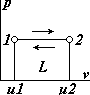
|
| 3. Изменение внутренней энергии как функции только состояния для всех процессов определяется по формуле Δu=cv(T2-T1). 4. Работа газа вычисляется в системе координат как площадь прямоугольника, основанием которого служит отрезок абсциссы v2-v1, а высотой – отрезок ординаты p: L=p(v2-v1). Можно написать выражение для работы в ином виде: p1v=RT1 и p2v=RT2, откуда L=p(v2-v1)=RT2-RT1=R(T2-T1). 5. Внешнюю теплоту можно подсчитать по общей формуле Qp=cp(T2-T1). или на основании первого закона термодинамики Qp=Δu+L. Подставляя в это уравнение вычисленные ранее значения Δu=cv(T2-T1) и L=R(T2-T1), получим Qp=cv(T2-T1)+R(T2-T1) или Qp=(cv+R)(T2-T1). Из приведённых выкладок можно получить, что cp=cv+R. Теплоту в изобарном процессе можно получить из первого закона ТД в виде Q=u2-u1+p(v2-v1) или Q=(u2+pv2)-(u1+pv1)=i2-i1. Т.е. теплота, сообщаемая газу в изобарном процессе, расходуется полностью на изменение его теплосодержания (энтальпии). | |
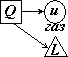
6. Распределение энергии для изобарного процесса: α=Δu/Q или в данном случае
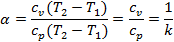
| 
|
Принимая k=1,4, получим, α=5/7 или 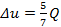 и и 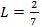 . Т.е. при расширении газа в изобарном процессе 5/7 подведённой теплоты идёт на увеличение внутренней энергии и только 2/7 – на совершение внешней работы. При сжатии, наоборот, 5/7 отведённой теплоты идёт за счёт уменьшения внутренней энергии и 2/7 – за счёт работы сжатия. . Т.е. при расширении газа в изобарном процессе 5/7 подведённой теплоты идёт на увеличение внутренней энергии и только 2/7 – на совершение внешней работы. При сжатии, наоборот, 5/7 отведённой теплоты идёт за счёт уменьшения внутренней энергии и 2/7 – за счёт работы сжатия.
|
Изотермический процесс
| 1. Изотермические процессы протекают при постоянной температуре (T=const). Т.к. по уравнению состояния pv=RT=const, то уравнение изотермического процесса имеет вид pv=const. Графиком процесса является равнобочной гиперболой. Расширение газа протекает в направлении 1 – 2, а сжатие в обратном направлении, 2 – 1. Способ геометрического построения изотермы прост. Пусть необходимо через точку A с координатами p1, v1 провести изотерму расширения. Проведём через точку A две прямые, параллельные осям координат. Из начала координат O проведём произвольную прямую, которая пересечёт эти прямые в точках D и C. Из точки D проведём прямую, параллельную оси v, из точки C – прямую, параллельную оси p. Пересечение этих прямых даёт точку B. Докажем, что точка B принадлежит изотерме, | 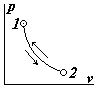
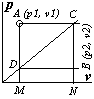
|
прошедшей через начальную точку A, т.е. p1v1=p2v2. Треугольники подобны, т.к. имеют один общий угол с вершиной в точке O, следовательно их стороны пропорциональны, т.е.: DM/CN=OM/ON. Т.к. DM=BN=p2, CN=AM=p1, OM=v1, ON=v2, то
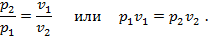 Проведя ряд лучей из начала координат и выполнив для каждого аналогичные построения, получим ряд точек, принадлежащих изотерме, проходящей через начальную точку A с координатами p1v1. Если необходимо поострить изотерму сжатия, то принципиально метод построения не меняется; разница состоит в том, что прямую AE проводят влево, а не вправо, а прямую AM вверх, а не вниз.
Проведя ряд лучей из начала координат и выполнив для каждого аналогичные построения, получим ряд точек, принадлежащих изотерме, проходящей через начальную точку A с координатами p1v1. Если необходимо поострить изотерму сжатия, то принципиально метод построения не меняется; разница состоит в том, что прямую AE проводят влево, а не вправо, а прямую AM вверх, а не вниз.
| |
2. Для вывода соотношения между параметрами напишем уравнение pv=RT для начального и конечного состояний газа в процессе 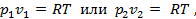 т.е. т.е.
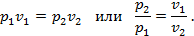 Т.е. в изотермическом процессе объёмы газа обратно пропорциональны давлениям.
3. Изменение внутренней энергии. Применяя общую формулу Δu=cv(T2-T1), получим Δu=0, т.к. T2=T1. Т.е. в изотермическом процессе изменение внутренней энергии равно нулю, и внутренняя энергия газа в течение всего процесса остаётся постоянной.
4. Работа вычисляется по формуле
L = 2,303RT·lg(v2/v1) = 2,303p1v1·lg(p1/p2)
5. Внешняя теплота определяется по первому закону термодинамики Q=Δu+L. Для изотермического процесса Δu=0, следовательно, Q=L. Т.е. в изотермическом процессе расширения вся подведённая
Т.е. в изотермическом процессе объёмы газа обратно пропорциональны давлениям.
3. Изменение внутренней энергии. Применяя общую формулу Δu=cv(T2-T1), получим Δu=0, т.к. T2=T1. Т.е. в изотермическом процессе изменение внутренней энергии равно нулю, и внутренняя энергия газа в течение всего процесса остаётся постоянной.
4. Работа вычисляется по формуле
L = 2,303RT·lg(v2/v1) = 2,303p1v1·lg(p1/p2)
5. Внешняя теплота определяется по первому закону термодинамики Q=Δu+L. Для изотермического процесса Δu=0, следовательно, Q=L. Т.е. в изотермическом процессе расширения вся подведённая
| |
| теплота расходуется на внешнюю работу, а в процессе сжатия внешняя работа полностью превращается в тепло. 6. Коэффициент α=Δu/Q=0. | 
|
Адиабатный процесс
1. Адиабатными называются процессы, протекающие без подвода и отвода тепла, т.е. Q=0. Уравнение процесса можно найти на основании первого закона ТД Q=Δu+L. Т.к. Q=0, то -L=Δu или L=-Δu. Поскольку Δu=cv(T2-T1) для любого процесса, то 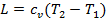 . Определяя по уравнению состояния T1=p1v1/R и T2=p2v2/R и подставляя эти в формулу работы, имеем . Определяя по уравнению состояния T1=p1v1/R и T2=p2v2/R и подставляя эти в формулу работы, имеем
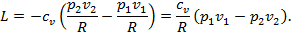
 Деля числитель и знаменатель правой части на cv и заменяя cp/cv=k, получим
Деля числитель и знаменатель правой части на cv и заменяя cp/cv=k, получим
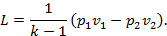
| |
Основное правило по определению кривой при известной формуле для лежащей под ней площади гласит: если площадь F, ограниченная сверху кривой, снизу осью абсцисс и по бокам крайними ординатами, выражается формулой 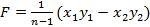 , то уравнение искомой кривой имеет вид yxn=const. В нашем случае зависимость , то уравнение искомой кривой имеет вид yxn=const. В нашем случае зависимость
| 
|
| между давлением и объёмом, имеет вид pvk=p1v1k=const. График адиабатного процесса представляет собой неравнобочную гиперболу. Кривую можно построить по двум крайним точкам по методу, основанному на том, что среднее геометрическое координат двух крайних точек адиабаты также является точкой, принадлежащей этой адиабате. | |
2. Формула соотношения параметров. Из уравнения процесса p2v2k=p1v1k имеем (p2/p1)=(v1/v2)k. Напишем уравнение состояния для двух крайних точек p1v1=RT1 и p2v2=RT2. Разделив почленно второе уравнение на первое, получим
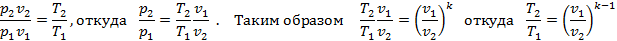
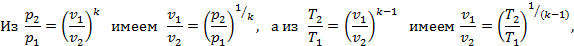
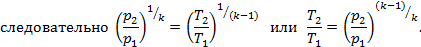 3. Изменение внутренней энергии. Применяя общую формулу Δu=cv(T2-T1).
4. Внешняя работа газа в адиабатном процессе вычисляется по формуле
3. Изменение внутренней энергии. Применяя общую формулу Δu=cv(T2-T1).
4. Внешняя работа газа в адиабатном процессе вычисляется по формуле
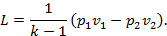 Формуле можно придать также другие выражения, удобные в расчётах:
а) т.к. p1v1=RT1 и p2v2=RT2, то получим
Формуле можно придать также другие выражения, удобные в расчётах:
а) т.к. p1v1=RT1 и p2v2=RT2, то получим
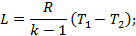 б) вынося за скобки T1 в последней формуле, получим:
б) вынося за скобки T1 в последней формуле, получим:
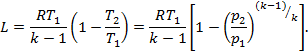 Другой вид формул для внешней работы можно получить из общего уравнения первого закона ТД, который для адиабатного процесса, т.к. Q=0, примет вид
Другой вид формул для внешней работы можно получить из общего уравнения первого закона ТД, который для адиабатного процесса, т.к. Q=0, примет вид
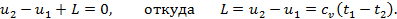 Таким образом, внешняя работа газа в адиабатном процессе получается за счёт уменьшения его внутренней энергии.
5. По условию протекания адиабатного процесса теплообмен с внешней средой отсутствует, т.е. Q=0.
6. Т.к. Q=0, а Δu
Таким образом, внешняя работа газа в адиабатном процессе получается за счёт уменьшения его внутренней энергии.
5. По условию протекания адиабатного процесса теплообмен с внешней средой отсутствует, т.е. Q=0.
6. Т.к. Q=0, а Δu  0, то α= Δu/Q= 0, то α= Δu/Q=  . .
|
Лекция 5
Дата добавления: 2017-11-21; просмотров: 3435;










