ДИАГНОСТИКА ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ (ОНКОИММУНОЛОГИЯ)
1. Деление раковых клеток происходит бесконтрольно.
Нормальный рост клеток регулируется таким образом, что количество пролиферирующих клеток в органе увеличивается или уменьшается, чтобы сбалансировать скорость потери клеток; тем самым поддерживается постоянный размер органов. Раковые клетки не подчиняются такой регуляции, в результате чего большая часть их потомства продолжает пролиферировать, что может привести к возникновению крупных образований, называемых опухолями. Опухоль, вызванная клеточной пролиферацией, называется неопластической (новообразование). Новообразования, прорастающие в окружающие ткани и в конце концов распространяющиеся по всему организму, называются злокачественными опухолями или раком. Новообразования, представляющие собой не прорастающие и не распространяющиеся в отдаленные органы опухоли, называются доброкачественными. Опухоли, возникающие из эпителиальных клеток, называются карциномами, а опухоли, возникающие из стромальных клеток или клеток мезенхимы, — саркомами.
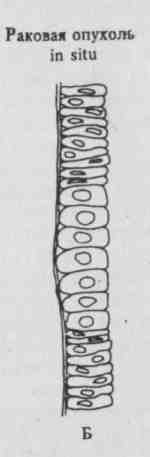
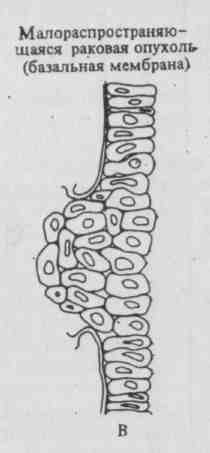
Рис. 1. Кинетика роста нормальных и неопластических клеток.
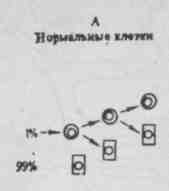
Количество ткани, состоящей из нормальных клеток, уменьшается ежедневно на 1%, что компенсируется делением небольшого числа стволовых клеток (А).
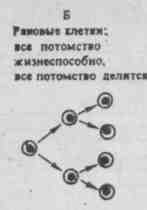
Если нормальная стволовая клетка становится раковой, то она может пролиферировать, образуя опухоль, путем быстрой полностью экспоненциальной экспансии (Б).
 путем более медленной частично экспоненциальной экспансии (В).
путем более медленной частично экспоненциальной экспансии (В).
2. Раковые клетки внедряются в другие ткани.
Распространение раковых клеток из основного очага в отдаленные органы называется метастазированием. Свойство метастазов, видимо, связано с природой первоначального очага и наследуется потомством метастазирую-щих клеток. Первая стадия метастазирования — внедрение раковых клеток в окружающие ткани. Вторая стадия — проникновение раковых клеток через стенку сосудов и внедрение в лимфатическую или кровеносную систему. Лимфатические сосуды дренируют все межклеточные пространства организма, заполненные жидкостью, направляя различные частицы и плазматическую жидкость в лимфатические узлы. Раковые клетки, отделившиеся от опухоли и попавшие в лимфатические сосуды, практически всегда задерживаются в лимфоузлах дренирующей лимфатической сети. В результате пролиферации этих раковых клеток происходит аномальное увеличение лимфатического узла (лимфаденопатия). Продолжающаяся пролиферация может привести к выходу раковых клеток из лимфатического узла в эфферентные лимфатические сосуды, ведущие к расположенному выше лимфоузлу. В конце концов раковые клетки могут проникнуть в крупный лимфатический сосуд, например в грудной проток, содержимое которого переходит непосредственно в крупные вены, ведущие к сердцу. Это приведет к рапространению раковых клеток через кровоток.
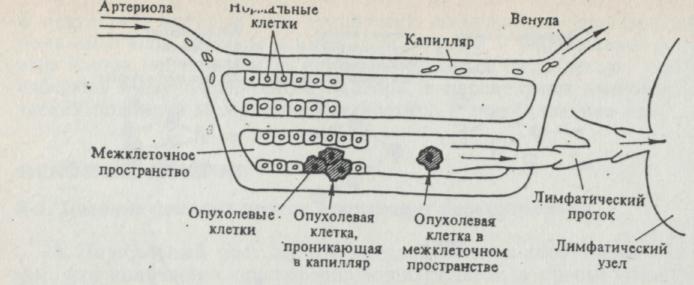
Рис. 2. Схематическое изображение путей инвазии опухолевых клеток и их влияния на расположение отдаленных метастазов. Опухолевые клетки, отрывающиеся от первичной опухоли, попадают в афферентные лимфатические протоки и оседают в дренирующих лимфатических узлах. Опухолевые клетки, проникшие в соседние кровеносные сосуды, попадают в кровоток и разносятся по всему организму.
3. Раковые клетки могут также попадать в кровоток непосредственно через стенки кровеносных сосудов. Раковые клетки, которые попадают в кровоток и задерживаются в отдаленных от основной опухоли участках, называются гематогенными (происходящими из крови) метастазами.
4. Появление раковых клеток может быть связано с изменением или активацией клеточного генома.
Канцерогенез — процесс, в результате которого возникает рак, все еще мало понятен. Перерождение нормальной клетки в раковую называется трансформацией. Так как трансформация является свойством раковой клетки и ее потомства, процесс трансформации должен быть связан с изменением генетической программы клетки.
Две основные теории канцерогенеза гласят, что трансформация обусловлена либо мутациями, изменяющими генетический материал, либо избирательной активацией латентных генов, экпрессия которых приводит к бесконтрольной пролиферации, характерной для раковых клеток.
В любом случае развитие рака до момента появления клинических симптомов обусловлено прогрессией трансформации, приводящей к образованию субклонов с возрастающей злокачественностью.
Эпидемиологические исследования рака позволили предположить, что вещества из окружающей среды могут быть причиной канцерогенеза. Очистка и фракционирование этих веществ приводят иногда к потере ими канцерогенной активности. Избирательная рекомбинация фракций из разных источников (таких, как каменноугольная смола и сигаретный дым) может восстановить их ; канцерогенные свойства. Эти исследования позволили выделить два класса соединений, активных при химическом канцерогенезе: канцерогены и промоторы.
Канцерогены быстро действуют на клетки-мишени. Это воздействие необходимо, но не достаточно для неопластической трансформации затронутой клетки.
Промоторы стимулируют деление клеток, в частности клеток-мишеней. Для злокачественной трансформации обработанных канцерогеном клеток требуются по крайней мере два цикла их деления., Действие промотора обратимо и само по себе не является канцерогенным. Чтобы вызвать трансформацию, он должен действовать после обработки клеток канцерогеном.
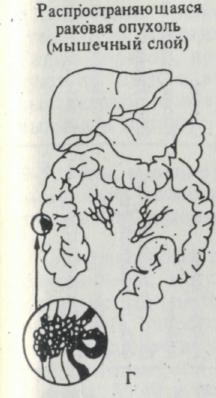
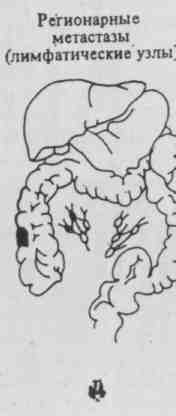
Рис. 3. Последовательные стадии развития рака прямой кишки (нижний отдел кишечника). Слева направо очаг патологических клеток с течением времени проникает глубже в мышечный слой кишечной стенки, распространяется в местные лимфатические узлы через тканевые лимфатические протоки, а затем после проникновения в кровеносные сосуды — в печень.

Несмотря на то что механизм действия основных канцерогенов при трансформации до сих пор не установлен, появляется все больше данных, свидетельствующих о потенциальной мутагенности большинства (или всех) этих соединений. Этот вывод лежит в основе теста Амеса, простого метода, с помощью которого можно определять незначительные концентрации канцерогенов в окружающей среде по их способности повышать частоту хорошо изученных мутаций у таких бактерий, как Salmonella. Физические агенты, вызывающие рак, например ультрафиолет и облучение, также крайне мута-генны. Они действуют непосредственно на нуклеиновые кислоты, вызывая изменения в геноме. Таким образом, представляется, что канцерогенные агенты действуют на ДНК и вызывают трансформацию. Однако остается невыясненным, основано ли их первичное действие на. способности вызы-вать мутации или на изменении экспрессии генов.
5. Гены, индуцирующие злокачественный фенотип, могут быть обнаружены как в ДНК-, так и в РНК-содержащих опухолеродных вирусах.
Некоторые ДНК- и РНК-содержащие вирусы, называемые онкогенными, могут трансформировать инфицированные ими клетки и тем самым индуцировать образование опухоли. Существуют различные онкогенные ДНК-содержащие вирусы, как очень простые, так и очень сложные. Простейшие вирусы, SV40 и полиома, изучены наиболее полно и поэтому наиболее удобны для выяснения общих закономерностей вирусиндуцирован-ной трансформации. Небольшая часть инфицированных клеток подвергается злокачественной трансформации. Трансформированные клетки сохраняют один или несколько вирусных геномов, ковалентно встроенных в геном клетки хозяина. Неизвестно, вызывают ли какие-либо ДНК-содержащие онкогенные вирусы (крме вируса папилломы) рак у человека.
Инфекции, вызванные онкогенными РНК-содержащими вирусами (онкорна-вирусами), отличаются от инфекций, вызванных опухолевыми ДНК- содержащими вирусами, по ряду признаков. Уникальный набор ферментов, закодированный в геноме онкврнавирусов и переносимый ими, обеспечивает синтез двуспиральной циркулярной ДНК-копии РНК генома вируса, называемой првовирусом. Провирус включается в клеточный геном хозяина, что сопровождается трансформацией клетки хозяина. Клетки, инфицированные онкорнавирусами, продолжают продуцировать потомство вируса путем отпочковывания от клеточной мембраны. В процессе отпочковывания кор вируса имеет форму буквы С, поэтому эти вирусы называются вирусами С-типа. У онкорнавирусов, как и у ДНК-содержащих онкогенных вирусов, существует несколько разновидностей. Структурные гликопротеины клеточной мембраны, которые расположены в местах почкования и впоследствии становятся гликопротеиновой оболочкой вируса, кодируются вирусным геномом. Эти молекулы, очевидно образуют находящийся на клеточной мембране комплекс, в котором полностью или почти полностью отсутствуют белки клеточной мембраны клетки хозяина. Эти места отпочко-вания, по- видимому, специфически распознаются цитоплазматическими скоплениями вирусного кора, содержащими РНК вириона. Отпочковывание происходит путем выпячивания комплекса кора с мембраной и заканчивается разделением и последующим замыканием вируспых и клеточных мембран. Способность как онкорнавирусов, так и опухолеродных ДНК-содержащих вирусов вызывать рак у человека не была пока убедительно продемонстрирована.
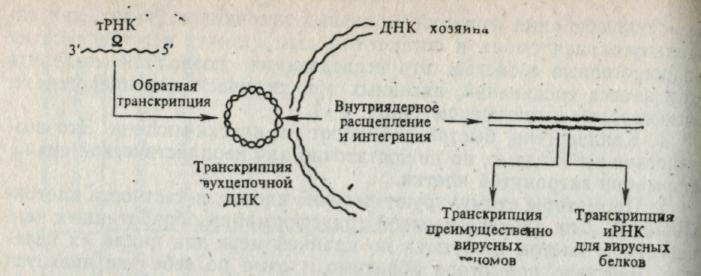
Рис. 4. Последовательность событий, происходящих при обратной транскрипции и интеграции онкорнавирусных генов, с геномом хозяина. Интактный вирус проникает в цитоплазму клеток-мишеней. С помощью-фермента, называемого обратной транскриптазой, синтез которой он кодирует, вирус начинает транскрипцию нуклеотидных последовательностей своей РНК-матрицы в нуклеотидные последовательности ДНК. Для реакции необходима затравка — транспортная РНК (тРНК) клетки хозяина, которая связывается с комплементарной последовательностью вирусной РНК. Одноцепочечная ДНК транскрибируется в направлении вирусной РНК, и затем синтез продолжается конца вирусной РНК. В течение этого процесса использованная матрица вирусной РНК расщепляется или удаляется и образуется двухцепочечная копия ДНК с помощью обратно транскрибиро-ванной ДНК в качестве матрицы. В результате появляется двухцепочечная замкнутая кольцевая ДНК провируса, представляющая собой копию информационной вирусной РНК. В клетках, инфицированных вирусом, ДНК провируса, очевидно, встраивается в определенный участок хромосомной ДНК хозяина, где она может выступать в качестве матрицы для считывания новых вирусных РНК и РНК с индивидуальных генов.
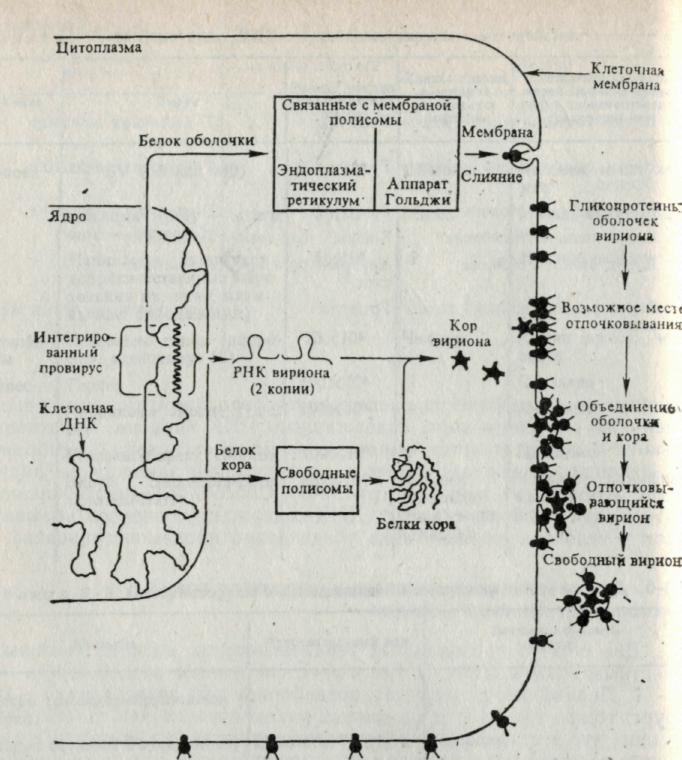
Рис. 5. Формирование клеткой мест отпочковывания онкорнавирусов. Вирионные- и- РНК двух классов, кора и оболочки, считываются с интегрированных ДНК копий вируса. Полифункциональный белок кора считы-вается с и- РНК кора во фракции свободных полисом и расщепляется на несколько разных белков, которые соединяются с РНК вириона и образуют коры вирионов. Одновременно и- РНК оболочки транслируются на полисомах, прикрепленных к мембранам эидоплазматического ретикулума. Этот предшественник полифункционального белка оболочки гликозилиру-ется, расщепляется на функциональные субъединицы и встраивается в плазматическую мембрану клетки в предполагаемых местах отпочковыва-ния. Комплексы коров прикрепляются к внутренней поверхности мембраны в предполагаемых местах отпочковывания и выпячивают ее, что в конце концов приводит к разделению вирусной и клеточной мембран
6. Для лечения рака человека в настоящее время используют три вида методов.
Два обычно применяемых терапевтических подхода связаны с местным воздействием, а третий — с системным воздействием.
► Первый метод местного воздействия для лечения рака — хирургическое удаление пораженных раком органов или тканей. Очевидно, что этот подход требует точного знания локализации и размеров раковой опухоли, так как удалить можно только ограниченный участок ткани.
► Второй способ местного воздействия — применение ионизирующей радиации (лучевая терапия) по месту локализации первичной опухоли и подозреваемых метастазов. Облучение приводит к невосстанавливаемым повреждениям клеточной ДНК. Клетки, вступающие в следующий клеточный цикл, не способны завершить митоз и гибнут (митотическая смерть). Некоторые типы клеток, например лимфоциты, погибают вне зависимости от времени вступления в митоз через несколько часов после облучения летальной дозой (интерфазная смерть). Лучевая терапия также требует знания точной локализации и размера опухоли. Это лечение особенно эффективно при опухолях лимфоидного происхождения с известкой картиной метастазов, как, например, при болезни Ходжкина, которая теперь излечима в 80% случаев. Лучевая терапия также эффективна, когда необходимо сохранить морфологию органа, освободив его от раковых клеток, причем этот орган впоследствии будет способен функционировать без экстенсивного деления клеток. Например, в отличие от хирургического вмешательства радиотерапия по поводу карциномы гортани может обеспечить сохранение голосовых связок больного.
► Третий способ лечения рака — химиотерапия, введение лекарственных препаратов, обладающих цитотоксическим действием. Эти лекарства названы так, потому что действуют на пролиферирующие клетки главным образом путем нарушения метаболизма пиримидина и пурина, синтеза ДНК или процесса митоза клеток. Для этих лекарств доступны все клетки, как злокачественные, так и нормальные. Вот почему их применение ограничено.
В результате использования одного или нескольких из перечисленных способов лечения целый ряд раковых заболеваний, неизлечимых 10 лет назад, в настоящее время стали излечимы. Однако исцеление, по-видимому, лишь частично обусловлено терапевтическим воздействием. Многие онкологи считают, что любое лечение рака направлено на уменьшение массы опухолевых клеток до количеств, с которыми могут справиться защитные механизмы хозяина. В любом случае противораковая терапия должна иметь целью удаление всех раковых клеток, так как даже одна оставшаяся незатронутой раковая клетка будет размножаться и может привести к смерти больного.
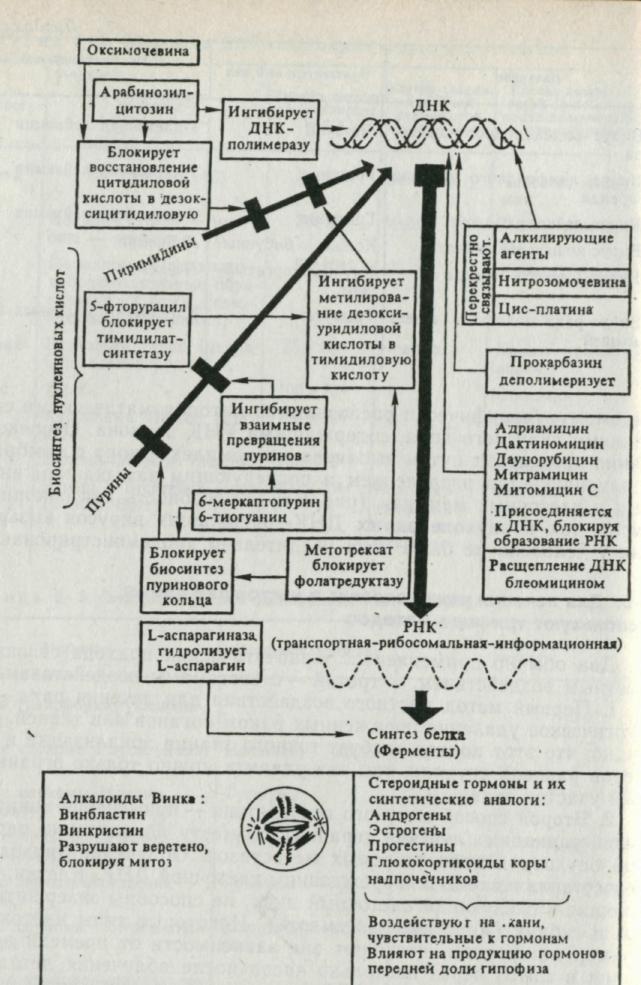
Рис. 6. Действие используемых в настоящее время противораковых химиотерапевтических препаратов. Рассматриваются три класса препаратов: воздействующие на синтез или репликацию ДНК; воздействующие на митотическое веретено и задерживающие клетки в метафазе и воздействующие на ткани, нуждающиеся в стероидных гормонах или ингибируемые ими.
7. Большинство опухолей антигенны для организма хозяина.
В 1908 г. известный биолог Пауль Эрлих сформулировал положение о том, что раковые клетки возникают и их мембраны изменены таким образом, что могут быть распознаны организмом хозяина как чужеродные антигены. Далее он утверждал, что для отторжения раковых клеток в большинстве случаев достаточно клеточного иммунного ответа. Через 50 лет Льюис Томас предположил, что развитие клеточноопосредованного иммунитета в процессе эволюции диктовалось необходимостью иммунологического надзора над вновь появляющимися новообразованиями.
Антигенность опухолей и иммунитет хозяина к опухолям были впервые продемонстрированы в трехэтапном эксперименте. Вызванная канцерогеном раковая опухоль была полностью удалена из организма, а затем разное количество опухолевых клеток трансплантировали сингенным реципиентам. Определяли число трансплантированных клеток, которые с хорошей степенью воспроизводимости индуцировали опухоль у реципиента. Ретрансплантация того же количества опухолевых клеток от второго хозяина исходному обычно не вызывала образования опухоли. Этот феномен был специфичен для конкретной опухоли. Адоптивный перенос лимфоцитов от первого хозяина генетически идентичным реципиентам обеспечивал их специфическую резистентность к раковой опухоли, индуцированной у донора лимфоцитов. Для передачи иммунитета был необходим перенос живых лимфоцитов, впоследствии идентифицированных как Т-лимфоциты.
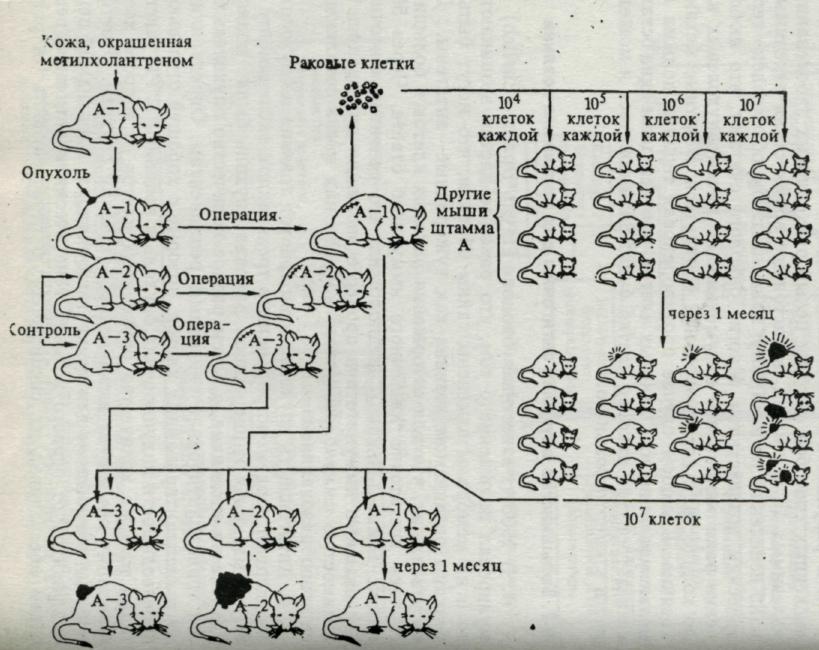
Рис. 7. Опыт, свидетельствующий, что мышь может стать иммунной к собственной опухоли. У мыши линии А (А-1) вызвана канцерогеном опухоль кожи, которую удаляют, и определенное число опухолевых клеток вводят другим мышам линии А. У мышей, получивших 10 млн. опухолевых клеток, развивается опухоль, смертельная для хозяина; в то же время у мышеи А, получивших 1 млн. клеток, опухоль возникает в 50% случаев. Однако мышь А-1, у которой была удалена опухоль, теперь резистентна к имплантации даже 10 млн. клеток этой опухоли, тогда как контрольные мыши той же линии (А-2 и А-3) чувствительны даже к 1 млн. опухолевых клеток. Таким образом, А-1 иммунны к собственной опухоли
После разработки таких чувствительных методов определения антител к опухолевым антигенам, как иммунофлуоресценция и радиоиммунный анализ, было показано, что у носителя опухоли имеется как клеточный, так и гуморальный иммунитет против своих собственных опухолевых антигенов. Образующиеся антитела использовали в опытах перекрестной адсорбции для того, чтобы сравнить большое число различных опухолевых и нормальных клеток. Таким путем удалось обнаружить опухоли с перекрестно-реагирую-щими антигенами, опухоли с опухолевоспецифичными антигенами и опухоли с антигенами, общими для части нормальных клеток (дифференци-ровочные антигены).
Теоретически опухолевоспецифические антигены могут быть новыми детерминантами или просто очень редко встречающимися детерминантами. Большинство опухолей состоит преимущественно из клеток одного клона, мембраны которых имеют свойства, одинаковые со свойствами мембраны исходной трансформированной клетки. Некоторые поверхностные детерминанты каждой нормальной клетки могут быть характерны (уникальны) только для этой клетки или еще для небольшого крличества других клеток. В таком случае концентрация этих уникальных детерминант слишком мала, чтобы вызвать иммуногенный или толерогенный ответы. Однако если такая клетка дает начало трансформированному клону идентичных клеток, то их поверхностные молекулы могут вызвать иммунный ответ, даже если какие-либо новые детерминанты и не появятся.
Таким образом, индуцированная канцерогеном трансформация способна либо изменять поверхность клеток, либо просто обеспечивать селективное размножение одной или нескольких предшествующих клеток, несущих уникальные поверхностные детерминанты.
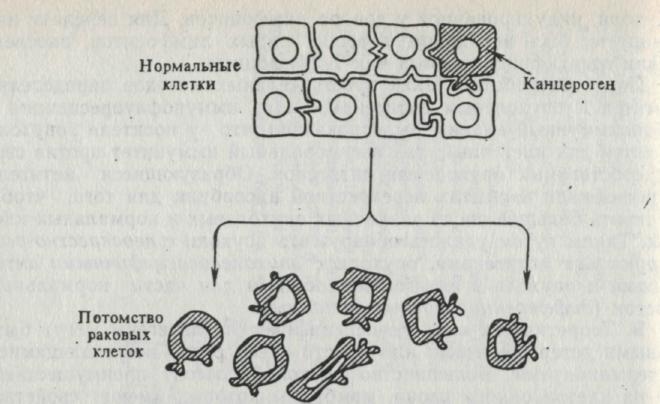
Рис. 8. Гипотеза клональной селекции, описывающая индукцию канцерогеном опухолевоспецифических антигенов. Несколько различных типов клеток в ткани прикрепляются друг к другу благодаря специфическим свойствам клеточных поверхностей. Канцероген избирательно трансфор-мирует клетки одного типа. Клон клеток, образующийся из этой трансформи-рованной клетки, несет те же специфические клеточные детерминанты, но эти раковые клетки морфологически неоднородны (плеоморфизм). Так как потомки злокачественных клеток не содержат комплементарных клеток; к которым могут прикрепляться, они приобретают тенденцию разрастаться из первоначального очага.
В экспериментальных условиях обнаружено четыре класса опухолевых антигенов.
►1-й класс антигенов называется опухолево-эмбриональным. Эти антигены найдены на поверхности раковых клеток, но они выявляются также во время специфической фазы эмбриональной дифференцировки.
1. Ярким примером могут служить канцероэмбриональные антигены прямой кишки. Эти антигены обнаружены на поверхности всех опухолевых клеток, происходящих из желудочно-кишечного тракта или органов, развивающихся из желудочно-кишечного тракта плода, таких, как поджелудочная железа, печень и желчный пузырь. Показано, что эти антигены, являющиеся, вероятно, гликопротеинами, присутствуют только на небольшой части нормальных взрослых клеток, и поэтому в здоровом организме общая кон
центрация канцероэмбриональных антигенов прямой кишки чрезвычайно низка.
2. Другим важнейшим примером является альфа-фетопротеин, секретиру-емый в норме эпителиальными клетками желточного мешка и эмбрио-нальной печени, а также продуцируемый злокачественными клетками желточного мешка и печени. Несмотря на то что ά-ФП секретируется клетками опухоли, иммунный ответ на него приостанавливает рост опухоли. Тщательный анализ показал, что ά-ФП не только опухолевый антиген у взрослых, но и вырабатывается пролиферирующими клетками печени.
► 2-й класс опухолевоспецифических антигенов возникает при индукции опухоли химическими канцерогенами. Каждая индуцированная канцеро-геном опухоль имеет присущие только ей поверхностные клеточные анти-гены. Если на кожу мыши в разных местах наносят канцероген —метил-холантрен, то каждая возникающая в результате карцинома имеет поверх-ностные клеточные антигены, идентичные для всех ее клеток, но отличные от антигенов других индуцированных метилхолантреном опухолей. Индиви-дуальные опухолевоспецифические антигены найдены также на опухолях, индуцированных любым другим химическим канцерогеном.
Уникальность индуцированных канцерогенами опухолевоспецифических антигенов имеет также важное клиническое значение. Если каждая новая индуцированная канцерогеном опухоль обладает только уникальными опухолевоспецифическими детерминантами, то трудно или совсем невозможно приготовить-заранее некоторое количество иммунологических диагностикумов для обнаружения таких антигенов и препаратов для лечения подобных опухолей.
► 3-й класс опухолевых антигенов включает антигены, индуцируемые онкогенными ДНК-содержащими вирусами. Каждый такой вирус индуцирует уникальные ядерные и поверхностные антигены в трансформируемых им клетках. Для определенного вируса эти антигены всегда одинаковы, независимо от ткани и даже биологического вида, в которых произошла трансформация. Три наиболее вероятных вида опухолей человека, вызываемых ДНК-содержащими вирусами (вероятные кандидаты — различные вирусы герпеса), — это лимфома Беркитта, назофарингеальная карцинома и рак шейки матки. Все три вида опухолей экспрессируют ассоциированные с поверхностью клетки опухолевые антигены и антигены, одинаковые для всех опухолей.
► 4-й класс присущих опухоли антигенов — это антигены, индуцированные при трансформации онкорнавирусами. Подобно опухолевым ДНК-содержа-щим вирусам, каждый опухолевый РНК- содержащий вирус индуцирует специфические антигены, которые одинаковы во всех трансформированных клетках. Однако в отличие от ДНК-содержащих вирусов большинство, если не все специфические опухолевые антигены для инфицированных онкорнавирусами клеток представляют собой вирусные белковые антигены. Некоторые из этих белков служат предшественниками структур трансформи-рованной клеточной мембраны в местах, где произойдет отпочковывание вирусов. Эти антигены могут иметь группоспецифические детерминанты, общие для всех вирусов определенной группы. Например вирусов лейкемии мышей, типоспецифические детерминанты, общие только для близкород-ственных вирусов, например вирусов лейкемии Гросса и лучевой лейкемии, а также уникальные вирусоспецифические детерминанты. Эти детерминанты могут присутствовать на различных полипептидах вириона; по крайней мере один поверхностный клеточный антиген является внутренним белком вириона.
Большинство лейкомогенных онкорнавирусов вызывает новообразования, которые экспрессируют нормальные дифференцировочные антигены. У мышей дифференцировочный антиген ТL может аномально экспрессирова-ться лимфомами тимуса у линий мышей, тимоциты которых в норме не имеют ТL антигена. Следовательно, контроль за экспрессией может быть каким-то образом поврежден при трансформации, вызванной онкорнавирусами.
8. Раковые клетки атакует система клеточного иммунитета.
А. Первый эксперимент по выяснению роли антител и клеток в противора-ковом иммунитете был проведен в конце 40-х годов. Раковые клетки помещали в непроницаемую для них камеру с порами 0,2μ в диаметре, через которые внутрь и наружу могли проникать молекулы, но не клетки. Когда камеру помещали в иммунный к этим раковым клеткам организм, клетки выживали и размножались, несмотря на то, что специфические противора-ковые антитела в большом количестве диффундировали в камеру и связывались клетками. Однако в том случае, когда эксперимент был повторен с использованием камер, имеющих поры, достаточные для проникновения клеток, раковые клетки разрушались, причем было показано, что лимфо-идные клетки хозяина проникают внутрь опухоли. Эти эксперименты явились первым доказательством того, что большинство опухолей не чувствительны к действию только антител или антител и комплемента, но чувствительны к воздействию клеток- киллеров. Три вида клеток- киллеров могут участвовать в клеточно-опосредованном иммунитете к опухолям:
Тс-клетки, натуральные клетки-киллеры (NK) и клетки, ответственные за антителозависимую клеточноопосредованную цитотоксичность (АDСС).
В большинстве случаев преобладает Тс- ответ. Однако лейкемии достаточно чувствительны к натуральным клеткам- киллерам, антителам и комплементу и к АDСС. Вообще рак гематолимфоидной системы чувствителен как к гуморальному, так и к клеточному иммунитету, тогда как другие виды рака чувствительны только к клеточному иммунитету.
Если система Т-клеток играет важную роль в уничтожении вновь возникаю-щих опухолей, то животные и люди с дефицитом этой системы должны быть крайне чувствительны к индукции опухолей и у них должна наблюдаться высокая частота распространения спонтанных опухолей.
Животные, лишенные тимуса в раннем возрасте, чрезвычайно подвержены воздействию различных онкогенных вирусов. Например, у мышей, тимэктомированных при рождении, после введения вируса саркомы Молони или вируса полиомы наблюдали высокую частоту возникновения опухолей, которые росли быстрее, чем редко встречающиеся опухоли у нетимэктоми-рованных животных того же помета. Более того, опухоли от тимэктомиро-ванных животных более антигенны в расчете на клетку, чем опухоли от нетимэктомированных животных. Эти результаты, как и результаты, под-тверждают гипотезу иммунологического надзора, согласно которой иммун-ная система отвечает на антигены эндогенных новообразований.
Более спорно положение, что клеточная иммунная система в процессе эволюции приобрела функцию защиты от большого числа спонтанно возникающих новообразований. При более благоприятных условиях выращивания можно продлить жизнь животным с врожденным отсутствием тимуса. Однако, как оказалось, последние редко погибают от рака. У людей с иммунологическим дефицитом рак встречается чрезвычайно часто. Например, около 10 % детей с врожденным иммунодефицитом заболевают раком. Однако опухоли у них в большинстве случаев относятся к опухолям лимфоидной системы. В связи с этим возникает вопрос, причина высокой частоты новообразований заключена в недостаточности иммунологического надзора или в патологических последствиях дисбаланса лимфоидной системы.
Наиболее убедительны примеры повышения частоты возникновения опухолей у индивидов с подавленной иммунной системой, получавших иммунодепрессанты по поводу трансплантации аллогенной почки.
Риск заболевания раком у этих больных повышается в 80 раз, причем около 60 % опухолей имеет эпителиоидное происхождение и около 40 % —лимфоидное. Остается непонятным, связаны ли эти раковые заболевания с иммунодефицитным состоянием или являются результатом патологических процессов, происходящих в лимфоидной системе. Объяснение результатов еще больше осложняется данными о том, что частота различных эпителио-идных новообразований, развивающихся у этих больных, не соответствует частоте, найденной для других групп больных того же возраста, пола и места жительства. Например, в результате иммуносупрессии частота заболеваний раком грудной железы и легких увеличивается ненамного, в то время как возникновение других новообразований сильно возрастает.
Итак, существуют весомые доказательства в пользу гипотезы иммунологи-ческого надзора, но в целом эта гипотеза недостаточно проверена. Все еще не известны иммунные механизмы, которые вовлечены в этот процесс, и не доказана высокая частота спонтанного возникновения рака.
9. Некоторые раковые клетки «ускользают» от иммунологического надзора.
Какова бы ни была общая ценность гипотезы иммунологического надзора, к моменту обнаружения опухоли у большинства раковых больных возникает как клеточный, так и гуморальный иммунитет против поверхностных клето-чных антигенов опухолевых клеток. Каким же образом тогда выживают опухолевые клетки во враждебном окружении? Рост опухоли в таких условиях обозначают как иммунологическое ускользание. При изучении экспериментальных опухолей было найдено несколько разных механизмов такого ускользания.
* Иммунологическая толерантность. Животные, которым в раннем возрасте до развития полной иммунологической компетентности прививают опухоль или вводят опухолевые антигены в высокой концентрации, сохраняют специфическую ареактивность к этим опухолям, если таковые им позднее пересаживают. Это явление, видимо, идентично явлению иммунологической толерантности.
* Иммунный отбор. В крупных популяциях опухолевых клеток изредка встречаются клетки, которые потеряли собственные, присущие данной опухоли поверхностные антигены. При наличии иммунного ответа против антигенов опухолевых клеток указанные клетки растут и образуют опухоль. Эти клетки могут нести особый набор антигенов и благодаря этому индуцировать специфический иммунный ответ на себя. Иммунный ответ не вызывает антигенных изменений, он просто отбирает клетки, в которых антигенные изменения уже произошли.
* Антигенная модуляция. Это интересное явление — пример того, как понимание основ биологии микроорганизмов может привести к важнейшему клиническому выводу. В 40-х годах Бил и Зоннеборн обнаружили, что обработка инфузорий антителами, специфичными к антигенам жгутиков, вызывает прекращение их движения. Однако если инфузории были метаболически активны, они вскоре вновь начинали плавать даже в присутствии антител. Дальнейшие исследования показали, что инфузории утратили ранее присутствовавшие на их жгутиках антигены и у них образовался новый набор антигенов. В присутствии антител к новым антигенам модуляция может возникать вновь, что сопровождается либо реэкспрессией первона-чальных антигенов, либо появлением другого, нового набора антигенов. Все эти жгутиковые антигены кодированы в геноме инфузории.
Сходная антигенная модуляция была продемонстрирована для двух систем клеток лейкемии мышей. Лейкемии тимического происхождения (тимомы), индуцированные у мышей некоторых линий тимотропными вирусами лейкемии мышей, экспрессируют ТL антигены. Перенос клеток тимомы животному, иммунному к ТL антигенам, не приостанавливает прогрессиру-ющий рост опухоли. На поверхности лейкемических клеток, растущих у таких реципиентов, не обнаружено ТL антигенов. Когда анти-ТL антитела добавляют в культуру тканей к ТL -положительным лейкемическим клеткам, они тоже теряют ТL антигены и в течение нескольких часов 100 % клеток становятся ТL -отрицательными. В отсутствие анти-ТL антител ТL антигены обычно появляются вновь; это свидетельствует о том, что как регуляторные, так и структурные гены - для ТL антигенов сохраняются в модулированных клетках и их потомках.
Молекулы иммуноглобулина на поверхности В-клеток и клеток лейкемий В-клеточного происхождения также подвержены антигенной модуляции. В этом случае было прямо продемонстрировано, что некоторые молекулы антигенов сходят с поверхности клеток, в то время как другие поглощаются путем эндоцитоза.
* Иммуностимуляция. В 50-х годах было впервые выдвинуто предположение о том, что некоторые иммунные реакции, возникающие в ответ на опухоль, в действительности вызывают более быструю и интенсивную пролиферацию раковых клеток. Недавно на нескольких опухолевых системах было проде-монстрировано, что слабый иммунный ответ может действительно способ-ствовать усилению роста опухолевых клеток. Механизм этой стимуляции неизвестен.
* Иммуносупрессия. Существует по крайней мере два пути развития иммуносупрессии у раковых больных. Самой распространенной является иатрогенная иммуносупрессия, т. е. иммуносупрессия, вызванная агентами, используемыми для лечения рака. Побочное действие большинства раковых агентов, включая ионизирующее.облучение и цитотоксические лекарствен-ные препараты, состоит в разрушении лимфоцитов и других клеток, игра-ющих важную роль в возникновении и поддержании иммунного ответа.
При некоторых видах рака сами опухоли, видимо, выделяют иммуносупрес-сорные факторы. Наиболее ярким примером этого явления служит болезнь Ходжкина, при которой небольшая опухоль в единичном лимфатическом узле выделяет сама или стимулирует выделение иммуносупрессорных факторов, оказывающих мощное воздействие на всю клеточноопосредован-ную иммунную систему. Пациенты, страдающие болезнью Ходжкина, дают слабую реакцию гиперчувствительности замедленного типа и высоко чувствительны к таким инфекциям, при которых инфекционный агент размножается в клетках, например туберкулез и инфекции, вызванные вирусом герпеса.
* Иммунологическое усиление. В некоторых случаях животные, предвари-тельно иммунизированные разрушенными аллогенными клетками опреде-ленной опухоли, а затем зараженные этой же опухолью, не отторгают ее и, в конечном итоге, погибают. У неиммунизированных животных, зараженных той же самой опухолью, наблюдают лишь незначительный рост опухоли с ее последующим отторжением. Ряд выполненных экспериментов позволяет предположить существование нескольких механизмов этого парадоксального явления.
Иммунологическое усиление роста опухолевых аллотрансплантатов может осуществляться путем пассивного переноса сыворотки от иммунного хозяина сингенному неимунному реципиенту даже в том случае, если введение антисыворотки происходит только на 7-й день после имплантации опухоли. Этот результат позволяет допустить, что усиление происходит вследствие блокады эффекторных механизмов, которые в норме способствуют отторжению опухоли.
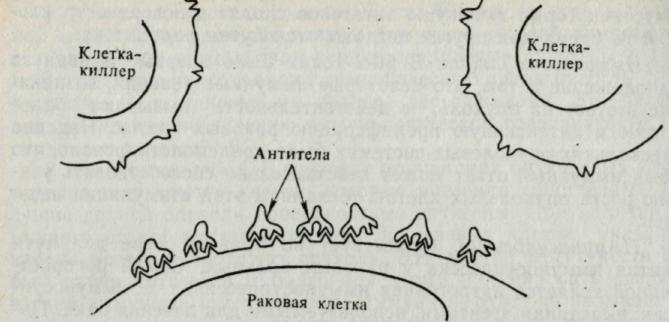
Рис. 9. Блокада функции эффекторных клеток (киллеров) конкурирующими антителами, направленными против тех же антигенов клеток -мишеней, которые распознаются клетками-киллерами.
Однако иммунологическое усиление наблюдается также при введении опухолевых клеток, предварительно обработанных усиливающими анти-телами. Поэтому можно предположить, что усиление осуществляется бла-годаря нарушению механизма сенсибилизации. Эксперименты в модельной системе in vitro подтверждают существование сывороточных блокирующих факторов, которые препятствуют действию эффекторных клеточных механизмов. Рост опухолевых клеток в культуре ткани обычно ингибируют лимфоциты ракового больного.
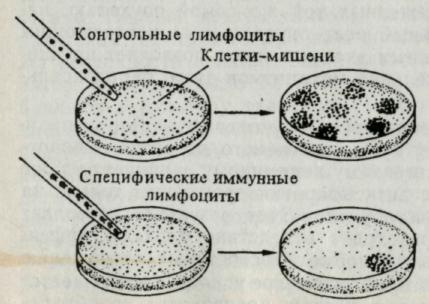
Рис.10. Тест ингибирования образования колоний основан на уничтожении опухолевых клеток или ингибировании их роста специфическими иммунными лимфоцитами. Сравнивая число колоний, образованных в присутствии иммунных и контрольных лимфоцитов, можно определить про
Дата добавления: 2016-09-06; просмотров: 1950;










