ТГФ ДМСО ДМФА ГМФТА
Лекция Галогенпроизводные.
Номенклатура.
Окончание галогенид - фторид, хлорид, бромид, иодид.
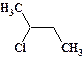 В приставке: название галогена с указанием положения в цепи.
В приставке: название галогена с указанием положения в цепи.
втор-бутилхлорид, 2-бутилхлорид или 2-хлорбутан,
(в данном примере не указана конфигурация хирального центра)
В связи с высокой электроотрицательностью, галогены проявляют –I эффект по отношению к связанному с ними атому углерода. За счет этого, на атом углерода наводится частичный положительный заряд, то есть он проявляет электрофильные свойства (в качестве примера можно привести алкилирование по Фриделю-Крафтсу ароматических соединений).
Методы получения.
1. Действие галогенов (Cl2, Br2) на предельные углеводороды (алканы) по радикальному механизму (см. лекцию 1)
2. Присоединение галогенов и галогеноводородов к алкенам диенам и алкинам (см. лекции 2 и 3)
3. Взаимодействие ароматических соединений с галогенами в присутствии кислот Льюиса (см. лекцию 4)
4. реакция спиртов с галогенидами фосфора, серы и с галогеноводородами. Например, реакция первичного спирта с PCl5: R-CH2-OH + PCl5 ® R-CH2-Cl + HCl + POCl3 с образованием алкилхлорида и хлорокиси фосфора. Или реакция третичного спирта с концентрированной соляной кислотой: R3C-OH + HCl(конц) ® R3C-Cl + H2O.
5. Получение фтористых алкилов действием фторида серебра на алкилиодиды.
6. Синтез арилфтоидов заменой ароматической нитрогруппы на фтор под действием фторида цезия SNAr, и введение фтора термолизом тетрафторборатов арилдиазония.
7. Реакция замены галогенов в галогенпроизводных на йод под действием иодида калия или натрия в ацетоне (реакция Финкельштейна)
Химические свойства:
 Реакция нуклеофильного замещения. (SN)
Реакция нуклеофильного замещения. (SN)
В зависимости от молекудярности подразделяюи два механизма:
SN1Мономолекулярная реакция (общая скорость реакции зависит только от концентрации галогенпроизводного).
механизм SN1:
Так как реакция идет через плоское Sp2 переходное состояние (карбокатион) то при использовании хирального (оптически активного) субстрата в результате реакции образуется рацемический продукт.
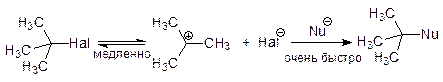
Конкурирующим процессом для реакции SN1является реакция мономолекулярного элиминирования Е1 где первая стадия механизма полностью совпадает с первой стадией механизма SN1.
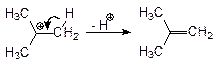
| Скорость-лимитирующая стадия такая же как и в реакции SN1, поэтому на соотношение продуктов не влияет сила основания и полярность растворителя, и это соотношение одинаково для данного конкретного субстрата в любых условиях. |
Скорость депротонирования промежуточного карбокатиона, в общем случае, меньше чем реакция его с нуклеофилом, поэтому в продуктах данной реакции преобладает продукт SN1, однако скорость реакции элиминирования сильнее зависит от температуры и при повышенных температурах начинает преобладать процесс элиминирования.Смещение равновесия в сторону образования продукта замещения (SN1) можно осуществить используя большой избыток нуклеофильного агента (например в качестве растворителя). Смещение равновесия в сторону Е1 достигается повышением температуры (термодинамический контроль) и использованием ненуклеофильного окружения (инертный растворитель и ненуклеофильная среда).
SN2Бимолекулярная реакция (общая скорость реакции зависит как от концентрации галогенпроизводного так и атакующего нуклеофила).
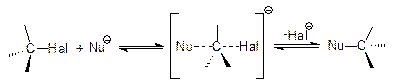
Исходя из пирамидальной структуры переходного состояния, при использовании оптически активного субстрата наблюдается обращение конфигурации хирального центра.
Конкурирующим процессом для реакции SN2является реакция бимолекулярного элиминирования Е2
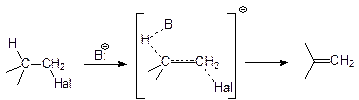
| На соотношение продуктов влияют многие факторы, основным из которых является соотношение основности и нуклеофильности атакующей частицы. |

Скорости реакций нуклеофильного замещения и элиминирования в данном случае сопоставимы. В общем случае, преобладание продукта реакции Е2 обусловливается большим размером атакующей частицы (затруднен подход к углеродному центру для осуществления замещения). Увеличение силы нуклеофила по сравнению с его основностью, а также применение в качестве реакционной среды полярных апротонных растворителей таких как тетрагидрофуран (ТГФ), диметилсульфоксид (ДМСО), диметилформамид (ДМФА) или гексаметилфосфатриамид (ГМФТА), способствующих диссоциации реагента и селективной сольватации противоиона наоборот смещает равновесие в сторону процесса SN2.
ТГФ ДМСО ДМФА ГМФТА
Температурная зависимость реакций бимолекулярного замещения и элиминирования сходна с мономолекулярными процессами.
«Сила» нуклеофила.
Если отбросить факторы сольватации в растворе и рассматривать процесс замещения в газовой фазе, то выстраивается достаточно простой ряд нуклеофильности (данные получены исследованием кинетики реакций замещения в газовой фазе методом ионного циклотронного резонанса ИЦР):
OH- > F- > CH3O- > CH3S- > CN- ~ Cl- > Br-> I-
Видно, что сила нуклеофила увеличивается с уменьшением радиуса частицы и увеличением локализованного отрицательного заряда.
При переходе от газовой фазы к раствору скорость реакций SN2 уменьшается более чем на 10 порядков! За счет сольватации исходных частиц резко понижается их потенциальная энергия, а энергия переходного состояния [Nu-C-X]- с делокализованным зарядом уменьшается незначительно. Следовательно, возрастает энергия активации процесса в целом и уменьшается скорость. Полярные протонные растворители сильнее сольватируют маленькие «жесткие» анионы, а большие «мягкие» остаются менее сольватированными и, следовательно, более реакционно-способными. Поэтому при проведении реакции замещения в этих растворителях ряд силы нуклеофилов (на примере галогенов) меняется на противоположный:I- > Br-> Cl- > F-. При проведении реакции в полярных апротонных растворителях сравнительная нуклеофильность близка к последовательности в газовой фазе, но скорость процесса несопоставимо ниже.
Таким образом, чем сильнее основные свойства атакующей частицы и слабее ее нуклеофильные свойства, тем больше образуется продукта бимолекулярного элиминирования, и наоборот.
Дата добавления: 2016-06-15; просмотров: 1576;










