Приближение МО ЛКАО. Уравнения Рутана.
Уравнения Хартри-Фока для молекул можно, в принципе, решить численно, получив МО в виде таблиц. Извлечение, однако, химической информации из МО, представленных таким образом - нелегкая задача. Существует простое и мощное приближение, позволяющее существенно упростить как решение уравнений ХФ, так и интерпретацию результатов. Суть его в следующем.
Двигаясь по молекуле, каждый электрон попадает под преимущественное влияние поля ядра, вблизи которого электрон находится в данный момент. Это означает, что его МО вблизи этого ядра должна быть близкой к соответствующей АО. Поэтому каждую МО можно представить как линейную комбинацию всех АО системы:

Коэффициенты разложения сim определяют “вес” каждой АО в МО; ясно, что одна и та же АО входит в разные МО с разными весами, т.е. эти коэффициенты различны для каждой МО.
Представление (2.12) очень удобно для применения вариационного метода. Применяя его с учетом ортонормированности МО, из условия минимума энергии получают уравнения ХФ в виде:

Элементы матрицы Фока в приближении МО ЛКАО имеют вид:

где



а Sij –матрица интегралов перекрывания между АО cm и cn , а Еm - одно из решений секулярного уравнения

Уравнения (2.13) называются уравнениями Рутана.
Уравнения Рутана можно переписать в матричном виде:
F C = S C E ,(2.19)
который путем унитарных преобразований F+=S-1/2FS-1/2 и C+=S-1/2C сводится к стандарнной задаче на собственные значения.
F+C+= EC+. (2.20)
Введем теперь матрицу P c элементами

(суммирование ведется по занятым МО). Она называется матрицей зарядов-порядков связей или матрицей плотности; смысл этого названия будет объяснен позже. Эта матрица играет важную роль в теории химической связи, поскольку о писывает распределение электронной плотности по молекуле.
Энергия молекулы с закрытыми оболочками в терминах введенных обозначений записывается следующим образом:

Решение уравнений Рутана осуществляется таким же итерационным методом ССП, как и в случае атома. Блок-схема вычислительного процесса представлена на рис. 2.1. 
Двухэлектронные кулоновский 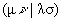 и обменный
и обменный  интегралы по АО (или по базисным функциям - см. ниже) являются причиной большинства практических проблем в случае, когда расчет проводится из первых принципов. Число их без учета симметрии равно » N4/8, где N - число АО, т.е. очень велико (для сравнения: число одноэлектронных интегралов hm n равно » N2/2 – см. табл. 2.2). Таким образом, вычисление этих интегралов и их запоминание в памяти компьютера представляет собой отдельную проблему, особенно, если учесть, что все четыре орбитали cm ,cn , cl и cs в общем случае центрированы на разных ядрах. Отсюда ясно, сколь важен для эффективного вычислительного процесса выбор аналитического вида функций, по которым вычисляются интегралы. В так называемых прямых ССП методах (доступных при наличии суперкомпьютеров), эти интегралы не запоминаются, а вычисляются в каждой итерации. При этом малыми по величине интегралами часто пренебрегают, что увеличивает риск ошибки, ибо число их велико, а знаки одинаковы (положительны).
интегралы по АО (или по базисным функциям - см. ниже) являются причиной большинства практических проблем в случае, когда расчет проводится из первых принципов. Число их без учета симметрии равно » N4/8, где N - число АО, т.е. очень велико (для сравнения: число одноэлектронных интегралов hm n равно » N2/2 – см. табл. 2.2). Таким образом, вычисление этих интегралов и их запоминание в памяти компьютера представляет собой отдельную проблему, особенно, если учесть, что все четыре орбитали cm ,cn , cl и cs в общем случае центрированы на разных ядрах. Отсюда ясно, сколь важен для эффективного вычислительного процесса выбор аналитического вида функций, по которым вычисляются интегралы. В так называемых прямых ССП методах (доступных при наличии суперкомпьютеров), эти интегралы не запоминаются, а вычисляются в каждой итерации. При этом малыми по величине интегралами часто пренебрегают, что увеличивает риск ошибки, ибо число их велико, а знаки одинаковы (положительны).
Таблица 2.2 Общее число одноэлектронных и двухэлектронных интегралов в зависимости от базиса
| Молекула | Базис | Одноэлектронные интегралы | Двухэлектронные интегралы | Общее число интегралов | |
| N | тип АО | ||||
| Н2 CH4 Бензол C6H6 | 1s 1s-, 2s-, 2p- АО углерода, 1s-AO водорода 1s-, 2s-, 2p-AO углерода, 1s-AO водорода |
Волновая функция и энергии, получаемые с помощью метода Рутана
(и с помощью метода Хартри-Фока вообще), инвариантны относительно ортогонального преобразования занятых электронами спин-орбиталей. Это означает, в частности, что если вместо АО для построения МО (2.12) будут использованы их линейные комбинации, полученные с помощью ортогональных преобразований, то одновременно и согласовано изменятся как все одно- и двухэлектронные интегралы, так и матрица P. Волновая функция (2.10) и энергия системы (2.22) при этом останутся прежними. Это очень важное свойство метода: используя его всегда можно облегчить концептуальную химическую трактовку результатов, например, перейти к локализованным МО, описывающим электроны связи и неподеленные электронные пары, гибридизованным АО, и т.д.
Ортогональным преобразованием называется преобразование, которое не меняет длин векторов и углов между ними и переводит один ортонормированный базис в другой ортонормированный. Матрица ортогонального преобразования Т обладает свойствами: ТТ' = 1, det T =± 1.
Введение приближения МО ЛКАО ограничивает точность метода ХФ лишь постольку, поскольку конечное число АО реально включается в расчеты. В принципе, чтобы воспроизвести точное ХФ решение, потребовалось бы использовать бесконечное число функций в разложении (2.12) – этот случай известен как хартри-фоковский предел.
Приведем несколько примеров исследования свойств молекул неэмпирическим методом Хартри-Фока.
Таблица 2.3. Длины связи (А) и углы (град.) для циклофосфорамида
| связь | Рентгеновский Эксперимент | Расчет HF/6-31G* |
| P=O | 1.47 | 1.46 |
| P-O | 1.58 | 1.59 |
| P-N | 1.63 (экзоциклическая) 1.63 (эндоциклическая) | 1.65 (экзоциклическая) 1.67 (эндоциклическая) |
| C-Cl | 1.78, 1.79 | 1.79, 1.80 |
| - C-N-C | 117.0 | 117.7 |
| - P-N-C | 121.0 (экзоциклическая) 122.0 (эндоциклическая) | 119.7 (экзоциклическая) 122.4 (эндоциклическая) |
Таблица 2.4. Энергии (ккал/моль)вращательные барьеров
| молекула | STO-3G //STO-3G | 3-21G //3-21G | 6-31G* //6-31G** | эксперимент |
| BH3-NH3 | 2.1 | 1.9 | 1.9 | 3.1 |
| CH3-CH3 | 2.9 | 2.7 | 3.0 | 2.9 |
| CH3-NH2 | 2.8 | 2.0 | 2.4 | 2.0 |
| CH3-OH | 2.0 | 1.5 | 1.4 | 1.1 |
| CH3-SiH3 | 1.3 | 1.1 | 1.4 | 1.7 |
| CH3-PH2 | 1.9 | 1.7 | 2.0 | 2.0 |
| CH3-SH | 1.5 | 1.1 | 1.4 | 1.3 |
| Цис-HO-OH | 9.1 | 11.7 | 9.2 | 7.0 |
| Цис-HS-SH | 6.1 | 5.7 | 8.5 | 6.8 |
После символа // базис, с которым была оптимизирована геометрия.
Таблица 2.5. Энергии (ккал/моль) реакций изомеризации
| Формула | Реакция | HF/6-31G* // 3-21G | Эксперимент |
| HCN | Цианид водорода ® изоцианид водорода | 12.4 | 14.5 |
| CH2O | Формальдегид ® гидроксиметилен | 52.6 | 54.9 |
| CH3NO | Формамид ® нитрозометан | 65.3 | 62.4 |
| C2H3N | Ацетонитрил ® метил изоцианид | 20.8 | 20.9 |
| C2H4O |
Дата добавления: 2022-04-12; просмотров: 78;










