Уравнение Шрёдингера для водородоподобных атомов. Распределение электронов по оболочкам и подоболочкам в атоме
Половинчатая, полуклассическая теория Бора явилась важным этапом в развитии квантовых представлений, введение которых в физику требовало кардинальной перестройки механики и электродинамики. Такая перестройка была осуществлена в 20-е – 30-е годы XX века.
Боровская модель атома позволила нам составить первое (хотя и довольно грубое) представление о строении атома. Она объяснила, почему атомы испускают и поглощают свет с дискретными длинами волн, и решила проблему стабильности атомов. Вычисленные в рамках боровской модели длины волн линейчатого спектра и энергии ионизации атома водорода и одноэлектронных ионов оказались в превосходном согласии с экспериментом. Но теория Бора имела и существенные ограничения. На её основе нельзя было предсказать линейчатые спектры более сложных атомов – даже нейтрального атома гелия всего лишь с двумя электронами. Теория Бора не смогла объяснить, почему линии испускания при более детальном изучении оказались состоящими из двух или большего числа очень близких линий (так называемая тонкая структура). Теория Боране смогла также объяснить, почему одни спектральные линии ярче других. Не получили объяснения и межатомные связи в молекулах, твёрдых телах и жидкостях. Представление Бора об определенных орбитах, по которым движутся электроны в атоме, оказалось весьма условным. На самом деле движение электрона в атоме очень мало похоже на движение планет или спутников. Физический смысл имеет только вероятность обнаружить электрон в том или ином месте, описываемая квадратом модуля волновой функции |Ψ|2. Волновая функция Ψ является решением основного уравнения квантовой механики – уравнения Шрёдингера.
Общее уравнение Шрёдингера:
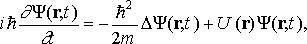
здесь i - мнимая единица; m - масса частицы; r - радиус-вектор, определяющий ее положение; ∆ - оператор Лапласа, который в прямоугольной декартовой системе координат записывается в виде
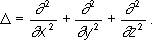
Для любого стационарного состояния волновую функцию можно записать в виде
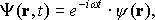
где функция зависит только от координат частицы; w - вещественный параметр (частота волновой функции).
Стационарное уравнение Шрёдингера
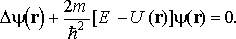
Волновая функция, входящая в это уравнение, описывает состояние микрочастицы в стационарных состояниях.
Чтобы решить волновое уравнение, надо разделить его переменные. Для этого заменяют декартовы координаты x, y, z на сферические r, θ, φ. Тогда волновую функцию можно представить в виде произведения трех функций, каждая из которых содержит только одну переменную:
ψ(x,y,z) = R(r) Θ(θ) Φ(φ)
Функцию R(r) называют радиальной составляющей волновой функции, а Θ(θ) Φ(φ) - её угловыми составляющими.

В сферической системе координат уравнение Шрёдингера преобразуется к виду:
, 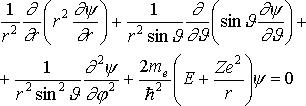 (1)
(1)
где Θ и φ - полярный и азимутальный углы соответственно.
В ходе решения волнового уравнения вводятся целые числа - так называемые квантовые числа (главное n, орбитальное 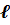 и магнитное mℓ). Функция R(r) зависит от n и
и магнитное mℓ). Функция R(r) зависит от n и 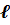 , функция Θ(θ) - от
, функция Θ(θ) - от 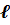 и mℓ, функция Φ(φ) - от mℓ.
и mℓ, функция Φ(φ) - от mℓ.
Геометрическим образом одноэлектронной волновой функции является атомная орбиталь. Она представляет собой область пространства вокруг ядра атома, в которой высока вероятность обнаружения электрона (обычно выбирают значение вероятности 90-95%). Это слово происходит от латинского "орбита" (путь, колея), но имеет другой смысл, не совпадающий с понятием траектории (пути) электрона вокруг атома, предложенным Н. Бором для планетарной модели атома. Контуры атомной орбитали - это графическое отображение волновой функции, полученной при решении волнового уравнения для одного электрона.
Квантовые числа
Квантовые числа, возникающие при решении волнового уравнения, служат для описания состояний квантово-химической системы. Каждая атомная орбиталь характеризуется набором из трёх квантовых чисел: главного n, орбитального 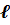 и магнитного mℓ.
и магнитного mℓ.
Главное квантовое число n определяет квантование энергии атома (см. ф.2)
Оно может принимать любые положительные целочисленные значения. Чем больше значение n, тем выше энергия и больше размер орбитали. Решение уравнения Шрёдингера для атома водорода даёт следующее выражение для энергии электрона:
E = −2π2me4 / n2h2 = −1312,1 / n2 (кДж/моль)  (2)
(2)

Таким образом, каждому значению главного квантового числа отвечает определённое значение энергии электрона. Уровни энергии с определёнными значениями n иногда обозначают буквами K, L, M, N... (для n = 1, 2, 3, 4...).
Для E < 0 уравнение имеет конечные и непрерывные решения только для дискретных значений энергии.
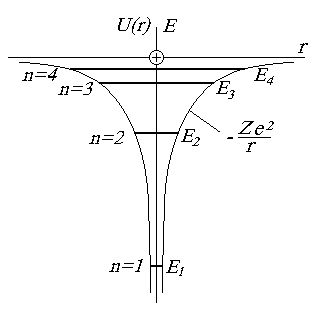 Рис. 1 Энергетическая диаграмма водородоподобного атома
Рис. 1 Энергетическая диаграмма водородоподобного атома
Для квантования момента импульса вводится так называемое орбитальное квантовое число l.
Орбитальное квантовое число 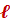 определяет орбитальный момент количества движения электрона Le, т. е. определяет допустимые дискретные значения момента импульса электрона.
определяет орбитальный момент количества движения электрона Le, т. е. определяет допустимые дискретные значения момента импульса электрона.
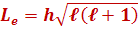 ,
, 

Орбитальное квантовое число 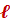 характеризует энергетический подуровень. Атомные орбитали с разными орбитальными квантовыми числами различаются энергией и формой. Для каждого n разрешены целочисленные значения
характеризует энергетический подуровень. Атомные орбитали с разными орбитальными квантовыми числами различаются энергией и формой. Для каждого n разрешены целочисленные значения 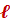 от 0 до (n−1). Значения
от 0 до (n−1). Значения 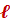 = 0, 1, 2, 3... соответствуют энергетическим подуровням s, p, d, f.
= 0, 1, 2, 3... соответствуют энергетическим подуровням s, p, d, f.
Проекция момента импульса на любое выделенное в пространстве направление (например, направление вектора магнитного поля) также принимает дискретный ряд значений. Для квантования проекции момента импульса вводится магнитное квантовое число mℓ
Магнитное квантовое число mℓ – определяет ориентацию орбитального момента количества движения  относительно избранного направления z, т. е. определяет допустимые дискретные значения проекции момента импульса на ось z.
относительно избранного направления z, т. е. определяет допустимые дискретные значения проекции момента импульса на ось z.
 где mℓ= -ℓ, -(ℓ-1), …0, 1, 2 …, ℓ
где mℓ= -ℓ, -(ℓ-1), …0, 1, 2 …, ℓ
Всего 2ℓ+1 значение.
Квантовые числа n, 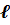 ,mℓ связаны определёнными правилами квантования. Например, орбитальное квантовое число
,mℓ связаны определёнными правилами квантования. Например, орбитальное квантовое число 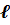 может принимать целочисленные значения от 0 до (n – 1). Магнитное квантовое число mℓ может принимать любые целочисленные значения в интервале ±
может принимать целочисленные значения от 0 до (n – 1). Магнитное квантовое число mℓ может принимать любые целочисленные значения в интервале ±  . Таким образом, каждому значению главного квантового числа n, определяющему энергетическое состояние атома, соответствует целый ряд комбинаций квантовых чисел
. Таким образом, каждому значению главного квантового числа n, определяющему энергетическое состояние атома, соответствует целый ряд комбинаций квантовых чисел 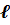 и mℓ. Каждой такой комбинации соответствует определённое распределение вероятности |Ψ|2 обнаружения электрона в различных точках пространства («электронное облако»).
и mℓ. Каждой такой комбинации соответствует определённое распределение вероятности |Ψ|2 обнаружения электрона в различных точках пространства («электронное облако»).
Состояния, в которых орбитальное квантовое число 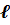 = 0, описываются сферически симметричными распределениями вероятности. Они называются s-состояниями (1s, 2s, ..., ns, ...). При значениях
= 0, описываются сферически симметричными распределениями вероятности. Они называются s-состояниями (1s, 2s, ..., ns, ...). При значениях  > 0 сферическая симметрия электронного облака нарушается.
> 0 сферическая симметрия электронного облака нарушается.
Состояния с 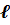 = 1 называются p-состояниями,
= 1 называются p-состояниями,
с 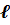 = 2 – d-состояниями и т. д.
= 2 – d-состояниями и т. д.
На рис. 1 изображены кривые распределения вероятности ρ (r) = 4πr2|Ψ|2 обнаружения электрона в атоме водорода на различных расстояниях от ядра в состояниях 1s и 2s.
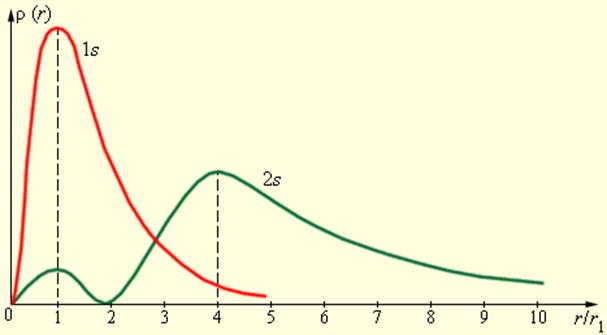
Рисунок 1. Распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s и 2s. r1 = 5,29·10–11 м – радиус первой боровской орбиты
Как видно из рис. 1, электрон в состоянии 1s (основное состояние атома водорода) может быть обнаружен на различных расстояниях от ядра. С наибольшей вероятностью его можно обнаружить на расстоянии, равном радиусу r1 первой боровской орбиты. Вероятность обнаружения электрона в состоянии 2s максимальна на расстоянии r = 4r1 от ядра. В обоих случаях атом водорода можно представить в виде сферически симметричного электронного облака, в центре которого находится ядро.
Область пространства, в которой высока вероятность обнаружить электрон, называют подоболочкой или орбиталью. Вид основных типов орбиталей показан на рис.2.
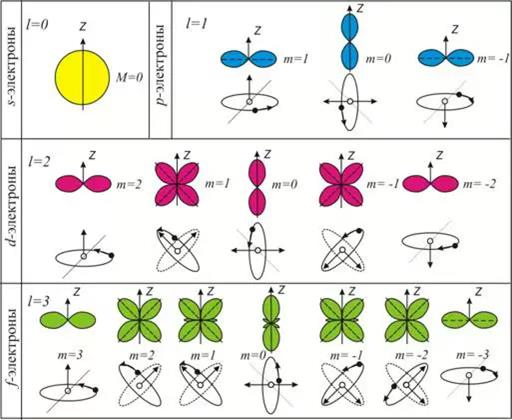
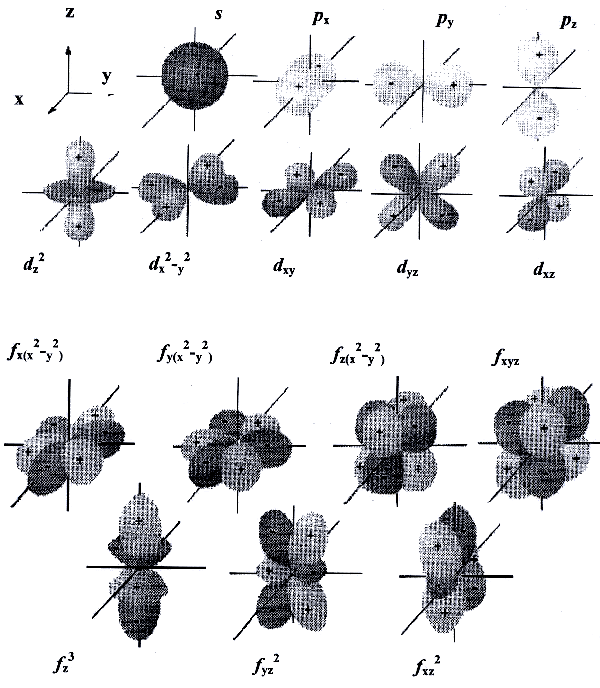
Электрон, занимающий определённую орбиталь, характеризуется тремя квантовыми числами, описывающими эту орбиталь. и четвёртым квантовым числом (спиновым) ms, которое характеризует спин электрона - одно из свойств (наряду с массой и зарядом) этой элементарной частицы.
СПИН
В 1925 году Гоуделлит и Уленбек выдвинули предположение, что еще одно квантовое число s, которое должно определять различие двух состояний при одинаковых значениях n и l может быть связано с вращением электрона вокруг своей оси. Действительно если электрон вращается вокруг своей оси, то он должен обладать механическим моментом количества движения s и (поскольку он имеет электрический заряд) магнитным моментом Pm.Этот собственный момент количества движения Ps получил название спина электрона.
Подобно тому, как орбитальный момент может располагаться под 2l+1 различными углами к выбранной за преимущественное направление координатной оси, а его проекции на это направление могут быть только кратны ћ, спин электрона должен располагаться под 2s+1 углами к этой координатной оси (например OZ).
Его величина 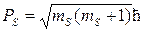 , а проекции на эту ось кратны ћ,
, а проекции на эту ось кратны ћ,
то есть  .
.
За преимущественное направление у координатных осей при определении ориентации спина логично принять направление магнитного поля, образуемого за счет орбитального движения электрона, поскольку наличие этого поля должно (даже в отсутствие внешнего магнитного поля) приводить к расщеплению характеризующихся данными значениями квантовых чисел n, l уровней на 2s+1 подуровней.
Для объяснения расщепления каждого уровня на 2 подуровня следует, очевидно, записать равенство 2mS+1=2, то есть принять, что спиновое квантовое число имеет полуцелое значение mS = ½.При этом величина спина оказывается равной 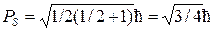 , а его проекции на совпадающую с преимущественным направлением координатную ось принимает значение 1/2
, а его проекции на совпадающую с преимущественным направлением координатную ось принимает значение 1/2 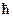 и – 1/2
и – 1/2 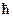 .
.
 Таким образом, спиновое квантовое число принимает ориентацию собственного момента количества движения электрона (спина
Таким образом, спиновое квантовое число принимает ориентацию собственного момента количества движения электрона (спина 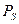 ) относительно избранного направления Н: вектор
) относительно избранного направления Н: вектор 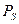 может ориентироваться относительно Н лишь так, что его проекция на Н равна:
может ориентироваться относительно Н лишь так, что его проекция на Н равна:

mS =1/2 mS = – 1/2
Спин - собственный магнитный момент количества движения элементарной частицы.Хотя это слово по-английски означает "вращение", спин не связан с каким-либо перемещением частицы, а имеет квантовую природу. Спин электрона характеризуется спиновым квантовым числом ms, которое может быть равно +1/2 и −1/2.
| <== предыдущая лекция | | | следующая лекция ==> |
| | | Физические основы вакуумной и плазменной электроники |
Дата добавления: 2017-01-26; просмотров: 3034;










