Условия равновесия двухфазной однокомпонентной системы
В качестве примера рассмотрим изолированную замкнутую однокомпонентную систему, состоящую из двух фаз (например, газ и вода)
В такой системе:
U = U1 + U2 = const
V = V1 + V2 = const (9)
N = N1 + N2 = const
S = S1 + S2. Условие равновесия: δS = 0, δS = δS1 + δS2
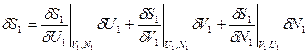
Производные берутся в состоянии равновесия, где (1) – равенство, и 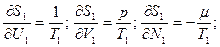 В результате имеем:
В результате имеем:
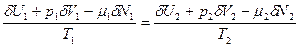 (10)
(10)
В силу (9): δU1 = - δU2, δV1 = - δV2, δN1 = - δN2 Тогда из (10):
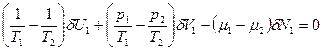 (11)
(11)
Откуда следует независимость вариаций δU1, δV1, δN1. Имеем:
(12) T1 = T2, p1 = p2, μ1 = μ2 – условия частного фазового равновесия однокомпонентной системы. Если предположить, что в системе происходит процесс выравнивания (p и T считаем const), и происходит переток вещества из одной фазы в другую, то μ1 ≠ μ2. Тогда из (7): δФ = μ1δN1 + μ2δN2 < 0, но δN1 = - δN2, и (μ1 – μ2)δN1 ≤ 0 (13)
Теперь, если μ1 > μ2, то δN1 < 0, т.е. N1 убывает, а N2 растет, и переток вещества от фазы с большим μ к фазе с меньшим μ (!).
Т.о. для потока вещества из одной фазы в другую μ играет туже роль, какую температура Т – для потока тепла (от > к <) и давление для потока газа в соответствующих процессах выравниваются.
Полученные условия (12) можно объединить в одно:
μ1(p, T) = μ2(p, T) (14)
- условие фазового равновесия, которое показывает, что в состоянии равновесия двух фаз давление оказывается функцией температуры, p и T перестают быть независимыми. p(T) – кривая равновесия . (14) верно для однородных систем без внешнего поля. Если оно есть (например, поле тяжести), то в состоянии равновесия одинаковы лишь температуры, давление же и μ являются функциями координат. От координат в этом случае не зависит величина μ + U (U – потенциальная энергия частицы во внешнем поле)
Правило фаз Гиббса
Обобщим условия равновесия на многокомпонентную систему, состоящую из n компонент. Сколько фаз Г может содержать?
P и T должны быть одинаковы везде, ясно. Поскольку n компонентов, r фаз, то можем ввести nГ хим потенциалов 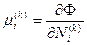 , где
, где 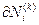 - число молей i-го компонента в к-ой фазе. Обобщая (14) на наш случай имеем в равновесии:
- число молей i-го компонента в к-ой фазе. Обобщая (14) на наш случай имеем в равновесии:
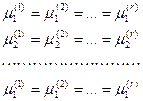 (15)
(15)
всего имеем n(r-1) уравнений. Даже не зная конкретного вида μi(k) мы можем установить важную закономерность – правило фаз Гиббса
Состав каждой фазы определяется относительной концентрацией компонентов.
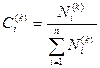 (16) – концентрация i-ой компоненты в k-ой фазе. Сi(k) – не независимы, т.к.
(16) – концентрация i-ой компоненты в k-ой фазе. Сi(k) – не независимы, т.к. 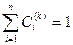
и независимых концентраций в каждой фазе (n-1). Полное число параметров (независимых переменных), характеризующих состояние системы, включая T и p, равно, т.о. 2 + (n - 1)r. Уравнений, как мы выяснили n(r-1), см (15). Число независимых уравнений не должно превышать число переменных:
n(r-1)≤2 + r(n-1) => r ≤ n+2 (17) – правило фаз Гиббса.
Число фаз в равновесии не превышает число компонент + 2. Число термодинамических степеней свободы, т.е. число свободных параметров, которые можем изменять, не нарушая равновесия, равно f=(2+(n-1)r)-n(r-1)=n+2-r.
Пусть n=1, одна компонента.
Тогда rmax=3 (r≤3); f=3-r
Если r=2, то число независимых параметров f=1, и есть зависимость (кривая), связывающая, например, p и T – кривая равновесия. Если r=1 (одна фаза), то р и Т могут быть и не зависимы (уравнение состояния: р и Т входят вместе pV=RT).
rmax=3 : здесь нет лишних степеней свободы, можно найти соотв. значения р и Т.
В этой единственной точке существуют три другие единовременно. Это тройная точка.
Для «вода-пар-лед» понятно, в районе 0, но равновесие при Т=273,16 оК, р=0,008 атм. Именно эта температура для калибровки шкалы Кельвина.
Но есть вещества, у которых может быть 4 фазы. Например, это кристаллическая сера. Здесь есть три тройные точки, а все 4 одновременно существовать не могут (две разновидности кристаллов). 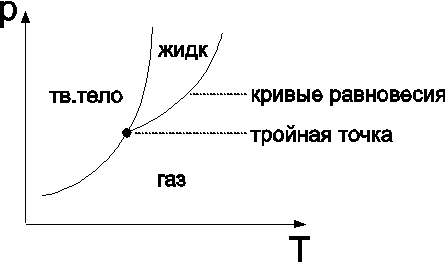

Дата добавления: 2021-05-28; просмотров: 182;










