Восстановители и окислители
Основные положения теории окисления – восстановления
Сущность окисления состоит в отдаче окисляющимся веществом (восстановителем) валентных электронов окислителю, который, принимая электроны, восстанавливается.
Сущность восстановления состоит в присоединении восстанавливающимся веществом (окислителем) электронов восстановителя, который, отдавая электроны, окисляется.
Например, в реакции:
С + PbO = Pb + CO
 – окисление; восстановитель
– окисление; восстановитель
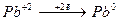 – восстановление; окислитель
– восстановление; окислитель
Процесс отдачи веществам (атомом, ионом) электронов называется окислением, а процесс присоединения веществом электронов называется восстановлением.
Вещества (атомы, ионы) в процессе химической реакции, присоединяющие электроны, называются окислителями, а вещества, отдающие электроны, называются восстановителями.
Восстановители и окислители
Группа восстановителей: восстановителями могут быть нейтральные атомы металлов – восстановительные свойства металлов зависят от агрегатного состояния, среды, величины радиуса атома и количества валентных элементов. Сильными восстановителями являются атомы с малым потенциалом ионизации. К ним относятся атомы электронов двух первых главных подгрупп периодической системы элементов – щелочные и щелочноземельные металлы, а также алюминий, железо и другие. Франций является самым сильным восстановителем из всех элементов периодической системы. В химических реакциях восстановители отдают электроны согласно схеме:  .
.
Восстановительные свойства проявляют и неметаллы (углерод, водород); отрицательно заряженные ионы неметаллов (к данной группе относятся анионы в бескислородных кислотах и их солях: H2S-S2-, H2Se-Se2-, HJ-J-, HBr-Br- и другие. Сильные восстановительные свойства проявляют водород, находящийся в степени окисления (-1), т.е. в гидридах металлов – CaH2); положительно заряженные ионы металлов в низшей степени окисления (это ионы металлов, которые при взаимодействии с сильными окислителями могут еще повышать свою степень окисления: Sn+2, Fe+2, Cr+2, Mn+2); сложные ионы и молекулы, содержащие атомы в состоянии промежуточной степени окисления (сложные ионы SO  , NO
, NO 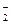 , AsO
, AsO 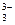 , CrO
, CrO 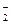 , [Fe (CN)6]4- проявляют восстановительные свойства, так как у них атомы серы, азота, мышьяка, хрома и железа находятся в состоянии промежуточной степени окисления: S+4, N+3, As+3, Cr+3, Fe+2; аналогичными свойствами обладают и некоторые молекулы:
, [Fe (CN)6]4- проявляют восстановительные свойства, так как у них атомы серы, азота, мышьяка, хрома и железа находятся в состоянии промежуточной степени окисления: S+4, N+3, As+3, Cr+3, Fe+2; аналогичными свойствами обладают и некоторые молекулы:  ,
,  ,
,  ).
).
Дата добавления: 2016-11-04; просмотров: 1924;










