СОЕДИНЕНИЙ. ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕ.
ОСНОВЫ РЕАКЦИОННОЙ СПОСОБНОСТИ ОРГАНИЧЕСКИХ
Вопрос 1.Понятие об оптической изомерии органических соединений.Среди органических соединений встречаются вещества, способные вращать плоскость поляризаации света. Это явление называют оптической активностью, а соответствующие вещества - оптически активными. Оптически активные вещества встречаются в виде пар оптических антиподов - изомеров, физические и химические свойства которых в обычных условиях одинаковы, за исключением одного - знака вращения плоскости поляризации. (Если один из оптических антиподов имеет, например, удельное вращение 20 о, то другой - удельное вращение -20 о).Оптическая изомерия появляется тогда, когда в молекуле присутствует асимметрический атом углерода; так называют атом углерода, связанный с четырьмя различными заместителями. Возможны два тетраэдрических расположения заместителей вокруг асимметрического атома. Обе пространственные формы нельзя совместить никаким вращением; одна из них является зеркальным изображением другой:
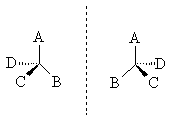
Рассмотренный вид изомерии называют оптической изомерией, зеркальной изомерией или энантиомерией. Обе зеркальные формы составляют пару оптических антиподов или энантиомеров.
Вопрос 2. Ассиметрические атомы углерода. Хиральные молекулы.
Чаще всего оптическая активность обусловлена наличием в молекуле асимметричного атома углерода, т. е. атома углерода, связанного с четырьмя различными заместителями. Примером может служить молочная кислота: CH3C*H(OH)COOH (асимметрический атом углерода отмечен звёздочкой). Согласно тетраэдрической модели атома углерода, заместители располагаются в углах правильного тетраэдра, в центре которого находится атом углерода:

Как видно из приведённых формул, молекула молочной кислоты ни при каком перемещении в пространстве не может совпасть со своим зеркальным отображением. Эти две формы кислоты относятся друг к другу, как правая рука к левой, и называются оптическими антиподами (энантиомерами).Все химические свойства оптических антиподов идентичны; одинаковы и их физические свойства, за исключением оптической активности: одна форма вращает плоскость поляризации света влево [l-или (—)-форма], другая — на тот же по величине угол вправо [d-или (+)-форма]. Ясно, что две формы одного и того же вещества с противоположными знаками вращения имеют зеркально-противоположные конфигурации. Одинаковый знак вращения разных веществ не служит доказательством сходства их конфигураций, а вещества с противоположным знаком вращения могут иметь одинаковые конфигурации, как, например, левовращающая молочная кислота и её правовращающие эфиры.Хиральность (молекулярная хиральность) — в химии свойство молекулы быть несовместимой со своим зеркальным отражением любой комбинацией вращений и перемещений в трёхмерном пространстве.Наряду с конфигурацией и конформацией хиральность — основное понятие современной стереохимии. Хиральностью обладают молекулы, в которых отсутствуют зеркально-поворотные оси симметрии Sn
Вопрос 3.Относительная и абсолютная конфигурация молекул. Проекции Фишера.
При рассмотрении пространственного строения веществ с асимметрическими атомами различают их относительную и абсолютную конфигурации. Относительная конфигурация — это взаимное расположение заместителей при разных асимметрических атомах по отношению друг к другу; обычно ее обозначают приставками к основному названию вещества (цис- и транс-, трео- и эритро-, мезо-, алло- и др.). Абсолютная конфигурация — это истинное расположение в пространстве заместителей при каждом асимметрическом атоме молекулы; чаще всего ее обозначают буквами D или L. Например, правовращающая и левовращающая винные кислоты обладают противоположными (антиподными) абсолютными конфигурациями, но одинаковой относительной конфигурацией, отличающейся в то же время от относительной конфигурации мезовинной кислоты
(различные расстояния между группами ОН, СООН и т. д.):

Относительная конфигурация многих веществ может быть выяснена различными химическими и физическими методами. Прямое же определение абсолютной конфигурации, напротив, представляет очень трудную задачу, которую пока удалось решить только на одном примере: в 1951 г. путем рентгеноструктурного анализа калий-рубидиевой соли D(+)-винной кислоты было установлено, что эта кислота обладает абсолютной конфигурацией, изображаемой приведенными выше формулами. Тем не менее одного этого эксперимента достаточно, чтобы решить вопрос об истинном пространственном строении огромного числа оптически деятельных соединений путем корреляции (установления соответствия) их абсолютных конфигураций и сведения этих соединений в стерические ряды.
В качестве стереохимического стандарта еще в 1906 г., по предложению М. А. Розанова, был избран глицериновый альдегид, (+)-форме которого была произвольно приписана формула (I), а (—)-форме — формула (II):

С тех пор абсолютные конфигурации других оптически деятельных соединений рассматривались как соответствующие либо правовращающему, либо левовращающему антиподу глицеринового альдегида, в результате чего возникли два ряда конфигуративно родственных соединений —D-ряд и L-ряд.При этом корреляция конфигураций различных веществ чаще всего осуществлялась химическим путем. Например, (+)-глицериновый альдегид был окислен в (—)-глицериновую кислоту, которая была получена также из (+)-изосерина при его диазотировании; (+)-изосерин в свою очередь был дезаминирован с образованием (—)-молочной кислоты и получен из (+)-винной кислоты через (—)-хлоряблочную и (+)-яблочную кислоты:

Отсюда следовало, что все эти соединения обладают одинаковой конфигурацией, которая была обозначена как D-конфигурация по основному члену ряда —D(+)-глицериновому альдегиду. Сравнивая выведенную этим путем проекционную формулу (+)-винной кислоты с установленной на основании рентгеноструктурных данных ее пространственной формулой, можно легко убедиться, что сделанный ранее произвольный выбор проекционной формулы (+)-глицеринового альдегида случайно оказался правильным. Следовательно, абсолютные конфигурации теперь уже не являются условными, а правильно отражают истинное пространственное строение молекул. Формулы Фишера (проекции Фишера), способ изображения на плоскости пространств. структур органических соединений., имеющих один или несколько. хиральных центров. При проектировании молекулы на плоскость (рисасимметричный. атом обычно опускают, сохраняя лишь перекрещивающиеся линии и символы заместителей; при этом заместители, находящиеся перед плоскостью, располагают справа и слева, а за плоскостью - вверху и внизу (пунктирная линия).

Формулы Фишера для молекулы с одним асимметричным. атомом (I), а также схема построения такой формулы для соединений с двумя асимметричными. атомами (П). Цепь молекулы с несколькими асимметричными атомами располагают в пространстве вертикально в виде равномерно выпуклой ломаной линии, обращенной выпуклостью к наблюдателю. При написании Фишера формул обычно функциональную группу (если она стоит в конце цепи) ставят наверху и главную цепь располагают вертикально. При повороте формулы в плоскости чертежа на 180°, а также в случае двух (или любого четного числа) перестановок заместителей у одного асимметричнго атома С либо при перемене местами трех заместителей по часовой или против часовой стрелки (формулы б, в, г) стереохимический. смысл формулы не меняется; поворот формулы на 180° с выводом из плоскости, а также перемена местами двух заместителей (т.е. нечетное число перестановок) приводит к проекции антипода (а и б):

Вопрос 4. Индуктивный эффект
Одним из свойств ковалентной связи является некоторая подвижность электронной плотности. Она способна смещаться в сторону одного из атомов.
Если ковалентной связью связаны два совершенно тождественных атома, то электронная плотность будет равномерно распределена между этими атомами и связь будет неполярной. Атомы, связанные неполярной ковалентной связью, не несут зарядов, они электронейтральны, например в молекуле этана СH3 – СН3.
Если один из атомов более электроотрицателен, чем его партнер по связи, то электронная плотность будет смещена в сторону этого атома и связь будет полярной. Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой "дельта" (δ). Атом, оттягивающий электронную плотность σ-связи в свою сторону, приобретает частичный отрицательный заряд δ–. При рассмотрении пары атомов, связанных ковалентной связью, более электроотрицательный атом называют электроноакцептором. Его партнер по σ-связи соответственно будет иметь равный по величине дефицит электронной плотности, т.е. частичный положительный заряд δ+, и будет называться электронодонором. Например, если в неполярную молекулу метана СH4 ввести электроноакцепторные заместители, то их связь с атомом углерода будет полярной. Смещение электронной плотности полярной σ-связи обозначается прямой стрелкой, совпадающей с валентной черточкой.
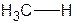
| 
| 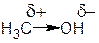
|
| Метан | Хлорметан | Метанол |
| Связь C-H малополярна | Связь C-Cl полярна | Связь C-O полярна |
Наличие полярной связи в молекуле сказывается на состоянии соседних связей. Они испытывают влияние полярной связи, и их электронная плотность также смещается в сторону электроотрицательного элемента, т.е. происходит передача электронного эффекта.
Смещение электронной плотности по цепи s-связей называется индуктивным эффектом и обозначается буквой I. Индуктивный эффект передается по цепи с затуханием. Направление смещения электронной плотности всех s-связей также обозначают прямыми стрелками. Индуктивный эффект передается по цепи с затуханием. Направление смещения электронной плотности всех s-связей также обозначают прямыми стрелками.

| 
|

| 
|
Другой эффект действует не через связи, а непосредственно через пространство или молекулы растворителя; его называют эффектом поля. Часто очень трудно разделить эти два эффекта, но во многих случаях это было сделано; при этом, как правило, исходили из того факта, что эффект поля зависит от геометрии молекулы, а индуктивный эффект зависит только от природы связей.
| изомер 1 | изомер 2 |

| 
|
| pKa=5.67 | pKa=6.07 |
Например, в показанных выше изомерах 1 и 2 индуктивные эффекты атомов хлора, влияющие на положение электронов в группе СООН (а следовательно, и на кислотность, одинаковы, поскольку между С1 и СООН находятся одни и те же связи, а эффекты поля различны, так как пространственное расположение в изомере 1 таково, что атомы хлора находятся ближе к группе СООН, чем в изомере 2. Сравнение кислотности изомеров 1 и 2 должно показать, действительно ли имеют место эффекты поля. Полученные экспериментальные данные подтвердили, что во многих случаях эффекты поля гораздо более важны, чем индуктивные эффекты. Чаще всего оба типа эффектов рассматривают вместе. Функциональные группы можно классифицировать на электроноакцепторные (–I группы) и электронодонорные (+I-группы) по отношению к водороду.
Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную плотность σ-связи от атома углерода, проявляют отрицательный индуктивный эффект (–I-эффект). Электронодонорные заместители, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект (+I-эффект).
Электронодонорные заместители, т.е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект (+I-эффект). +I-Эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы (метил, этил и т.д.). Большинство функциональных групп проявляют –I-эффект: галогены, аминогруппа, гидроксильная, карбонильная, карбоксильная группы.
Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. Например, в молекуле пропена метильная группа проявляет +I-эффект, поскольку атом углерода в ней находится в sp3-гибридном состоянии, а sp2-гибридизованный атом (при двойной связи) выступает в роли электроноакцептора, так как имеет более высокую электроотрицательность.

|
| пропен |
При передаче индуктивного эффекта метильной группы на двойную связь в первую очередь ее влияние испытывает подвижная π-связь. Смещение ее электронной плотности принято обозначать изогнутой стрелкой, идущей к тому атому, в сторону которого она смещается.
Вопрос 5. Мезомерный эффект (эффект сопряжения)
Другой разновидностью электронных эффектов является мезомерный эффект.
Мезомерный эффект также является результатом перераспределения электронов, которое происходит в ненасыщенных и, особенно, в сопряженных системах с участием их π-орбиталей. Например, свойства карбонильной группы полностью не описываются ни классической формулой (1), ни граничной структурой (2), получаемой путем сдвига π-электронов:
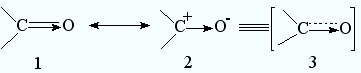
Действительная структура представляет собой нечто промежуточное, т. е. гибрид (3), для которого структура (1) и (2) являются каноническими формами. Здесь также возможен индуктивный эффект, как это показано в структуре (1, 2), но он гораздо меньше, чем мезомерный эффект, поскольку s-электроны намного меньше поляризуются и поэтому менее подвижны, чем π-электроны.
Многие соединения можно адекватно описать структурной формулой, однако для целого ряда других соединений этого недостаточно. Речь идет о соединениях, в которых одна или более связывающих орбиталей принадлежат не только паре атомов, но охватывают три ядра или даже большее число ядер. Такого рода связь называют делокализованной. Поэтому используемый, обычно, химиками способ изображения связей между атомами в виде одной, двух или трех черточек, обозначающих участие в этих связях соответственно двух, четырех или шести электронов, совершенно неудовлетворителен. В действительности в образовании некоторых связей участвуют другие и даже дробные числа электронов. Это можно видеть на примере этаноат-аниона (ацетат-анион), в котором, по данным рентгеноструктурного анализа, атомы кислорода неразличимы, а обе углерод-кислородные связи имеют одинаковые межатомные расстояния, т.е. содержат одинаковое число электронов


Эти трудности привели к тому, что молекулы, структуры которых не могут быть описаны в виде одной классической формулы, стали изображать комбинацией двух или большего числа классических структур, так называемых канонических структур, связанных стрелками с двумя остриями. Путь, по которому одна из этих структур может переходить в другую, часто указывают с помощью изогнутой стрелки, "хвост" которой показывает, откуда движется электронная пара, а ее острие – куда она движется.
Если группа >С=O сопряжена со связью >С=С<, поляризация может передаваться дальше посредством π-электронов, как, например, для 2-бутеналь:

При этом происходит делокализация заряда, что приводит к нехватке электронов на атомах С-З и С-1, как в простом карбонильном соединении. Различие между такой передачей через сопряженную систему и индуктивным эффектом в насыщенной системе состоит в том, что в данном случае при передаче по цепи эффект ослабляется в гораздо меньшей степени, а полярность соседних атомов углерода чередуется.
Стабилизация вследствие делокализации положительного или отрицательного заряда в ионе с участием его π-орбиталей может явиться основным фактором, обусловливающим образование соответствующего иона. Например, стабилизация феноксид-иона вследствие делокализации его заряда с участием делокализованных p-орбиталей ароматического кольца в значительной степени ответственна за кислотные свойства фенола:

Внешне сходная делокализация имеет место и в недиссоциированном феноле с участием неподеленной пары электронов атома кислорода:
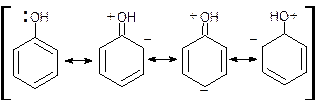
Но в этом случае происходит разделение заряда, вследствие чего такая делокализация будет соответственно менее эффективной, чем при стабилизации феноксид-иона.
Мезомерные эффекты, подобно индуктивным, вызывают поляризацию молекул в их основных состояниях и поэтому сказываются на физических свойствах соединений. Существенное различие между индуктивными и мезомерными эффектами состоит в том, что если индуктивные эффекты могут действовать как в насыщенных, так и в ненасыщенных соединениях, то мезомерные эффекты могут действовать только в ненасыщенных и, особенно, в сопряженных соединениях. Индуктивные эффекты связаны с электронами (σ-связей, а мезомерные-с электронами π-связей и р-орбиталей. Индуктивные эффекты передаются только на сравнительно короткие расстояния в насыщенной цепи, в то время как мезомерные эффекты могут передаваться от одного конца сравнительно больших молекул к другому при условии наличия сопряжения (т. е. делокализованных π-орбиталей).
Сверхсопряжение (гиперконъюгация)
Индуктивный эффект алкильных групп, как и следовало ожидать, уменьшается в ряду:
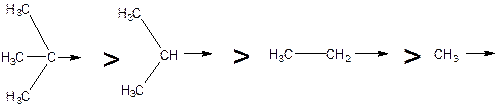
Однако, если алкильные группы связаны с ненасыщенной системой, например с двойной связью или бензольным кольцом, этот порядок нарушается и в случае некоторых сопряженных систем изменяется на обратный. Таким образом, по-видимому, алкильные группы способны при некоторых обстоятельствах вызывать смещение электронов с помощью механизма, отличного от индуктивного эффекта. Это удалось объяснить, расширив понятие сопряжения или мезомерного эффекта и предположив, что делокализация электронов происходит с участием электронов соседних σ-связей:

Этот эффект получил название сверхсопряжения (гиперконъюгации), с его помощью удалось объяснить ряд непонятных ранее явлений. Следует подчеркнуть, что в действительности не происходит отщепление протона или, поскольку, если он переместится из первоначального положения, то одно из условий, необходимых для делокализации, будет нарушено.
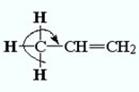
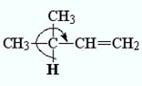
Обращение ожидаемого (индуктивного) ряда электронодонорных свойств (СН3 > МеСН2 > Ме2СН > Ме3С) можно объяснить тем, что эффект гиперконъюгации зависит от наличия атомов водорода, связанных с σ-углеродным атомом ненасыщенной системы. Ясно, что эффект гиперконъюгации должен быть максимальным у СН3-группы и отсутствовать у Ме3С-группы:
| 
| 
| 
|
Эффект гиперконъюгации был использован для объяснения большей термодинамической устойчивости таких алкенов, у которых двойная связь не является концевой, например в 2-метилбутене-2, по сравнению с изомерными соединениями с концевой двойной связью, например 2-метилбутене-1; в 2-метилбутене-2 имеется девять водородных атомов, способных участвовать в гиперконъюгации, а в 2-метилбутене-1-только пять:

| 
|
| 2-метилбутен-2 | 2-метилбутен-1 |
В результате этого преимущественно образуются алкены с неконцевой двойной связью в реакциях, в которых возможно также образование соответствующих изомеров с концевой двойной связью, а также наблюдается очень быстрая изомеризация менее стабильного соединения в более стабильное (2-метилбутен-1 в 2-метилбутен-2).
Вопрос 6. Понятие об ароматичности.(бензол и небензоидные системы).
АРОМАТИЧНОСТЬ (от греч. aroma, род. падеж aromatos - благовоние), понятие, характеризующее совокупность структурных, энергетич. св-в и особенностей реакц. способности циклич. структур с системой сопряженных связей. Термин введен Ф. А. Кекуле (1865) для описания св-в соединений, структурно близких к бензолу - родоначальнику класса ароматических соединении. К числу наиб. важных признаков ароматичности принадлежит склонность ароматич. соед. к замещению, сохраняющему систему сопряженных связей в цикле, а не к присоединению, разрушающему эту систему. Кроме бензола и его производных, такие р-ции характерны для полицикли ч. ароматич. углеводородов (напр., нафталина, антрацена, фенантрена и их производных), а также для изоэлектронных им сопряженных гетероциклич. соединений. Известно, однако, немало соед. (азулен, фульвен и др.), к-рые также легко вступают в р-ции замещения, но не обладают всеми др. признаками ароматичности. Реакц. способность не может служить точной характеристикой ароматичности еще и потому, что она отражает св-ва не только осн. состояния данного соединения, но и переходного состояния (активиров. комплекса) р-ции, в к-рую это соед. вступает. Поэтому более строгие критерии ароматичности связаны с анализом физ. св-в осн. электронных состояний циклич. сопряженных структур. Главная трудность состоит в том, что ароматичность не является экспериментально определяемой характеристикой. Поэтому не существует однозначного критерия для установления степени ароматичности, т.е. степени подобия св-вам бензола. Ниже рассмотрены наиб. важные признаки ароматичности.
Дата добавления: 2016-11-04; просмотров: 1521;










